


Un suivi des opérations est très important pour rendre compte des activités et permettre une analyse ultérieure des succès et des échecs de toute campagne. On peut toujours en tirer des enseignements pour améliorer la sécurité ou l’efficacité des futures opérations mais, très souvent, on ne dispose que de très peu d’informations claires sur le déroulement exact d’opérations réalisées dans le feu de l’action d’une campagne. Il y a beaucoup de données à noter, telles que l’utilisation des carburants et le temps consacré par le personnel aux opérations de lutte mais ce fascicule traitera uniquement de la manière de consigner les données relatives aux opérations de lutte et à leur efficacité.
Chaque organisation a ses propres exigences mais le Formulaire FAO de suivi de la pulvérisation prend en compte les éléments d’information les plus importants (voir Annexe 4.2). Les techniciens et les agents antiacridiens peuvent utiliser des formulaires de ce type pour consigner les détails de chaque opération de lutte. Dans le Formulaire FAO de suivi de la pulvérisation, une colonne spécifique est utilisée pour chaque site traité, qu’il s’agisse d’une bande larvaire, d’un bloc de bandes larvaires ou d’un essaim et quel que soit le mode de transport du pulvérisateur utilisé – manuel, à dos, monté sur véhicule ou équipant un aéronef. Ce formulaire devrait accompagner leu Formulaire FAO de prospection et de lutte contre le Criquet pèlerin (afin d’inclure des détails sur la localité, les précipitations, l’écologie et les Criquets pèlerins) et les deux formulaires devraient être transmis de façon régulière au siège de l’unité antiacridienne nationale pour y être analysé par le Chef de l’unité. Tous les problèmes rencontrés, par exemple, une pénurie de vêtements de protection, un surdosage, une efficacité médiocre, des effets sur les organismes non cibles, peuvent être abordés rapidement avant les prochaines opérations de lutte.
Conseil: si les équipes de lutte antiacridienne utilisent un pesticide qui devrait être épandu à une dose d’1 litre/ha et si la superficie traitée correspond exactement au nombre de litres utilisés, on peut suspecter qu’elle a été calculée à partir de la quantité de pesticide utilisé. Cela n’est pas satisfaisant et, très souvent, la superficie réelle est bien inférieure et il y a eu un surdosage considérable sur cette petite zone. Il faudrait calculer la superficie indépendamment de la quantité de pesticide utilisé en additionnant les superficies estimées de toutes les cibles traitées pendant une journée – voir la méthode permettant d’estimer la zone cible page 49. |
 |
Question fréquemment posée no 13 (voir réponse page 84) Comment trouver le temps de remplir un formulaire de suivi de la pulvérisation alors que tout le temps est consacré à effectuer les traitements? |
Pourquoi faut-il évaluer la mortalité?
|
Techniques d’évaluation de la mortalité | ||
Technique |
Cible |
Moment |
Rapide évaluation visuelle |
Essaims, bandes |
Toujours après un traitement larvaires et criquets épars |
Comptage pré- et post- traitement des effectifs acridiens (évaluation de la densité et de la superficie de la zone-cible) |
Bandes larvaires et criquets épars |
Vérifications ponctuelles, surtout lors de l’utilisation de nouvelles doses ou techniques ou s’il y a des problèmes de lutte |
Évaluation en cages |
Essaims, bandes larvaires et criquets épars |
Comme ci-dessus et surtout si des produits à action lente sont utilisés sur des cibles se déplaçant rapidement |
L’efficacité de la lutte antiacridienne doit être fréquemment évaluée au cours d’une campagne. Il n’est pas nécessaire de le faire de façon précise pour chaque cible mais des vérifications ponctuelles devraient être effectuées quand cela est possible et surtout si on utilise de nouvelles techniques ou de nouveaux insecticides. Cette évaluation a deux objectifs: évaluer s’il est nécessaire de refaire une pulvérisation et vérifier que l’insecticide et la technique de lutte antiacridienne sont efficaces. S’il existe des problèmes de pulvérisation, il faudra y remédier avant que d’autres traitements (peut-être inefficaces) ne soient réalisés. L’équipe d’évaluation doit se rendre sur la zone cible avant le traitement puis quelque temps après pour effectuer le suivi. Cette visite de suivi aura normalement lieu à la fin de la journée de pulvérisation ou le lendemain mais la période à laquelle l’efficacité sera évaluée dépend de la vitesse d’action du pesticide utilisé et cette visite peut être faite plusieurs jours plus tard.
Même avec une pulvérisation excellente, il n’est pas réaliste de s’attendre à une mortalité de 100%. Il existe plusieurs raisons à cela: des acridiens ont été protégés de la pulvérisation par la végétation ou par leurs congénères, les acridiens ne s’alimentent pas juste avant une mue, le dépôt des gouttelettes a été irrégulier à cause de déplacements d’air localisés. Dans la pratique, l’objectif devrait être une mortalité d’au moins 95%.
La plupart du temps, il n’est pas nécessaire d’obtenir un pourcentage de mortalité exact pour les bandes larvaires ou pour les essaims – s’il reste très peu d’acridiens vivants après un traitement, ce n’est pas la peine de passer du temps à les compter. Toutefois, s’il est clair qu’un nombre considérable d’acridiens n’a pas été éliminé lors du traitement, il peut être nécessaire d’estimer le pourcentage de mortalité pour pouvoir évaluer convenablement l’échec du traitement et pour qu’une décision appropriée soit prise.
Il est souvent techniquement difficile de faire une estimation même approximative car les criquets peuvent quitter la zone cible après le traitement. Cela est particulièrement vrai avec des produits à action plus lente qui permettent aux acridiens de se déplacer sur de plus grandes distances avant de mourir. Il existe aussi des difficultés d’ordre pratique car les agents antiacridiens seront probablement occupés à traiter d’autres zones les jours suivants. Des mesures plus précises de mortalité ne peuvent être faites que sur des cibles posées (bandes larvaires ou essaims). Il est très difficile d’évaluer la mortalité des essaims en vol et, dans la pratique, on se limite à vérifier s’il subsiste ou non un essaim significatif un jour ou plus après traitement.
Il existe deux principales démarches pour évaluer la mortalité de cibles posées: les évaluations de terrain et les évaluations en cages. Les évaluations de terrain représentent un véritable test d’efficacité mais elles ne sont pas faciles à réaliser, par exemple si les acridiens se déplacent avant de mourir. Les cages constituent un environnement artificiel mais peuvent néanmoins donner une indication de la mortalité sur le terrain si elles sont utilisées correctement. Un autre avantage est que l’équipe de suivi peut les emporter avec elle lors de ses déplacements sur d’autres sites et obtenir ainsi une estimation approximative de l’efficacité du traitement sur le site précédent.
 |
Question fréquemment posée no 14 (voir réponse page 84) Les Criquets pèlerins sont toujours vivants après le traitement – quelles peuvent être les causes de l’échec du traitement? |
Figure 31. Compter les larves d’une bande selon dix quadrats virtuels.
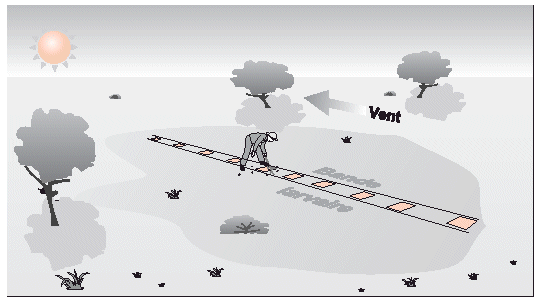
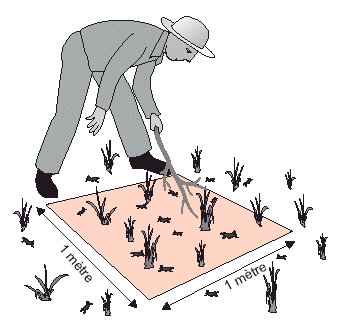
Figure 32. Compter les larves dans un quadrat virtuel de 1 m2.
Des estimations des effectifs acridiens présents avant et après traitement sont faites. Mesurer la superficie de la cible n’est pas suffisant parce que le même nombre d’acridiens occupe une superficie différente à différents moments de la journée. Par exemple, une bande larvaire en déplacement couvre souvent une superficie beaucoup plus vaste qu’une bande larvaire perchée. Les effectifs acridiens sont estimés par mesure de la taille approximative de la cible et de la densité acridienne dans celle-ci.
Une méthode similaire à celle utilisée pour mesurer la taille des bandes larvaires ou des essaims peut être employée: deux transects perpendiculaires sont parcourus à pied ou en véhicule le long des deux côtés de la cible pour mesurer sa longueur et sa largeur et calculer ainsi sa superficie approximative (voir pages 42 et 43 du fascicule intitulé «Prospection»).
La densité larvaire peut être mesurée en parcourant un transect à pied (voir Fig. 31), en réalisant au moins 10 comptages des criquets vivants dans des quadrats de 1 m situés de la cible, puis en faisant la moyenne. Cette technique peut être efficace pour compter les ailés dans un essaim mais seulement s’ils sont immobiles, par exemple quand la température est basse. Après le traitement, il faudra décider des critères permettant de considérer un criquet comme vivant ou mort. D’une façon générale, si un criquet est posé sur le sol ou perché sur la végétation dans une attitude normale, il est vivant. S’il est posé sur le côté ou sur le dos, même s’il n’est pas encore mort, l’effet continu de l’insecticide, la chaleur du soleil ou les fourmis le tueront bientôt. Il est possible que cela ne soit pas le cas avec les pyréthrinoïdes pour lesquels une récupération après effet de choc a été signalée.
Un carré imaginaire d’1 m peut être créé en écartant les pieds pour former un côté d’environ un mètre de long (voir Fig. 32). Il est utile d’avoir un bâton pour remuer la végétation et en faire sortir les criquets qui s’y trouvent. Si les effectifs acridiens sont élevés, on peut se référer à un carré d’1/4 de m2 et multiplier le chiffre obtenu par 4 pour trouver le nombre de criquets par m2. Si les criquets sont très mobiles, il faudra commencer le comptage avant d’atteindre le carré imaginaire car les acridiens sauteront (ou s’envoleront s’il s’agit d’ailés) hors du quadrat avant que l’agent n’arrive. Pour des ailés actifs, la méthode de comptage par transect décrite à la page 15 du fascicule «Prospection» peut être plus appropriée. Toutes ces évaluations sont des estimations dont l’exactitude varie énormément selon le moment de la journée, la mobilité des acridiens et la personne qui effectue le comptage.
Ces deux démarches devraient être réalisées avant le traitement et à un moment approprié après le traitement. Pour les insecticides conventionnels, le comptage post-traitement peut être effectué plusieurs heures après celui-ci. Les problèmes d’évaluation de mortalité sur le terrain sont plus importants avec les produits à action lente tels que les inhibiteurs de croissance et les pesticides biologiques. Les comptages post-traitement devront être faits jusqu’à plusieurs jours après l’épandage et il est possible que les acridiens se soient déplacés pendant cette période. Les techniques utilisant les cages décrites dans les pages suivantes sont plus pratiques pour les produits à action lente et pour les états pendant lesquels les criquets se déplacent rapidement.
Problèmes rencontrés lors de l’évaluation de la mortalité sur le terrain - résumé:
|
Conseils:
|
Étape 1. Calculer la densité acridienne moyenne en additionnant les résultats obtenus dans les dix quadrats et en divisant ce chiffre par 10.
Étape 2. Calculer la superficie de la cible en multipliant sa longueur par sa largeur.
Étape 3. Multiplier la densité moyenne obtenue par comptage dans les quadrats par la superficie de la cible pour obtenir une estimation des effectifs acridiens dans celle-ci.
Étape 4. La mortalité approximative est alors calculée en utilisant la formule suivante:
Formule 4

Si le produit a une action rapide et n’affecte pas trop le comportement des acridiens, il peut être possible d’effectuer une évaluation de la mortalité reposant sur les nombres de criquets morts et vivants. A condition qu’il n’y ait pas trop de cadavres emportés par les fourmis ou de cannibalisme par d’autres acridiens, cette méthode devrait donner un résultat plus précis qu’en comptant seulement les criquets vivants. La même technique des quadrats virtuels est utilisée mais tient alors compte aussi bien des acridiens morts que des vivants. Il faut souligner qu’on n’a généralement pas le temps d’effectuer des évaluations de mortalité aussi précises pendant les opérations de lutte antiacridienne. Si cette méthode est utilisée, la formule suivante permettra de calculer la mortalité:
Formule 5
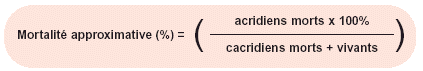
 |
Quand on pénètre à nouveau dans les zones traitées, il faut toujours être vêtu de vêtements de protection, y compris de gants, éviter de boire ou de manger pendant les comptages et toujours se laver et laver les vêtements de protection après les comptages. |
Figure 33. Deux méthodes pour fabriquer des cages: (A) avec des bouteilles en plastique et (B) avec des morceaux de bois et de la gaze.
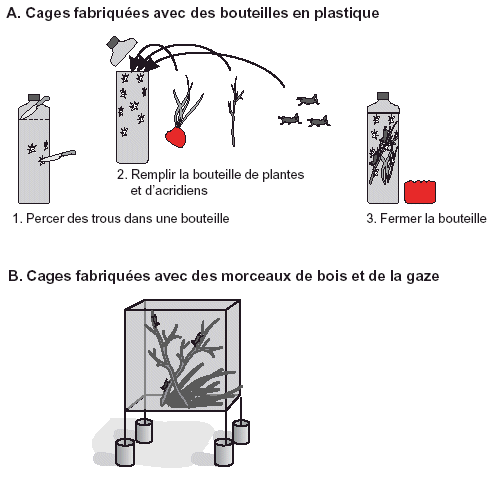
Conseil: les évaluations en cage posent divers problèmes:
|
Des criquets traités et non traités sont mis dans des cages pour voir combien survivent. Ces criquets peuvent être capturés avec un filet fauchoir (à partir d’un véhicule ou à pied) mais il faut veiller à utiliser un filet propre et à ne pas le traîner dans la végétation traitée sinon les criquets recevront une dose d’insecticide supplémentaire à partir du filet. Différents types de cages peuvent être utilisés. Elles peuvent être fabriquées à partir de bouteilles en plastique propres (d’une capacité de 2 litres), par exemple des bouteilles d’eau dont on a coupé le goulot et dans lesquelles on a percé des trous pour la ventilation (voir Fig. 33A). Un carré de gaze (ou de moustiquaire) fixé avec un élastique peut être utilisé à la place du goulot en plastique afin d’empêcher une condensation qui pourrait tuer les acridiens. On peut également fabriquer des cages à partir d’un cadre en bois ou en métal tendu d’une gaze, avec des boîtes en carton (pratiques puisqu’elles peuvent être transportées pliées), avec des seaux en plastique couverts d’un morceau de gaze et avec beaucoup d’autres matériaux (voir Fig. 33B). Il faudra veiller à laisser les cages dans un endroit exposé à la fois au soleil et à l’ombre, à fournir aux criquets de quoi manger et des branchages où se percher, et à empêcher aux fourmis et à d’autres prédateurs d’entrer dans les cages et de manger les criquets. Mettre les montants de la cage dans des pots remplis d’eau ou d’huile tel qu’illustré dans la Fig. 33B. Si les criquets traités se trouvaient sur de la végétation, un peu de cette végétation traitée devra aussi être mise dans la cage – les criquets prennent souvent une dose supplémentaire de pesticide sur le terrain par contact avec la végétation traitée et par ingestion de celle-ci. Si les criquets ont été traités en terrain découvert, de la végétation non traitée devra être mise dans la cage. La même règle s’applique pour les cages témoins contenant les criquets non traités. Si des plantes entières avec un peu de terre sont mises dans la cage et arrosées de temps à autre, la végétation restera fraîche et continuera à pousser jusqu’à ce qu’elle soit consommée.
Des cages de terrain (de même type mais ouvertes à la base) peuvent également être utilisées. On les place directement sur la végétation, sur le terrain, et on y introduit ensuite un certain nombre de criquets. Après traitement, certains chercheurs ont essayé de mettre en place des filets sur des ailés posés sur des buissons.
Il faudra garder un minimum de huit cages. Six cages contiendront des criquets et de la végétation traités et deux des criquets et de la végétation non traités, ces deux dernières servant de témoins. Chaque cage devra contenir plusieurs insectes (le nombre dépendra des dimensions de la cage mais, à titre indicatif, on pourra mettre 5 à 10 insectes par bouteille et 15 à 20 insectes dans une grande cage tendue de gaze). Il faudra compter les criquets morts et vivants à intervalles réguliers après la pulvérisation. Si la mortalité dépasse 10% dans les cages témoins, les résultats ne seront pas fiables car la capture et/ou la mise en cage auront entraîné une mortalité supplémentaire.
Si un grand bloc de bandes larvaires a été traité en barrières, il sera difficile d’évaluer la mortalité de chaque bande larvaire car on ne saura pas quand elle atteint une barrière traitée. Dans ce cas, il est possible d’évaluer la réduction de la surface totale couverte par les bandes larvaires à l’intérieur d’un grand bloc. Cela nécessite un échantillonnage méticuleux avant et après traitement, ce qui est difficile à réaliser durant une campagne de lutte. La méthode d’échantillonnage appropriée à ce cas particulier n’est pas décrite ici mais elle est similaire à la technique d’échantillonnage par point permettant l’évaluation des densités larvaires, décrite page 41 du fascicule intitulé «Prospection».