Les micro-algues unicellulaires marines (figure 12) sont cultivées en écloserie pour servir de nourriture aux coquillages d'intérêt commercial à différents stades de développement. Jusqu'à récemment, ces algues ont constitué la seule source de nourriture pour les larves et les juvéniles des bivalves. Mais cette situation évolue, avec la mise au point, grâce aux recherches récentes, d'un aliment de substitution adéquate. Cependant, la production des algues vivantes restera encore une composante très importante dans le bon fonctionnement d'une écloserie, même si c'est en tant qu'apport supplémentaire à ces nouveaux produits alimentaires.
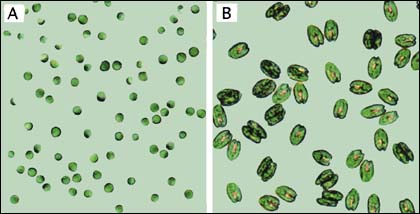
Figure 12: Microphotographies de deux espèces d'algues couramment cultivées en écloserie, Isochrysis sp. (A) et Tetraselmis sp. (B) montrant la différence relative de taille des cellules.
Les espèces de flagellés et de diatomées sont des microalgues qui constituent la base de la chaîne alimentaire marine. Elles produisent des substances organiques nécessaires aux cellules à partir du dioxyde de carbone et des sels nutritifs disponibles dans l'eau de mer en utilisant la lumière comme source d'énergie selon un processus appelé photosynthèse. Elles sont normalement cultivées en écloserie dans une eau de mer naturelle enrichie avec des engrais contenant des nitrates, des phosphates, des éléments traces, des vitamines et du dioxyde de carbone comme source carbonée. L'eau de mer synthétisée peut être utilisée, mais vu son prix élevé son utilisation reste exceptionnelle et à petite échelle.
Le besoin de cultiver les microalgues s'est imposé puisque les concentrations phytoplanctoniques naturellement contenues dans l'eau de mer utilisée en écloserie sont insuffisantes pour assurer une croissance optimale des larves et juvéniles élevés à forte densité. Ainsi et particulièrement pour la culture des larves, les traitements d'eau utilisés éliminent quasiment le phytoplancton naturel qui doit alors être remplacé par des cultures de microalgues sélectionnées pour leur valeur nutritive élevée. Dans ce contexte, et afin d'alimenter convenablement les géniteurs et juvéniles, les espèces microalgales présentant une bonne valeur nutritive pour les bivalves sont rares. De plus, elles ne sont pas toutes artificiellement cultivables, surtout à grande échelle. Le tableau 1 présente une liste des espèces communément utilisées en écloserie de bivalves et leurs paramètres (taille et composition cellulaire).
|
Tableau 1: Volume cellulaire, poids organique et composition en lipides de certaines espèces d'algues, couramment utilisées comme nourriture pour alimenter les larves et naissain de bivalves. Les espèces marquées d'un astérisque * sont relativement pauvres d'un point de vue valeur nutritive. |
|||
|
Espèces: |
Volume cellulaire moyen (µm3) |
Poids organique (µg 10-6 cells) |
Lipides % |
|
Flagellés: |
|||
|
Tetraselmis suecica |
300 |
200 |
6 |
|
Dunaliella tertiolecta* |
170 |
85 |
21 |
|
Isochrysis galbana |
40-50 |
19-24 |
20-24 |
|
Isochrysis (T-ISO) |
|||
|
Pavlova lutherii |
|||
|
Diatomées: |
|||
|
Chaetoceros calcitrans |
35 |
7 |
17 |
|
Chaetoceros gracilis |
80 |
30 |
19 |
|
Thalassiosira pseudonana |
45 |
22 |
24 |
|
Skeletonema costatum |
85 |
29 |
13 |
|
Phaeodactylum tricornutum* |
40 |
23 |
12 |
La culture d'algues représente environ 40 pour cent du coût global de production de naissain d'écloserie de bivalves de 5 mm environ de longueur. A titre d'exemple, un million de juvéniles de palourde japonaise ou d'huître japonaise de 5 mm de longueur et élevées à la température optimale de 24 °C consomment quotidiennement 1 400 litres d'algues fourrage concentrées. Des quantités journalières moins importantes sont nécessaires pour alimenter les géniteurs et les larves de ces deux espèces.
Les méthodes de base de la culture phytoplanctonique ont peu évolué. Les différentes étapes des procédés conduisant aux cultures de production sont présentées dans la figure 13.
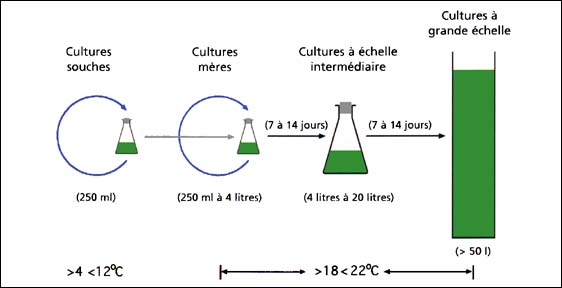
Figure 13: Etapes de production algale. Les souches (250 ml ou moins) sont maintenues séparément sous des conditions contrôlées de lumière et de température (basse) et sont seulement utilisées pour inoculer les souches mères quand c'est nécessaire. Elles ne sont ni aérées ni alimentées en dioxyde de carbone. Les souches mères (250 ml à 4 litres) sont cultivées rapidement pendant 7 à 14 jours à des températures et intensités lumineuses élevées avec un apport d'air enrichi en dioxyde de carbone. Quand la culture est prête, une aliquote est utilisée pour redémarrer une culture et la fraction principale permet d'initier une culture de volume intermédiaire. Les cultures de volume intermédiaire (variant normalement entre 4 et 20 litres) peuvent être utilisées aussi bien pour nourrir les larves que pour commencer les cultures en grand volume. Les cultures en grand volume sont généralement de 50 litres minimum et sont souvent bien plus importants.
Les écloseries optent soit pour une culture intensive close avec éclairage artificiel installé dans des locaux séparés des autres installations ou alors en plein air, quand il s'agit d'une culture extensive en bacs en grands volumes ou en étangs utilisant la lumière naturelle. Les techniques intensives sont satisfaisantes en terme de fiabilité et de productivité, mais sont coûteuses en terme d'équipement et de main d'oeuvre, alors que les méthodes extensives sont plus aléatoires et parfois très peu productives. Les deux méthodes vont être traitées ensembles ci-après, avec l'essentiel des infrastructures et méthodologies nécessaires. Un diagramme schématique du processus de culture phytoplanctonique est présenté dans la figure 14 et un plan d'installation d'un étage d'une écloserie montrant l'espace alloué à la culture algale est présenté dans la figure 5 (section 1.2).
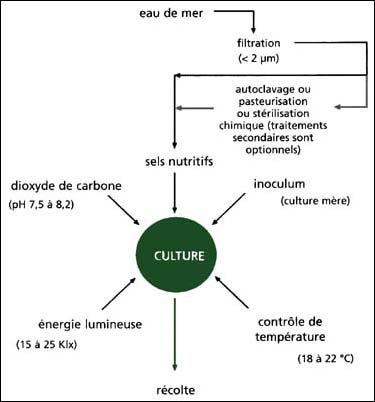
Figure 14: Processus de culture algale montrant les différents intrants nécessaires. Le besoin ou non d'un traitement secondaire d'eau de mer, dépend de l'état de filtration initiale de l'eau.
Les souches, connues sous le nom de stocks, des espèces sélectionnées représentent la base de la culture algale. Ce sont des algues monospecifiques (unialgale) issues de collections réputées et entretenues par des institutions nationales ou des laboratoires de recherche. Comme elles sont précieuses, ces cultures sont normalement maintenues dans des milieux de culture spécifiques. Par exemple, dans le milieu de culture d'Erdschreiber, le milieu F/2 ou sur des géloses d'agar enrichie en nutriment dans des boites de pétri ou en tubes à essai inclinés, dans des conditions contrôlées de température et de lumière. Une partie de la grande salle de culture d'algue est normalement réservée à cette tâche.
Les cultures souches ne sont utilisées que pour fournir des cultures mères (appelées aussi inoculum) quand nécessaire. Un effort constant doit être déployé pour minimiser le risque de contamination des souches et des cultures mères par des organismes compétiteurs. Les procédures de stérilisation décrites ci-dessous doivent être suivies pour éviter toute contamination.
Les souches sont gardées dans des petits récipients transparents pouvant être stérilisés à l'autoclave. Par exemple, des erlenmeyers de 500 ml à fond plat et en verre (borosilicate) ou des ballons fermés avec du coton, pouvant contenir 250 ml de milieu de culture préalablement stérilisé à l'autoclave sont idéals. La composition et la préparation du milieu de culture d'Erdschreiber figurent dans le tableau 2. Les autres milieux de cultures, qui peuvent être utilisés à cette fin, sont le F/2 de Guillard (voir tableau 3) et le HESAW (voir tableau 4). Des produits spécifiques pour l'enrichissement des algues à ajouter à de l'eau de mer correctement filtrée, peuvent être aussi utilisés selon les instructions des fabricants. Souvent les souches sont également maintenues dans de l'eau de mer sur milieu agar à base d'eau de mer enrichie sur boites de pétri ou dans des tubes à essais inclinés.
Les souches sont mieux préservées dans des incubateurs réfrigérés à des températures de 4 à 12 °C (selon les préférences), éclairés par deux lampes fluorescentes de 8 watts (W) ou plus et qui fournissent une intensité lumineuse de 450 lux mesurée à la surface des cultures (figure 15). Les cultures (souches) peuvent être aussi conservées au frais près d'une fenêtre orientée au Nord (c'est-à-dire non exposée à la lumière directe du soleil, ou dans une salle froide éclairée par des lampes fluorescentes. L'objectif ici n'est pas de permettre une croissance rapide, mais de maintenir les cultures dans un bon état physiologique. Les cultures ne sont ni aérées ni alimentées en dioxyde de carbone.

Figure 15: Incubateurs thermostatés illuminés programmables pour le maintien des petits volumes de cultures d'algues.
Pour maintenir les souches (stocks) dans un bon état de santé, il est nécessaire de les repiquer mensuellement. Après avoir enlevé le bouchon (coton) de l'erlenmeyer ou du tube et passé à la flamme l'ouverture du tube au bec bunsen (ou d'une bouteille de camping gaz) un inoculum de 20 à 50 ml est repiqué dans un autre erlenmeyer stérile contenant du milieu de culture, autoclavé. Le bouchon en coton est replacé après avoir passé à la flamme le goulot de l'erlenmeyer. Le nom des espèces, ainsi que la date du transfert, doivent être marqués sur l'erlenmeyer au feutre indélébile qui doit être replacé par la suite dans l'incubateur. La souche originale peut être gardée pendant quelques semaines au cas où la nouvelle culture ne parviendrait pas à croître. Le repiquage est optimisé sous une hotte préalablement stérilisée aux ultraviolets réduisant au maximum le risque de contamination (voir figure 16). Les détails du repiquage sont schématisés dans la hotte ou cabine de transfert montré ci-dessous.
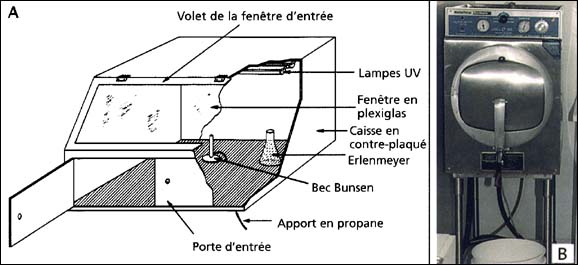
Figure 16: A - Diagramme schématique d'une cabine ou hotte de transfert de culture. B - Autoclave pour la stérilisation de petits volumes du milieu de culture.
|
Tableau 2: Composition et préparation du milieu de culture d'Erdschreiber pour le maintien des souches. |
|
Constituants:
Procédure: Ajouter 100 ml d'extrait de sol (2) à 2 litres d'eau de mer stérilisée (1). Avec une pipette stérile ajouter 2 ml de la solution mère de nitrate/phosphate (3) et 2 ml de la solution mère de silicate (4). Verser 250 ml dans 8 Erlenmeyers vides stérilisés de 500 ml fermés par des bouchons de coton. Utiliser la flamme du bec bunsen ou d'une bouteille de camping gaz pour stériliser les cols des erlenmeyers avant et aussitôt après le repiquage. Le milieu de culture pour le maintien des souches est maintenant prêt à l'emploi. |
|
Procédure pour le transfert des cultures d'algues d'un erlenmeyer à un erlenmeyer
(A partir de Bourne, Hodgson et Whyte, 1989) |
|
Tableau 3: Milieu de culture de Guillard F/2 utilisé pour la culture d'algue en écloserie de bivalves. À partir de Guillard (1975). |
||||
|
1. |
Nitrate |
NaNO3 |
75,0 g par l |
|
|
2. |
Phosphate |
NaH2PO4.H2O |
5,0 g par l |
|
|
3. |
Silicate |
Na2SiO3.9H2O |
30,0 g par l |
|
|
4. |
Métaux traces |
FeCl3.6H2O |
3,5 g |
|
|
Na2EDTA |
4,36 g |
|||
|
Dissoudre dans 900 ml d'eau distillée. Ajouter 1 ml de chaque solution des métaux traces suivants: |
||||
|
CuSO4.5H2O |
0,98 g par 100 ml |
|||
|
ZnSO4.7H2O |
2,20 g par 100 ml |
|||
|
CoCl2.6H2O |
1,00 g par 100 ml |
|||
|
MnCl2.4H2O |
18,00 g par 100 ml |
|||
|
Na2MoO4.2H2O |
0,63 g par 100 ml |
|||
|
Compléter le volume à 1 litre avec de l'eau distillée (pH ca. 2,0). Ajouter 1 ml par litre d'eau de mer filtrée des solutions ci-dessus (numéros 1 à 4). 5. Vitamines |
||||
|
Biotine |
1.0 mg |
|||
|
B12 |
1.0 mg |
|||
|
Thiamine HCl |
20,0 mg |
|||
|
Dissoudre dans 1 litre d'eau distillée. Conserver la solution au congélateur. Ajouter 1/2 ml de la solution des vitamines pour chaque litre d'eau de mer filtrée. |
||||
|
Tableau 4: Milieu de culture HESAW utilisé pour la culture d'algue en écloserie de bivalves. A partir de Harrison et al. (1980). |
||
|
1. |
NaNO3 |
466,7 g |
|
Na2.glycero.P04.5H2O |
66,7 g |
|
|
Dissoudre dans 2 litres d'eau distillée. |
||
|
2. |
Na2EDTA.2H2O |
55,3 g |
|
H3BO3 |
38,0 g |
|
|
Dissoudre dans 1 litre d'eau distillée chaude. |
||
|
3. |
FeCl3.6H2O |
1,6 g |
|
Dissoudre dans 100 ml de H20 distillée. Ajouter 50 ml à la solution n° 1 et le restant à la solution n° 2. Mélanger les solutions n° 1 et n° 2. |
||
|
4. |
MnSO4.H2O |
4,1 g, ou |
|
MnSO4.4H2O |
5,4 g |
|
|
Dissoudre dans 50 ml d'eau distillée. Ajouter à la solution ci-dessus. |
||
|
5. |
Na2MoO4.2H2O |
1,26 g |
|
Dissoudre dans 50 ml d'eau distillée. Ajouter à la solution ci-dessus. |
||
|
6. |
ZnS04.7H2O |
7,3 g |
|
CuS04.7H2O |
1,6 g |
|
|
Dissoudre dans 100 ml d'eau distillée. Ajouter 10 ml de la solution ci-dessus. |
||
|
7. |
Na2SeO3 |
0,173 g |
|
Dissoudre dans 1 litre d'eau distillée. Ajouter 1 ml de la solution à 100 ml d'eau distillée pour préparer une solution mère. Ajouter 10 ml de la solution mère à la solution ci-dessus. Compléter le volume de la solution jusqu'à 10 litres en ajoutant de l'eau distillée. Stériliser le tout à l'autoclave avant utilisation. Ajouter 1 ml de la solution pour chaque litre d'eau de mer filtrée (EMF). |
||
|
8. |
Na2SiO3.5H2O |
224,0 g, ou |
|
Na2Si03.9H2O |
300,0 g |
|
|
Dissoudre dans 1 litre d'eau distillée. Ajouter doucement 1,5 litres d' HCl à 1 Mole (133,5 ml d'HCl concentré dans 1,5 litres d'eau distillée). Compléter le volume de la solution jusqu'à 10 litres en ajoutant de l'eau distillée. Stériliser à l'autoclave avant utilisation. Ajouter 1 ml de la solution pour chaque l d'eau de mer filtrée. |
||
|
9. |
Vitamines |
|
|
(Suivre les instructions pour les vitamines présentées dans le tableau 4). |
||
Les procédures de maintien des cultures mères (inoculum) sont presque identiques à celles décrites antérieurement. Ces cultures sont spécifiquement cultivées pour fournir un inoculum destiné à démarrer de grands volumes de cultures nécessaires à la production de nourriture.
Une lignée de cultures mères est préparée à partir des cultures souches des espèces souhaitées. Les cultures mères, comme les souches, peuvent être cultivées dans des erlenmeyers de 500 ml contenant 250 ml de milieu de culture. Pour satisfaire la demande en inoculum, il est nécessaire de les cultiver rapidement. Par conséquent, les cultures sont conduites à des températures de 18 à 22 °C et placées à une distance de 15-20 cm de lampes fluorescentes de 65 ou 80 W, fournissant une intensité lumineuse de 4 750 à 5 250 lux à la surface des cultures (figure 17). Les cultures mères sont généralement aérées avec un mélange air/dioxyde de carbone (CO2).
Avant d'être utilisées, les cultures mères sont maintenues selon des périodes variables. Dans le cas des diatomées qui ont un temps de division court, cette période est de 3 à 5 jours, alors que pour la majorité des flagellés, elle est de 7 à 14 jours. Quand les cultures mères sont prêtes elles sont transférées dans des conditions stériles, comme décrit antérieurement. Selon les espèces et la densité des cultures, 20 à 50 ml sont transférés dans 250 ml de culture fraîche pour le maintien de la lignée des cultures mères. Le reste est utilisé comme inoculum pour des cultures de plus grands volumes (jusqu'à 25 litres), qui peuvent servir à ce niveau comme nourriture ou être eux-mêmes une étape intermédiaire d'un processus de culture à grande échelle, où elles serviront à leur tour d'inoculum pour de plus grands volumes de culture.
De plus grands volumes de culture sont nécessaires pour inoculer de grands volumes de production. Les cultures de 2 à 25 litres, seront considérées comme étant des cultures de volume intermédiaire. Par exemple, une production d'une culture de 200 litres va être initiée avec une culture mère de 250 ml de l'espèce souhaitée qui va être transférée après croissance dans des volumes de 2 à 4 litres qui serviront également d'inoculum. Au moment de démarrer une culture de 200 litres, 200 à 400 ml issus de cultures en 2 ou 4 litres sont utilisés pour initier une nouvelle culture en 2 ou 4 litres et le reste est transféré pour assurer la production en 200 litres.

Figure 17: Photographies d'équipements classiquement utilisés pour la maintenance des cultures mères.
Pour de grands volumes d'inoculum, il peut être avantageux d'augmenter le niveau d'éclairement et de brassage des cultures avec un mélange air/dioxyde de carbone. Dans le cas des diatomées, il est conseillé de diminuer la salinité du milieu de culture jusqu'à 20 ou 25 PSU (unité pratique de salinité équivalent à parties par mille) pour obtenir de meilleurs taux de croissance. La plupart des espèces de flagellés montrent un optimum de croissance à une salinité de l'ordre de 30 PSU.
La majorité des laboratoires et écloseries qui ont besoin de petits volumes d'algues destinés à la nourriture utilisent des ballons en verre ou des bonbonnes en plastique transparent de volume variable pouvant atteindre 25 litres (figure 18). Ils sont généralement utilisés en «batch» ou semi-continu. Les cultures en batch consistent à inoculer du milieu de culture avec l'espèce souhaitée. Les microalgues croissent rapidement jusqu'à ce que l'augmentation de la densité cellulaire commence à être inhibée par le manque de lumière due à une moins bonne pénétration dans la culture. Cette dernière est alors entièrement récoltée, le récipient lavé et stérilisé pour y réceptionner une nouvelle culture.

Figure 18: Deux différentes approches pour la culture algale à échelle intermédiaire: A - ballon de 20 litres; B - ou utilisation tout aussi efficace de bonbonnes de 15 à 20 litres, utilisées dans la fabrication de vin.
La méthode semi-continue repose sur la même gestion des cultures mères mais au lieu de les récolter intégralement quand elles ont poussé, elles ne sont que partiellement récoltées avant leur limitation par la lumière. Le volume récolté est aussitôt remplacé par un même volume d'eau enrichi avec un milieu de culture fraîchement préparé. Le même processus est répété 2 à 3 jours plus tard et la durée de vie de la culture est ainsi prolongée. Avec certaines espèces tolérantes ou euryèces, par exemple, Tetraselmis suecica, les cultures peuvent être maintenues pendant 3 mois ou plus avec une récolte de 25 à 50 pour cent du volume de la culture 3 fois par semaine. La culture en batch est généralement utilisée pour les espèces délicates et les diatomées à croissance rapide, alors que la culture semi-continue est utilisée principalement pour les espèces tolérantes de flagellés.
La récolte d'une culture en semi continu est opérée en phase exponentielle alors que celle des cultures en batch se déroule en fin de phase exponentielle avant que la culture n'entre en phase stationnaire. Une illustration de ces termes est donnée en figure 19. Dans ce cas, l'espèce cultivée est le grand flagellé vert Tetraselmis.
Au moment de l'inoculation, la densité cellulaire des cultures est de 25 à 50 cellules par ml (cellules par microlitres). Puis ces cellules continuent de croître en se divisant rapidement et en s'acclimatant aux conditions de culture. Cette période d'adaptation, qui dure 2 à 3 jours, est appelée la phase de latence. Une fois habituées aux conditions, le taux de division cellulaire s'accélère et l'augmentation du nombre de cellules dans les cultures est logarithmique. Cette période appelée la «phase de croissance exponentielle» dure 4 à 6 jours. Puis le taux de division cellulaire ralentit quand la pénétration de la lumière dans la culture et/ou les sels nutritifs deviennent des facteurs limitants. La culture entre ensuite en «phase stationnaire», qui peut durer plusieurs jours dans le cas des flagellés mais bien moins chez les diatomées. Les cultures de flagellés restent dans cette phase en recyclant les sels nutritifs à partir des cellules mortes et dégradées, mais dans le cas des diatomées, qui peuvent produire des métabolites d'auto-inhibition favorisant la croissance des bactéries, la culture s'effondre.
La figure 19 montre un exemple de culture en batch de Tetraselmis qui pourrait être récoltée à une densité d'environ 2 000 cellules par ml et à 1 500 cellules par ml en cultures semi-continues. Ces densités peuvent être renforcées soit en en augmentant jusqu'à une certaine limite l'intensité lumineuse des cultures, soit en maintenant le pH entre 7,5 et 8,2 avec un apport contrôlé en CO2 soit en ajoutant un complément de sels nutritifs, dès que la densité des cultures augmente.
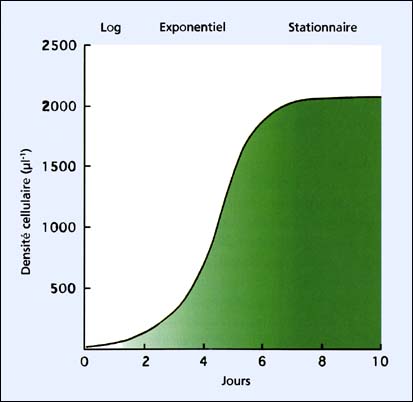
Figure 19: Phases de croissance des cultures d'algues illustrées par une courbe de croissance du grand flagellé vert, Tetraselmis suecica.
La complexité des opérations de culture dépend du besoin en algues et des contraintes financières dans lesquelles le système de production utilisé doit s'insérer. Dans sa forme la plus simple, le système de culture peut être juste une version agrandie des cultures mères, en utilisant des bonbonnes en verre ou ballons à fond plat de 2 à 25 litres. Remplis en partie par le milieu de culture - dans ce cas eau de mer stérilisée et enrichie - ils sont inoculés avec l'espèce choisie et aérée avec un mélange à 2 pour cent de CO2 apporté par un compresseur d'air. Le dioxyde de carbone est fourni par une bouteille de gaz, à pression et à flux réglable, qui assure une source carbonée pour la photosynthèse et la stabilisation du pH entre 7,5 et 8,2. Le mélange air/CO2 est filtré sur cartouche ou membrane de 0,2 mm de porosité, afin d'enlever la plupart des contaminants véhiculés par l'air. Des exemples de ce système sont illustrés dans la figure 18. Le milieu de culture est préparé à partir d'eau de mer filtrée ou stérilisée.
Il existe plusieurs techniques de traitement de l'eau de mer:
a) Filtration sur cartouche ou membrane de 0,22 ou 0,45 mm pour supprimer les bactéries,
b) Pasteurisation séquentielle ou continue à 65-75 °C
c) Passage à l'autoclave à 1,06 kg par cm2 pendant 20 minutes. (Après la stérilisation le milieu doit être réservé dans un récipient hermétique pendant 2 jours).
d) Traitement chimique à l'hypochlorite de sodium à 25 mg par litre de chlore libre, (0,5 ml d'eau de javel ménager à 5 pour cent par litre d'eau de mer filtrée). Avant utilisation, le chlore résiduel libre est neutralisé au thiosulfate de sodium ajouté en excès (solution à 50,0 mg par litre préparée dans de l'eau distillée).
Noter: Les méthodes les plus utilisées pour la préparation des cultures à petite échelle sont (a) et (c), et (b) et (d) pour les cultures à grande échelle après filtration préalable à 1 ou 2 mm.
Après stérilisation, les sels nutritifs sont rajoutés. La procédure détaillée d'enrichissement utilisée au Laboratoire de pêches du Ministère d'agriculture, pêches et alimentation de Conwy au Royaume de Grande Bretagne et d'Irlande du Nord, applicable à toutes les espèces communément cultivées, est consignée dans le tableau 5. Notez que les diatomées nécessitent, en plus des sels nutritifs de base, des silicates (Si). Le milieu est donc prêt à être distribué de façon stérile dans les erlenmeyers, qui sont alors prêts à être inoculés. Depuis ces dernières années plusieurs formulations commerciales d'enrichissement pour les cultures d'algue sont disponibles. Elles sont généralement basées sur la formule de Guillard F/2 et donnent d'excellents résultats de croissance (voir tableaux 3 et 4 pour la formule de base).
Pour obtenir un maximum de productivité pour la plupart des espèces, il est nécessaire de diluer l'eau de mer avec de l'eau douce pure (distillée ou de source non contaminée), avant filtration ou autoclavage. La croissance et le taux de division cellulaire de Chaetoceros calcitrans, Thalassiosira pseudonana et Skeletonema costatum sont optimaux à une salinité d'environ 20 à 25 unité pratique de salinité (PSU) alors que la productivité de nombreux flagellés est optimale à une salinité de 25 à 30 PSU.
|
Tableau 5: Solutions mères nutritives pour l'enrichissement des cultures de diatomées en eau de mer traitée. L'addition de la solution mère C n'est pas nécessaire pour la culture des flagellés. |
||
|
Solution mère A |
||
|
FeCI3.6H20 |
1,30 g* |
|
|
MnCl2.4H20 |
0,36 g |
|
|
H3BO3 |
33,60 g |
|
|
EDTA |
45,00 g |
|
|
NaH2PO4.2H20 |
20,00 g |
|
|
NaNO3 |
100,00 g |
|
|
Solution de métaux trace* |
1,0 ml |
|
|
Eau distillée |
jusqu'à |
1000 ml |
|
Ajouter 2 ml de la solution mère A par litre d'eau de mer filtrée. |
||
|
* Solution de métaux traces |
||
|
ZnCI2 |
2,10 g |
|
|
CoCI2.6H2O |
2,00 g |
|
|
(NH4)6Mo7O24.4H2O |
0,90 g |
|
|
CuS04.6H20 |
2,00 g |
|
|
Eau distillée |
jusqu'à |
100 ml |
|
Ajouter HCI concentrée jusqu'à l'obtention d'une solution limpide. |
||
|
* Quantité pour l'enrichissement de l'eau de mer stérilisée à l'autoclave. Pour de l'eau de mer filtrée utiliser 3,25g. |
||
|
Solution mère B |
||
|
Vitamine B12 (Cyanocobalamine) |
10 mg |
|
|
Vitamin B1 (Thiamine) |
200 mg |
|
|
Eau distillée |
jusqu'à |
200 ml |
|
Ajouter 0,2 ml de la solution mère B par litre d'eau de mer filtrée. |
||
|
Solution mère C |
||
|
Na2SiO3.5H20 |
4,0 g |
|
|
Eau distillée |
jusqu'à |
100 ml |
|
Ajouter 2 ml de la solution mère C par litre d'eau de mer filtrée. |
||
L'éclairage des cultures est assuré par des lampes fluorescentes, placées usuellement à l'extérieur des flacons de culture (voir figure 18). Le nombre de lampes utilisées est déterminé par la hauteur et le diamètre des récipients de culture, avec comme objectif de fournir 15 000 à 25 000 lux mesurés au centre, à vide. Deux lampes de 65 ou 80 W sont suffisantes pour fournir la lumière nécessaire à un récipient en verre de 3 litres, de 18 cm de diamètre environ, alors que 5 lampes de la même nature sont nécessaires pour des récipients de 25 litres (35 cm de diamètre). Pour la plupart des espèces, la croissance optimale est obtenue à des températures variant entre 18 et 22 °C.
Des exemples de densités cellulaires atteintes dans les cultures à petite échelle, pour un nombre d'espèces à forte valeur nutritionnelle, sont présentés dans le tableau 6. Ce sont des valeurs qui ont été obtenues au Laboratoire des pêches, Conwy, représentatives aussi des concentrations classiques atteintes dans d'autres entreprises industrielles. Il est intéressant de noter que des densités cellulaires de Chaetoceros calcitrans, obtenues en culture de 2 litres, sont plus élevées que celles provenant de volumes de 20 litres. Ceci ne signifie nécessairement pas que la productivité en terme de biomasse est plus basse. Chez toutes les espèces de culture, la taille des cellules est variable selon les conditions de culture et la phase de croissance. Chez Chaetoceros, les plus fortes densités cellulaires sont obtenues en cultures de 2 litres, mais les cellules sont plus petites (35 mm 3) comparées à celles atteintes en cultures de 20 litres (50 mm 3). Le poids sec est également plus faible; de l'ordre de 10 mg par million de cellules (microgrammes par millions de cellules) alors que celui-ci est de 18 mg par million de cellules en cultures de 20 litres. D'autres espèces montrent de telles variabilités de taille, selon la densité et les conditions de cultures et qui n'ont rien à voir avec les différences de taille entre espèces.
Par la manipulation des conditions de cultures chez des espèces de grandes tailles, telles que Tetraselmis, il est possible de diminuer la taille des cellules qui deviennent donc plus facilement ingérables par les petites larves. Les cultures à petite échelle peuvent être techniquement améliorées en les traitant comme des chemostats. Mais si l'objectif est de produire uniquement plus de nourriture, la meilleure solution est de se tourner vers des méthodes de culture à grande échelle.
|
Table 6: Densités cellulaires à la récolte (cells µl-1) obtenues en batch dans des cultures à petite échelle (B) et en semi-continue (SC) de 2 litres ou 20 litres chez plusieurs espèces de bonnes valeurs nutritionnelles. La salinité du milieu de culture est aussi donnée. |
||||
|
Espèces |
Conditions de culture |
Récolte densité (cells µl-1) |
||
|
Volume (l) |
Type |
Salinité (PSU) |
||
|
Isochrysis (T-ISO) |
20 |
SC |
25 |
15 000 |
|
Tetraselmis suecica |
20 |
SC |
30 |
2 000 |
|
Chaetoceros calcitrans |
2 |
B |
20 |
60 000 |
|
20 |
B |
20 |
22 000 |
|
|
Thalassiosira pseudonana (3H) |
2 |
B |
20 |
40 000 |
Avant d'entamer les méthodes de culture à grande échelle, une description brève de l'estimation de la densité cellulaire, à tous les stades de culture, paraît judicieuse. Il existe plusieurs méthodes pour estimer la densité cellulaire algale, comme la spectrophotométrie ou la fluorométrie, l'utilisation d'hématimètres, et de compteur de particules «Coulter Counter» («multisizers»).
Un spectrophotomètre ou fluorimètre mesure la chlorophylle á que contient la culture algale et cette méthode permet d'obtenir une approximation rapide de la densité cellulaire. Les graphes comparant les densités cellulaires et les lectures sur l'un des instruments doivent être préparés pour chacune des espèces algales. Cependant, la chlorophylle á présente dans les cellules algales n'est pas constante et varie suivant l'état nutritionnel de la cellule. Ceci affecte la précision de la densité cellulaire estimée selon cette méthode.
Des estimations plus précises de la densité cellulaire peuvent être obtenues en utilisant un hématimètre ou un compteur de particules «Coulter Counter».
Les hématimètres sont des lames épaisses en verre constituées de deux chambres sur la surface externe, mesurant chacune 1,0 x 1,0 mm. Une lamelle spéciale est placée sur les deux chambres ayant une profondeur de 0,1 mm aboutissant à un volume total de 0,1 mm3 pour chacune des chambres. Leur base est gravée d'une grille pour faciliter le comptage des cellules à l'intérieur de l'aire (figure 20). Avant le dénombrement d'espèces mobiles, 1 ou 2 gouttes de formol à 10 pour cent doivent être ajoutées à un échantillon de 10-20 ml de culture à estimer. Avec la lamelle en position, une ou deux gouttes de l'échantillon d'algues sont introduites par le biais d'une pipette Pasteur pour remplir les deux chambres.
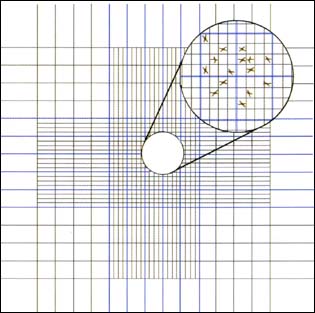
Figure 20: Diagramme de la grille gravée sur un hématimètre.
La densité cellulaire est estimée de la manière suivante. La grille centrale de chacune des chambres (marquée en bleu dans la figure 20) est subdivisée en 25 carreaux (marqué en bleu dans le diagramme). Chaque carreau mesure 0,2 x 0,2 mm et chaque grand carreau est subdivisé en 16 petits carreaux mesurant 0,05 x 0,05 mm chacun. Le nombre de cellules dans 10 carreaux de 0,2 x 0,2 mm choisis au hasard est compté et une moyenne ainsi calculée. Elle correspond à la moyenne du nombre de cellules algales trouvé dans 0,2 mm x 0,2 mm x 0,1 mm ou 0,004 mm3.
|
Exemple:
|
Une méthode simple et précise pour l'estimation de la densité cellulaire est le compteur de particules, appelé «multisizer» actuellement (voir figure 21). Ce compteur a été conçu, à l'origine, pour le comptage des cellules sanguines.
Plusieurs modèles sont disponibles et fonctionnent selon le même principe. Un petit courant électrique passe entre deux électrodes. Chaque fois qu'une cellule passe entre ces deux électrodes, le courant est entravé et la cellule est comptée. La taille de l'ouverture du tube est importante, et pour compter des cellules de taille variant entre 2 et 10 mm, une ouverture de 50 ou 100 mm de diamètre est nécessaire. Un volume connu d'eau est aspiré à travers l'orifice du tube et les cellules sont comptées. Des explications détaillées du fonctionnement du compteur de particules sont disponibles dans la bibliographie sélectionnée qui figure à la fin de ce chapitre.
Puisque les cultures d'algues sont souvent denses, les échantillons doivent être dilués à une densité approximativement 50 000 cells par ml (50 cellules par ml) permettant un comptage précis à l'aide d'un compteur électronique. Les échantillons d'algues sont normalement dilués dans une solution à 3 pour cent de chlorure de sodium (en dissolvant du sel de table dans de l'eau distillée) ou dans de l'eau filtrée sur membrane à 0,45 mm.
|
Exemple: Ajouter 0,2 ml de la culture algale dans 20 ml de NaCl à 3 pour cent. Bien mélanger. Faire 3 comptages pour obtention d'une valeur moyenne. Les comptages individuels = 5 280; 5 336; 5 120. Si le volume de la solution échantillonnée par le compteur de particules est de 0,1 ml, la moyenne sera donc = 5 245 cells par 0,1 ml. Multiplier 5 245 par 10, pour obtenir le nombre de cellules dans 1 ml de l'échantillon, et multiplier par 100 pour corriger le facteur de dilution. Dans cet exemple, la densité cellulaire sera 5 245 x 10 x 100 = 5,2 millions (5,2 x 106) cells par ml. |

Figure 21: Compteur électronique de particules utilisé en écloserie pour le comptage des densités cellulaires des cultures algales. A - un compteur de particules «Coulter Counter»; B - un Multisizer Beckman; C - détails de la chambre de lecture d'un compteur de particules montrant l'orifice du tube inséré dans le récipient de l'échantillon.
Les compteurs électroniques et analyseurs de taille sont coûteux, mais des appareils d'occasion peuvent être achetés à prix raisonnable. Le coût de l'achat est rapidement rentabilisé par le temps économisé et la précision de comptage.
Les écloseries industrielles de bivalves ont besoin de produire quotidiennement de grands volumes de nourriture de bonne qualité, à haute valeur nutritive pour assurer la production de naissain à une échelle économiquement rentable. Des exemples de quelques systèmes, actuellement utilisés en Europe et en Amérique du Nord, sont décrits dans cette section. Ils varient entre des sacs en polyéthylène qui sont soit suspendus ou maintenus dans une gaine recouverte de plastique ou en acier galvanisé et des systèmes électroniques sophistiqués, à savoir des turbidostats. Ces systèmes présentent tous la caractéristique commune d'une culture menée dans un cylindre haut et étroit, cette configuration étant la plus efficace. Les cultures en bacs rectangulaires (figure 22) ou circulaires, avec éclairage suspendu, sont désormais dépassées, à l'exception de certaines écloseries de la côte ouest de l'Amérique du Nord, qui continuent à utiliser des bacs circulaires éclairés par des lampes halogènes métalliques. La productivité la plus élevée est obtenue en plaçant les lampes à l'intérieur des cultures (figure 23) par rapport à des cultures exposées à une rangée de lampes fluorescentes suspendues à l'extérieur.

Figure 22: La culture à grande échelle a longtemps été pratiquée en grand bac, circulaire ou rectangulaire avec éclairage suspendu. Ce gabarit a été largement supplanté par de hauts bacs cylindriques.
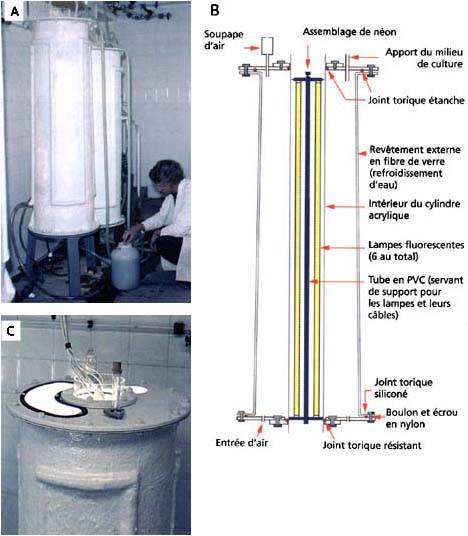
Figure 23: Bacs de culture algale de 200 litres, à éclairage interne et refroidis à l'eau. A - récolte de la culture par siphon. B - détails de fabrication. La surface externe en fibre de verre dispose de tubes de refroidissement moulés à la surface pour aider à dissiper la chaleur provenant des lampes fluorescentes intégrées. C - détail du couvercle du récipient avec son tuyau d'admission du milieu de culture obturé; tuyau d'évacuation d'air garni de coton hydrophile à l'arrière; un accès/volet d'observation montrant par le dessus l'intérieur du cylindre en acrylique. Les câbles de 150 cm de longueur, qui alimentent les 6 lampes fluorescentes, sont protégés dans un tube central en PVC qui sert également de support de fixation pour les lampes.
Le polyéthylène peut être acheté sous forme de rouleau à fort tirant (gaine aplatie et comprimée) de différentes largeurs et de longueur adaptable. En coupant la longueur souhaitée et en soudant un côté à la chaleur, un récipient pour culture stérile, souple peut être fabriqué, soit sous forme d'un cylindre ou d'un sac rectangulaire. Les récipients ainsi conçus peuvent être renforcés en les plaçant dans un cadre en plastique ou en acier galvanisé recouvert de plastique parfois maintenus par un cadre à mailles en acier. Les cylindres peuvent aussi être suspendus, avec ou sans support latéral, si le diamètre du sac est < 30 cm et la hauteur < 200 cm. Des exemples sont présentés dans la figure 24.

Figure 24: Exemples de sac en polyéthylène et type d'éclairage, et de systèmes cylindriques de culture algale en fibre de verre: A - Sacs de 480 litres en polyéthylène maintenus dans des cadres à maille d'acier et sous éclairage naturel dans une serre. B - Sacs de 80 litres suspendus autour d'un axe central grâce à un système rotatif fixé au plafond. Les lampes fluorescentes sont disposées en couronne au centre d'un cadre. C - Maillage en plastique soutenant des sacs rectangulaires en polyéthylène placés de part et d'autre d'une rangée de lampes fluorescentes. D - Type d'éclairage pour des cylindres en fibre de verre de 100 litres, adossés à une rangée de lampes fluorescentes verticales. E - Cylindres en fibre de verre de 2,4 m de hauteur et de 0,3 m de diamètre, éclairés extérieurement par des lampes fluorescentes de 2,4 m de longueur montées verticalement.
Les sacs constituent le moyen le moins coûteux pour la fabrication des récipients destinés aux cultures à grande échelle. Ces derniers peuvent être utilisés aussi bien en intérieur avec un éclairage artificiel ou en extérieur pour profiter de la lumière naturelle. Les sacs de la figure 24A sont formés à partir d'un rouleau à fort tirant autorisant la fabrication de 10 000 cylindres en polyéthylène robuste de 90 cm de largeur. Ils sont maintenus dans des cadres en maille d'acier soudés et calibrés pour une capacité de 480 litres et une vaste aire de 3,2 m2 permettant la pénétration de la lumière. Les grandes cultures de ce type peuvent être éclairées par des lampes fluorescentes de 1,8 m de long et 80 W, montées verticalement ou placées à l'extérieur pour une exposition indirecte à la lumière solaire. Les bacs des figures 24B et C sont fabriqués de la même matière mais sont soutenus par une maille en plastique rigide.
En général, plus le diamètre des ballons de cultures est grand, plus la densité cellulaire est moindre pour une même intensité lumineuse. Néanmoins, ces sacs permettent, pour un volume similaire, une productivité supérieure comparée à celle obtenue en bacs rectangulaires en fibre de verre ou en plastique, qui sont parfois encore utilisés pour les grandes cultures. Cependant, ils sont inefficaces quand ils sont comparés à ceux dont l'éclairage est intégré, comme il ressort des données de biomasse présentées dans le tableau 7.
|
Tableau 7: Comparaison des rendements de Tetraselmis et de Phaeodactylum provenant de différents systèmes de culture algale à grande échelle. Le rendement est calculé en litres par jour pour une densité cellulaire standard par litre de culture. (*système d'illumination intégré). Les références citées sont présentées dans la liste bibliographique qui figure à la fin de ce chapitre. |
||
|
Espèces/Système |
Référence |
Rendement |
|
Tetraselmis |
||
|
80 litres turbidostat* |
Laing & Jones, 1988 |
1,25 |
|
200 litres récipients* |
Laing & Helm, 1981 |
0,40 |
|
340 litres bacs |
Griffith et al., 1973 |
0,12 |
|
Phaeodactylum |
||
|
200 litres récipients* |
Helm & Laing, 1981 |
0,35 |
|
20 litres Erlenmeyer |
Ukeles, 1973 |
0,33 |
|
480 litres sacs en polyéthylène |
Baynes et al., 1979 |
0,15 |
|
195 litres cylindres |
Wisley & Purday, 1961 |
0,06 |
|
* Une valeur de rendement de 1,25 indique une moyenne journalière récoltée de 100 litres à une densité cellulaire standard à partir d'un volume de culture de 80 litres. |
||
Les sacs en polyéthylène ont une vie relativement courte, car la surface interne semble être favorable aux débris et bactéries qui, réunies, réduisent la pénétration de la lumière et présentent une source de contamination. Le renouvellement du sac est nécessaire à la fin de chaque culture. Les sacs de grand diamètre sont inefficaces, contrairement à ceux dont le diamètre est inférieur à 30 cm de par la relation entre la surface et le volume qui favorise une meilleure pénétration de la lumière.
Une solution plus durable basée sur le même type d'éclairage est possible en utilisant une feuille de fibre de verre transparente que l'on plie et colle pour former un cylindre ou en achetant des tubes préformés autorisant une meilleure pénétration de la lumière. Les cylindres dont la hauteur est de 150 à 240 cm et de 30 à 50 cm de diamètre sont les plus utilisés dans les écloseries en Amérique du Nord (figure 24D et E)
Les systèmes de culture à éclairage intégré représentent un investissement onéreux mais sont peu coûteux en fonctionnement. En montant des lampes à l'intérieur d'un cylindre, en fibre de verre ou en plastique transparent (figure 23), la distance requise pour que la lumière pénètre la culture est réduite de manière importante. Dans l'exemple de la figure 23, le bac de culture est de 150 cm de hauteur et 40 cm de diamètre. Le cylindre à éclairage intégré est de 15 cm de diamètre, par conséquent l'énergie lumineuse émise par les 6 lampes fluorescentes de 80 W, et de 150 cm de longueur, ne traverse qu'environ 14 cm du périmètre de la culture. Récemment, cette distance a été réduite par l'utilisation de petits récipients de culture de 80 litres, de même productivité que des cultures de 200 litres.
La productivité (ou rendement) est déterminée comme étant le nombre total des cellules algales récoltées quotidiennement dans une culture. Les cultures à éclairage intégré ont une durée de vie plus longue, dont certaines pour les espèces les plus tolérantes vivent plus de 100 jours. Quand une culture est finie le récipient est stérilisé, par adjonction de 20 à 50 mg par litre (chlore libre) d'une solution d'eau de javel, maintenue en contact pendant au moins une heure. Il est alors abondamment rincé avec de l'eau de mer finement filtrée, puis vidangé et une nouvelle culture est redémarrée.
Les conditions de base de culture sont essentiellement les mêmes que celles décrites auparavant. La différence principale est le traitement de l'eau de mer utilisée comme milieu de culture. La stérilisation par autoclavage ou microfiltration est trop coûteuse pour les grands volumes. L'eau de mer filtrée à travers un filtre à cartouche de 1 à 2 mm est acceptable pour certaines espèces de grande taille, par exemple Tetraselmis et Skeletonema. Sinon, la pasteurisation ou la stérilisation chimique est recommandée. Le contrôle de la salinité et du pH est nécessaire et, pour obtenir un maximum de productivité, l'intensité lumineuse doit être prudemment calculée pour le diamètre du bac de culture.
L'objectif de la gestion des cultures est d'obtenir un rendement phytoplanctonique journalier plus élevé afin que les systèmes de cultures soient économiquement rentables. Ce rendement doit être assurée pendant une longue période pour permettre la production des juvéniles en écloserie. La gestion inefficace des cultures algales influence significativement le potentiel de production de naissain des bivalves et par la suite son prix de vente.
Les cultures semi-continues, avec éclairage intégré seront traitées dans cette section. Les principes généraux sont applicables à n'importe quel équipement et à n'importe quelle production. La relation de base entre la production et l'intensité lumineuse est montrée dans la figure 25. La production est calculée comme étant le nombre de litres d'algues récoltés par jour à la densité cellulaire standard par ml.
L'utilisation du terme densité cellulaire standard nécessite une explication préalable. Pour comparer les rendements entre les différentes espèces dans un même système de culture, un facteur commun basé sur le poids sec des algues récoltées est appliqué. Les algues varient beaucoup en taille et en poids par cellule, comme rapporté dans le tableau 1. Connaissant le poids par cellule, un nombre équivalent de cellules peut être calculé pour chaque espèce pour fournir une biomasse donnée. Pour certaines espèces importantes, cette méthode permet de faire les approximations suivantes:
Sur la base du poids sec: 250 cellules de Chaetoceros calcitrans = 100 cellules d'Isochrysis galbana = 60 cellules de Skeletonema costatum = 10 cellules de Tetraselmis suecica.
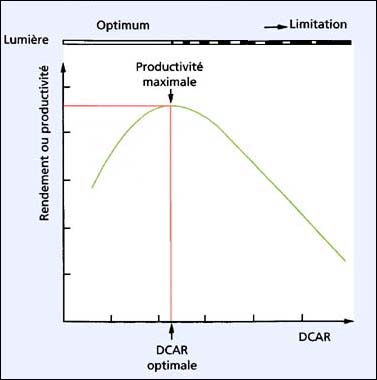
Figure 25: Relation entre la productivité d'un système de culture (rendement) et l'intensité lumineuse. Voir le texte pour explication.
Ainsi pour Skeletonema et Tetraselmis, les densités cellulaires standard utilisées dans le calcul de la production sont de 6 000 et 1 000 cellules par ml respectivement (ou, 6 millions et 1 million de cellules par ml).
Le terme densité cellulaire après récolte (DCAR), nécessite aussi des explications:
DCAR = densité cellulaire par unité de volume (cells par ml) immédiatement après la récolte journalière et le remplacement du volume soutiré par un milieu de culture frais.
C'est la densité cellulaire (suite à la récolte et le rafraîchissement de la culture par un même volume de milieu neuf) relative à l'intensité lumineuse qui influencera largement la croissance de la culture dans les prochaines 24 heures. La figure 25 montre que la production maximale est atteinte pour une DCAR optimale quand l'énergie lumineuse n'est pas limitante. A des valeurs de DCAR inférieures à l'optimum, le taux de la division cellulaire (K), décrite par l'équation:
(Nt = cells par ml à la récolte)
(N0 = DCAR)
est à son maximum mais la DCAR est trop basse pour un maximum de productivité. Au-dessus de la DCAR optimale, la lumière devient progressivement limitante à cause de l'effet d'auto ombrage des cellules dans les cultures à grande densité. La photosynthèse baisse et, par conséquent, le taux de division cellulaire diminue ainsi que les biomasses journalières. La production est maximale à une intensité lumineuse particulière et peut être augmentée ou diminuée en altérant l'énergie lumineuse.
L'effet de l'augmentation de l'intensité lumineuse sur les cultures de 200 litres de Tetraselmis, en remplaçant les 4 lampes fluorescentes de 80 W par 8, est illustré dans la figure 26. Quatre lampes fournissent une intensité lumineuse de 7,6 mW par cm2 (7,6 milliwatts par centimètre carré qui fournit une intensité lumineuse de 28 000 lux) et 8 lampes, une intensité de 14,0 mW par cm2 (52 000 lux). Les productivités maximales augmentent de 67 litres par jour, à 1 000 cells par ml et à 28 000 lux, à 96 litres par jour à la même densité cellulaire sous l'intensité lumineuse la plus élevée. Des améliorations de rendement résultent de l'accélération du taux de division cellulaire, et parce qu'une plus grande intensité lumineuse est apportée, les cultures peuvent être opérées à une DCAR élevée. Les productions obtenues avec 8 ou 6 lampes sont similaires. Ceci, est dû au phénomène de saturation lumineuse affectant les cultures les plus fortement illuminées et, par conséquent, les rendements économiques diminuent à cause du surcoût énergétique des 8 lampes (vs 6).
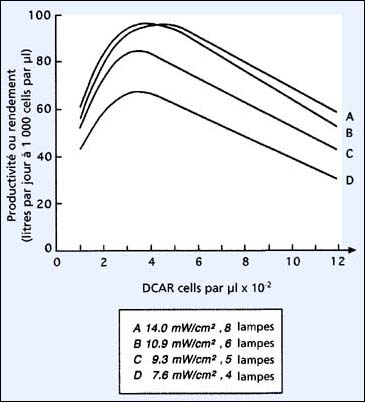
Figure 26: Effet de l'intensité lumineuse sur la productivité de Tetraselmis dans un bac de 200 litres à éclairage intégré.
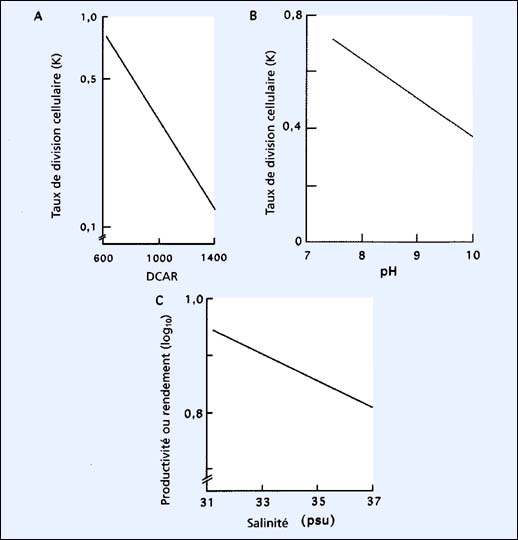
Figure 27: Effet de la densité cellulaire après récolte (DCAR) (A) et du pH (B) sur le taux de division cellulaire, et influence de la salinité sur la productivité des cultures de Tetraselmis suecica (C).
L'influence de la DCAR sur le taux de division cellulaire (K) dans des cultures de 200 litres de Tetraselmis est illustrée dans la figure 27A. L'augmentation de la valeur de la DCAR résulte d'une diminution exponentielle de la valeur de K, puisque la lumière devient progressivement limitante. Les données de la figure 27B et C montrent que les valeurs de K diminuent, et par ailleurs un moindre rendement est noté avec l'augmentation du pH et de la salinité. Ceci démontre le besoin de contrôler ces paramètres en (a), augmentant l'apport en dioxyde de carbone dans le cas d'augmentation de pH et (b), diluant le milieu de culture dans le cas d'une élévation de salinité. Les dispositifs de contrôle de pH, basé sur la variation de l'apport en dioxyde de carbone, sont disponibles chez les fournisseurs d'équipement de matériel aquacole.
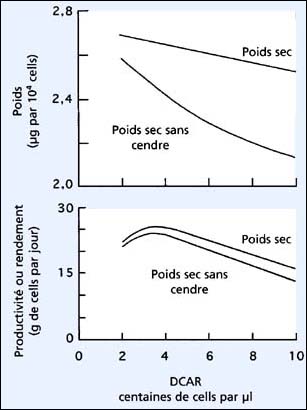
Figure 28: Relations entre densité cellulaire après récolte (DCAR) et la taille cellulaire exprimée en poids, et la productivité de culture en semi-continu de Tetraselmis suecica.
Les techniques de culture, qui améliorent la productivité, peuvent aussi altérer la taille des cellules à la récolte (figure 28). Avec l'augmentation de la DCAR et dès que la lumière devient limitante, les cellules diminuent de taille même quand elles sont estimées par leur poids sec ou organique. Cependant, à l'intérieur des limites normales de fonctionnement de la DCAR, l'effet global sur la productivité maximale, basée sur la biomasse, est moins important.
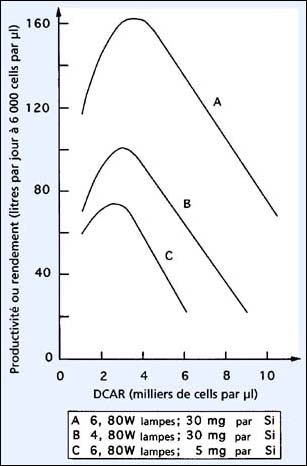
Figure 29: Relations entre densité cellulaire après récolte (DCAR) et densité cellulaire standard de cultures en semi-continu de Skeletonema costatum sous deux intensités lumineuses et deux concentrations de silicates.
La concentration en sels nutritifs du milieu de culture a un effet important sur la productivité maximale des systèmes de cultures à grande échelle. Ceci est illustré dans la figure 29, qui fournit des données sur la culture des diatomées, Skeletonema costatum. Les diatomées exigent du silicate, qui est fourni sous forme de SiO3-Si, pour permettre le développement des frustules de silice qui enveloppent le cytoplasme. Si le silicate est limitant, la croissance des cellules ainsi que le taux de division baissent et les rendements diminuent. Ceci est clairement montré en comparant des cultures, exposées à l'intensité de 6 lampes fluorescentes de 80 W, contenant soit 30 mg par l de Si (figure 29A) soit 5 mg par l de Si (figure 29C). Les cultures à 30 mg par litre de Si, ont atteint une productivité journalière maximale de 160 litres (à partir d'un volume de culture de 200 litres à 6 000 cells par ml), alors que les cultures recevant 5 mg de Si par litre, ne parvenaient qu'à un rendement maximal de 74 litres - moins que celui obtenu avec 4 lampes et à la concentration la plus élevée de Si (figure 29B). La productivité maximale (figure 29) est bien plus forte que celle obtenue dans les cultures de Tetraselmis pourtant produites efficacement et reflète un taux de division cellulaire plus élevé, productivité caractéristique des diatomées.
Jusqu'à présent la discussion a été centrée sur les méthodes de culture en semi-continue. Bien qu'elles exigent moins de personnel que les systèmes de récolte en batch, la maind'oeuvre nécessaire pour les opérations de récolte journalière reste relativement élevée. Par conséquent, il est usuel de ne récolter que toutes les 48 heures. Ceci est possible en conduisant des cultures à une faible DCAR. Néanmoins, la productivité maximale peut être atteinte dans un intervalle de 48 heures avant limitation par la lumière. Il s'agit alors de produire des cultures en continue, c.à.d. des récoltes continues. Cette solution est envisageable si on exerce un contrôle opto-électronique de la densité cellulaire. Un diagramme d'un système automatique développé et utilisé dans le Laboratoire des Pêches, Conwy, GB, est schématisé dans la figure 30.
La composante clé de ce système réside dans une résistance asservie à une cellule photoélectrique fixée à la surface d'un bac de culture transparent. La lumière qui se reflète sur la résistance de la cellule photoélectrique (CPE) après avoir pénétrée la culture, varie selon la densité cellulaire dans la culture. L'éclairage intégré est utilisé de la même façon que dans le système semi-continu à grande échelle antérieurement décrit. Quand la densité cellulaire augmente, la lumière transmise à travers la culture diminue et celle ci augmente la valeur de la résistance de la CPE. Cette augmentation est détectée par une Résistance d'Asservissement (RA) qui va activer une pompe péristaltique quand la valeur préfixée de résistance est atteinte. La RA est ajustée pour fonctionner à l'intensité lumineuse pour laquelle la division cellulaire est à son maximum. Quand elle est activée, la pompe péristaltique fournit du milieu de culture frais dans le bac contenant la culture et un volume égal de culture est transféré dans le bac de récolte. La culture se dilue progressivement et la transmission de la lumière détectée par la CPE augmente, la résistance de la CPE diminue, et la RA éteint la pompe péristaltique.
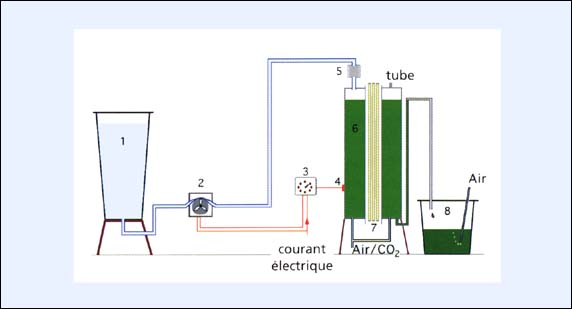
Figure 30: Schéma d'un système de culture en continu («turbidostat») (non représenté à l'échelle). Clés: 1, réservoir d'eau de mer (200 litres); 2, pompe péristaltique; 3, résistance d'asservissement (50 to 5 000 ohms); 4, cellule photoélectrique (ORP 12); 5, filtre à cartouche (0,45 mm); 6, bacs de culture (80 litres); 7, six lampes fluorescentes de 80 W; 8, bac de récolte (125 litres).
La fabrication d'un tel appareil électronique moderne, n'est pas onéreuse et est très efficace pour le maintien des cultures à forte productivité. Les rendements d'un système automatique de 80 litres pour Isochrysis galbana (Clone T-Iso) et Tetraselmis sont similaires à ceux d'unités plus larges de 200 litres opérant en semi-continu. Un rendement maximal d'environ 100 litres par jour à 1 000 cells par ml, est atteint chez Tetraselmis, en faisant fonctionner le système automatique à 2 000 cells par ml environ. Des biomasses, d'environ 90 litres par jour à 10 000 cells par ml, ont été obtenues avec Isochrysis en déclenchant le système à une densité de 16 000 cells par ml.
Le principe des systèmes automatiques n'est pas nouveau. Les chémostats ou turbidostats, qui utilisent la lumière naturelle pour la production des espèces de microalgues, ont été déjà décrits. Le système de Conwy décrit auparavant est une version mise à jour et plus efficace du concept. Des systèmes de culture en continu basés sur des unités de sacs en polyéthylène placés soit verticalement ou horizontalement sont disponibles dans le commerce.
Les cultures arrêteront de croître, deviendront complètement contaminées avec des microorganismes compétiteurs et chuteront même dans les écloseries les mieux gérées. Des méthodes pour vérifier et déterminer la source de telles chutes sont discutées ci-après.
1. Apport en air. Y a t'il suffisamment d'air pour assurer le brassage des cultures? Les cellules sédimentent t-elles au fond des bacs de culture? Cela peut arriver chez certaines espèces de diatomées. Dans ce cas, le débit d'air doit être augmenté. Ce problème ne devrait pas apparaître dans les cultures classiques de flagellés. Si cela arrive, le problème est ailleurs.
2. La température. Vérifier le min/max du thermomètre pour vérifier s'il y a eu diminution ou augmentation dans les installations allouées aux cultures d'algues durant les dernières 24 heures. La majorité des espèces communément cultivées ne tolèrent pas des températures supérieures à 26 °C pendant des périodes prolongées, ni des températures inférieures à 12 °C. Des températures qui varient entre 18 et 22 °C, sont idéales.
3. pH. Vérifier l'apport en CO2. La bouteille du CO2 est-elle vide? Vérifier le pH des cultures algales en utilisant une sonde de pH. Le pH est-il trop élevé (supérieur à 8,5)? ou trop bas (inférieur 7,5)? Ajuster l'apport du CO2 en conséquence.
4. Sels nutritifs. Vérifier les données enregistrées la dernière fois que les cultures ont reçu des sels nutritifs. Ceci est particulièrement important pour les cultures en semi continu.
5. Contamination. Les parois des bacs de cultures, particulièrement au niveau de l'interface eau/air, présentent-elles une espèce de mousse visible ou sont-elles recouvertes d'une sorte de détritus? Si c'est le cas, la culture est à la fin de sa vie et doit être remplacée. Si ce problème persiste dans les premiers stades du cycle de la culture avec des espèces particulières, il faudra alors vérifier si les cultures mères ne contiennent pas de contaminants et les remplacer si c'est nécessaire.
Les espèces ne sont pas toutes cultivables avec succès pendant une saison intégrale. Certaines présentent des fenêtres d'opportunité où elles peuvent être cultivées de façon reproductible. Cependant, il n'existe aucune cohérence absolue entre écloseries quant aux performances de croissance d'une espèce donnée. Ceci doit être le résultat des observations de terrain cumulées ce qui souligne l'importance d'enregistrer minutieusement les données.
Les systèmes de cultures intensives, décrits antérieurement, sont rigoureusement contrôlés et sont très productifs. Ils fournissent de la nourriture pour les larves, les petits juvéniles et les géniteurs maintenus en écloserie. Une alternative, particulièrement adaptée pour la production de nourriture pour les juvéniles de grande taille, est la culture extensive dans des bacs placés en plein air, utilisant la lumière naturelle (figure 31). Cette culture implique l'enrichissement de grands volumes d'eau de mer avec les sels nutritifs de base nécessaires pour la production, à savoir, le nitrogène, le phosphate et le silicate sous une forme ou une autre. Dans ce cas, l'objectif n'est pas nécessairement d'obtenir une floraison monospécifique, mais un mélange de flagellés et diatomées à une densité supérieure à celle qui pourrait se produire normalement en mer.
Il est possible d'induire des floraisons monospécifiques par une filtration préalable fine (<2 mm) de l'eau de mer et l'inoculation de l'espèce demandée, tant qu'elle est vigoureuse. L'utilisation d'eau de mer ou d'eau saumâtre, aspirée à partir d'un puits pourra aussi servir à cette tâche. Cependant, il est difficile de maintenir de tels floraisons pendant de longues périodes parce qu'elles deviennent rapidement contaminées par d'autres microorganismes.

Figure 31: Exemples d'une production d'algue à grande échelle en plein air. A - bacs circulaires, couverts, semi-transparents, en fibre de verre dans une écloserie en Colombie britannique, Canada; B - bassins en béton de 450 000 litres utilisés pour la production de phytoplancton naturel pour la culture de naissain au Laboratoire des Pêches, Conwy, GB; C - de grands bassins en béton avec pente utilisés pour la production d'algues monospécifiques à Turpiolito, Venezuela; D - caisses de poissons en fibre de verre, de 2 500 litres, dans une écloserie en Nouvelle Ecosse, Canada.
Les floraisons multispécifiques sont plus facilement gérables et dépendent du contenu phytoplanctonique existant dans l'eau de mer utilisée comme inoculum. Leur composition varie d'une floraison à une autre, selon la saison et les conditions environnementales. Les algues produites de cette manière présentent une valeur nutritionnelle correcte pour les juvéniles et géniteurs.
Au Laboratoire des pêches, Conwy, des grands bassins extérieurs en béton, d'un volume variant de 60 m3 à 450 m3, ont été utilisés pour assurer une production extensive d'algues destinées à la culture de naissain en nourricerie. Ces bassins sont remplis avec de l'eau de mer, dont la salinité varie entre 28 et 32 PSU, prélevée dans l'estuaire adjacent à 2 semaines d'intervalle approximativement. Dans cette forme de culture, les engrais sont ajoutés 3 jours avant que le bassin ne soit utilisé pour produire des algues comme nourriture pour les juvéniles de bivalves. Les produits chimiques ajoutés sont:
|
Urée NH2CONH2 |
(46% N) |
1,50 g par m3 |
|
Triple superphosphate P2O5 |
(20% P) |
1,56 g par m3 |
|
Métasilicate de sodium Na2SiO3.5H20 |
(13% Si) |
10,60 g par m3 |
Les concentrations sont de 50 mg d'atomes par litre pour les NH2N; de 10 mg atomes par litre pour les PO4-P, et de 50 mg atomes par l pour les SiO3-Si. Plus naturellement, l'utilisation de lisier de volaille ou autres animaux, à 500 kg par hectare pour des bacs et étangs ayant une profondeur d'environ 1 m, peut être efficace et peut constituer une source moins coûteuse de sels nutritifs.
Le taux de développement d'une floraison est lié à la composition initiale de l'espèce et la densité algale présente dans l'eau de mer, à la longueur du jour, à l'intensité lumineuse qui se reflète sur la surface de l'eau, aux concentrations en sels nutritifs et à la température. La relation entre la surface/volume du bac ou étang est importante. Les bacs et les étangs peu profonds (environ 1 m de profondeur) sont plus efficaces que ceux qui sont plus profonds, car ils autorisent une meilleure pénétration de la lumière. L'aération des bacs et des étangs est bénéfique pour les productions.
La durée d'une floraison dépend d'un nombre de facteurs liés aux espèces d'algues dominantes qui se développent et de son degré de consommation par les bivalves. Habituellement, une floraison ayant une densité suffisante pour servir d'alimentation peut être maintenue 7-10 jours, après quoi le bac est vidé, nettoyé et rempli à nouveau avec de l'eau de mer fraîche.
La variété des espèces en floraison peut être manipulée en utilisant différents types d'engrais. Par exemple, en omettant le Si, les espèces de flagellés peuvent dominer parce que le Si naturel contenu dans l'eau de mer et dont les diatomées dépendent diminuera rapidement et sera épuisé. Dans les petits bacs, il est possible d'inoculer l'eau enrichie avec des engrais par une espèce cultivée en systèmes de culture intensive. La dominance ou non de cette espèce dans la floraison dépendra des conditions environnementales et de la présence ou l'absence d'espèces compétitrices. En général, l'utilisation d'engrais chimiques dans l'eau de mer réservée, est une technique précieuse pour la culture des bivalves, particulièrement en nourricerie. Il est souvent possible d'améliorer la production phytoplanctonique par un facteur de 5 ou plus par rapport à celle du milieu naturel (en mer ouverte). Le coût des engrais pour 1 000 litres d'eau de mer est bas, par rapport au bénéfice considérable qui peut être généré par l'augmentation de la valeur commerciale suite à la croissance rapide des juvéniles.
Baynes, S.M., Emerson, L. et Scott, A.P. 1979. Production of algae for use in the rearing of larvae fish. Fish. Res. Tech. Rep., MAFF Direct. Fish. Res., Lowestoft, 53 (3): 13-18
Bourne, N., Hodgson, C.A. et Whyte, J.N.C. 1989. A Manual for Scallop Culture in British Columbia. Canadian Tech. Rep. Fish and Aquatic Sciences, No. 1694: 215 pp.
Droop, M.R., 1975. The chemostat in mariculture. In: G. Persoone and E. Jaspers (eds) Proceedings of the 10th European Symposium on Marine Biology, Ostend, Belgium, 17-23 September 1975. Universa Press, Wetteren, 1: 381-390
Dunstan, W.M. et Menzel, D.W. 1971. Continuous culture of natural populations of phytoplankton in dilute treated sewage effluent. Limnol. Oceanogr. 16: 623-632
Griffith, G.W., Murphy Kenslow, M.A. et Rose, L.A. 1973. A mass culture method for Tetraselmis sp. - a promising food for larval crustaceans. In: J. W. Avault. Jr. (ed) Proceedings of the 4th Annual Workshop of the World Mariculture Society. Louisiana State University, Baton Rouge: 289-294
Guillard, R.L. 1975. Culture of phytoplankton for feeding marine invertebrates, p. 29-60. In: P.B. Smith (ed) Culture of Marine Invertebrates. Plenum Press, New York.
Harrison, P.J., Waters, R.E. et Taylor, F.J.R. 1980. A broad spectrum artificial seawater medium for coastal and open ocean phytoplankton. J. Phycol. 16: 28-35
Helm, M.M., Laing, I. et Jones, E. 1979. The development of a 200 l algal culture vessel at Conwy. Fish. Res. Tech. Rep., MAFF Direct. Fish. Res., Lowestoft, 53 (1): 1-7
Kranck, K. et Milligan, T. 1979. The Use of the Coulter Counter in Studies of Particle Size Distributions in Aquatic Environments. Bedford Inst. Oceanography. Dartmouth, Nova Scotia. Rep. Ser. BI-R-79-7: 48 pp.
Laing, I. 1979. Recommended procedures for the culture of Chaetoceros calcitrans. Fish. Res. Tech. Rep., MAFF Direct. Fish. Res., Lowestoft, 53 (2): 8-12
Laing, I. 1985. Growth response of Chaetoceros calcitrans (Bacillariophyceae) in batch culture to a range of initial silica concentrations. Mar. Biol., 85: 37-41
Laing, I. 1987. The use of artificial diets in rearing bivalve spat. Aquaculture, 65: 243-249
Laing, I. 1990. Nutritional value of dried algae diets for larvae of Manila clam, Tapes philippinarum. J. Mar. Biol. Assoc., UK, 70: 1-12
Laing, I. et Ayala, F. 1987. Commercial mass culture techniques for producing microalgae. p 447-477. In: Akatsuka (ed) Introduction to Applied Phycology. Academic Publishing, The Hague, The Netherlands
Laing, I. et Helm, M.M. 1981a. Cost effective culture of marine unicellular algae. In: F. Vogt (Ed) Energy Conservation and Use of Renewable Energies in the Bio-Industries. Pergammon Press, Oxford: 247-259
Laing, I. et Helm, M.M. 1981b. Factors affecting the semi-continuous production of Tetraselmis suecica (Kylin) Butch. in 200 l vessels. Aquaculture, 22: 137-148
Laing, I. et Jones, E. 1983. Large scale turbidostat culture of marine microalgae. Aquacultural Engineering, 2: 203-212
Laing, I. & Jones, E. 1988. A turbidostat vessel for the continuous culture of marine microalgae. Aquacultural Engineering, 7: 89-96
Langdon, C.J. et Waldock, M.J. 1981. The effect of algal and artificial diets on the growth and fatty acid composition of Crassostrea gigas spat. J. Mar. Biol. Assoc. UK, 61: 431-448
Mann, R. et Ryther, J.H. 1977. Growth of six species of bivalve molluscs in a waste recycling aquaculture system. Aquaculture, 11: 231-245
Roels, O.A., Haines, K.C. et Sunderlin, J.B. 1975. The potential yield of artificial upwelling mariculture. In: G. Persoone and E. Jaspers (eds) Proceedings of the 10th European Symposium on Marine Biology, Ostend, Belgium, 17-23 September 1975. Universa Press, Wetteren, 1: 381-390
Sheldon, R.W. et Parsons, T.R. 1967. A Practical Manual for the Use of the Coulter Counter in Marine Science. Coulter Electronics, Toronto, Ontario: 66 pp.
Spencer, B.E. 1988. Growth and filtration of juvenile oysters in experimental outdoor pumped upwelling systems. Aquaculture, 75: 139-158
Stein, J.R. 1973. Handbook of Phycological Methods: Culture Methods and Growth Measurements. Cambridge University Press, Cambridge, England: 448 pp.
Trotta, P. 1981. A simple and inexpensive system for continuous monoxenic mass culture of marine microalgae. Aquaculture, 22: 383-387
Ukeles, R. 1973a. Continuous culture - a method for the production of unicellular algal foods. In: J.R. Stein (ed), Handbook of Phycological Methods, Culture Methods and Growth Measurements. Cambridge University Press, Cambridge: 233-254
Ukeles, R. 1973b. Cultivation of plants. In: O. Kinne (ed.), Marine Ecology, John Wiley and Sons, New York, NY, Cultivation, 3 (1): 367-466
Walne, P.R. 1970. Studies on the food value of nineteen genera of algae to juvenile bivalves of the genera Ostrea, Crassostrea, Mercenaria, and Mytilus. Fishery Invest., Lond., Ser. 2, 26 (5): 1-62
Webb, K.L. et Chu, F.-L.E. 1983. Phytoplankton as a source of food for bivalve larvae. In: (eds: Pruder, G.D., Langdon, C. & Conklin, D.) Proceedings of the 2nd International Conference on Aquaculture Nutrition: Biochemical and Physiological Approaches to Shellfish Nutrition, October 1981, Rehoboth Beach, Delaware. Louisiana State University Press, Baton Rouge: 272-291
Whyte, J.N.C. 1987. Biochemical composition and energy content of six species of phytoplankton used in mariculture of bivalves. Aquaculture, 60: 231-241
Wisley, B. et Purday, C. 1961. An algal mass culture unit for feeding marine invertebrate larvae. Tech. Pap. Div. Fish. Oceanogr. CSIRO, Australia, 12: 2-12