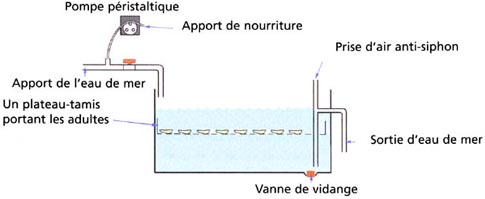
Le conditionnement des géniteurs est une étape essentielle pour l'approvisionnement en larves de bivalves en écloserie (figure 32). C'est une procédure par laquelle les écloseries sont capables d'étendre leur saison de production, sans être dépendant de la brève période de l'année au cours de laquelle les adultes des espèces d'intérêt sont matures. Les écloseries situées dans des climats rigoureux ont l'avantage de produire du naissain précoce - en avance de plusieurs mois avant que les géniteurs ne soient matures en mer.
La production en début de saison, dans les climats froids, assure au naissain une période de croissance maximale avant de connaître leur premier hiver difficile. De ce fait, ils sont plus grands et résistants aux faibles températures. Cela peut s'avérer avantageux pour la culture d'espèces exotiques où le petit naissain n'est pas aussi résistant au froid que les espèces natives à tailles similaires. Le conditionnement en écloserie peut être également pertinent lorsque des espèces exotiques sont introduites mais sont incapables de se reproduire dans leur nouvel habitat.

Figure 32: Un système classique de conditionnement de géniteurs.
De nombreux bivalves maturent en tant que mâles au cours de leur première année. Avec l'âge et, année après année, un pourcentage important de bivalves peuvent changer de sexe et deviennent femelles. Il s'agit de l'hermaphrodisme protandrique. Parmi les espèces, communément cultivées en écloserie, qui présentent cette forme de protandrie et de développement sexuel on trouve les palourdes du genre Tapes, Mercenaria, Mya et Spisula, les huîtres du genre Crassostrea et plusieurs types de moules incluant Mytilus sp. et Perna sp.
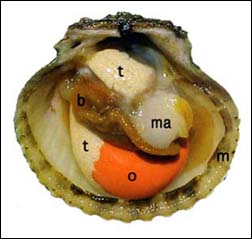
Figure 33: L'anatomie d'un pétoncle calico pleinement mature (Argopecten gibbus): ma - muscle adducteur; b - branchies (soulevées pour faire apparaître la gonade); m - manteau; o - ovaire; t - testicule.
Certaines espèces de bivalves fonctionnent véritablement comme des individus hermaphrodites. Elles développent simultanément les deux gonades mâle et femelle (figure 33). Les gamètes sont émis d'une manière séquentielle, normalement le sperme en premier puis les ovocytes, et de nouveau le sperme et ce au cours d'un même cycle de reproduction. Ce groupe d'espèces monoïques comprend la coquille Saint-Jacques de l'Europe du Nord Pecten maximus, la coquille Saint-Jacques de sable du Brésil et des Caraïbes, Pecten (Euvola) ziczac, le pétoncle de baie, Argopecten irradians, le pétoncle calico, Argopecten gibbus et le pétoncle du Chili, Argopecten purpuratus, et certaines espèces de Chlamys. Les sexes sont séparés (dioïque) chez d'autres pectinidés de grandes tailles, par exemple Placopecten magellanicus et Patinopecten yessoensis.
Chez les huîtres plates du genre Ostrea et Tiostrea, la sexualité est alternée. Elles inversent leur sexe à la fin de chaque cycle de reproduction. Une seule huître européenne (Ostrea edulis) peut passer à travers deux ou trois inversions sexuelles au cours de chaque saison de reproduction, et cela, quand suffisamment de nourriture est disponible et au cours d'une période prolongée de rechauffement thermique.
|
Le conditionnement d'un cas historique - la palourde japonaise, Tapes philippinarum
Figure 34: Une sélection de palourdes communément cultivées en écloserie. Noter que la nomenclature du genre Tapes est synonyme de Venerupis et Ruditapes dans les écloseries en Europe; ainsi, la palourde japonaise peut se référer à Tapes ou Venerupis ou Ruditapes philippinarum (avec semi decussatus ou semi decussata comme autres noms spécifiques). La nomenclature est également confondue pour d'autres bivalves communs. Pour la palourde japonaise (figure 34), comme pour d'autres bivalves, la production d'ovocytes augmente avec la taille des individus. Des femelles matures de 10-20 g de poids frais émettront en moyenne 5-8 millions d'ovocytes suivant les conditions de maturation et la période de l'année au cours de laquelle elles ont été conditionnées. Des populations de 2 à 3 ans montrent un sexe ratio proche de 50:50. Par exemple, à partir de 138 palourdes conditionnées, soumises à des tests de stimulation de la ponte au Laboratoire des Pêches MAFF, Conwy, GB, en 1987, 54 individus ont pondu en tant que femelles et 55 en tant que mâles. Les 29 palourdes restantes n'ont pas réussi à émettre leurs gamètes et n'étaient probablement pas encore matures. Le développement sexuel commence en mer quand la température de l'eau dépasse 10 °C. Les gamètes se développent vers la fin du mois de mai ou juin et deviennent matures en juillet ou en août, et sont retenus jusqu'à ce que la ponte soit provoquée par des températures élevées (>20 °C), par une succession de chocs thermiques ou de manipulations. Dans les eaux nord-européennes, où les températures sont rarement élevées pour déclencher la ponte, les gamètes matures sont retenus en début de l'hiver et par la suite résorbés. La maturité peut être accélérée en écloserie en maintenant les palourdes dans des températures élevées et en leur fournissant une ration alimentaire adéquate. Il est possible de maturer les adultes en hiver et en début de printemps, avant que les palourdes n'amorcent leur développement sexuel en pleine mer et de cette façon, la période de production larvaire en écloserie est prolongée. Des palourdes prêtes à pondre peuvent ainsi être disponibles presque toute l'année. Pour obtenir une ponte en automne il est possible de maturer les juvéniles à partir du début de cette même saison en les conditionnant à des températures et des rations alimentaires élevées. |
Généralement les bivalves de climat tempéré présentent deux périodes de ponte durant l'année suivant les pics de production phytoplanctonique qui se produisent au printemps et en automne. Les espèces tropicales montrent des phases de ponte moins marquées. Celle ci a lieu quasiment toute l'année avec un faible pourcentage d'adultes atteignant la maturité à n'importe quel moment. Cette particularité pose des problèmes pour les écloseries tropicales puisque plusieurs individus seront vides (c'est-à-dire qui ont récemment pondus) ou dans les premiers stades de développement sexuel quand le stock est amené à l'écloserie. Ceci constitue une perte de temps, d'espace et de ressources alimentaires. Il existe cependant des méthodes pour synchroniser le développement gonadique des géniteurs (voir section 4.1.3).
Les méthodes de base pour le conditionnement des géniteurs sont similaires chez tous les bivalves. Il est courant pour une écloserie d'assurer le maintien de son propre stock pour autoriser des productions larvaires dans des conditions proches d'un grossissement en mer. Ces stocks sont maintenus dans les meilleures conditions possibles avec débit d'eau élevé et à faibles densités dans des installations bien entretenues. Ce sont souvent les descendants des générations antérieures élevées dans l'écloserie, sélectionnés pour leurs caractéristiques comme le taux de croissance, la forme de la coquille et la coloration.
A. Bac de géniteurs à flux ouvert
B. Un bac similaire équipé d'un filtre à gravier
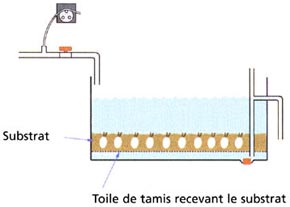
Figure 35: Représentation schématique de A - Bac à flux ouvert de géniteurs dans lequel les adultes sont suspendus sur des plateaux à grand maillage pour éviter que les fèces et les détritus ne s'accumulent dans le bac; B - Un bac similaire équipé pour permettre une filtration sur gravier. Les systèmes de type A sont adaptables pour la plupart des espèces qui n'exigent pas de substrat. Le conditionnement d'espèces de palourdes et de certains pectinidés se déroule mieux dans des bacs de type B.
Les adultes récupérés en mer sont transférés à l'écloserie. Après avoir bien frotté et rincé leurs coquilles pour enlever l'épifaune (fouling) et le sédiment, ils sont placés dans des bacs similaires que ceux schématisés dans la figure 35 (voir aussi figure 32). Les palourdes et certaines espèces de pectinidés (par exemple Pecten ziczac) qui vivent normalement partiellement enfouies dans le substrat naturel, se nourrissent plus efficacement quand elles sont gardées sur un fond adapté. Dans les bacs du genre illustré, les palourdes ou les pectinidés sont enfouies dans un lit de sable grossier ou de gravier coquiller de 10 cm, ou à une profondeur suffisante de substrat au-dessus d'un filtre à sable (figure 35B). Les plateaux sont éloignés du fond du bac de conditionnement quand ils contiennent des bivalves qui n'exigent pas de substrat, par exemple les huîtres, les moules et certaines espèces de pectinidés (figures 35A et 36).
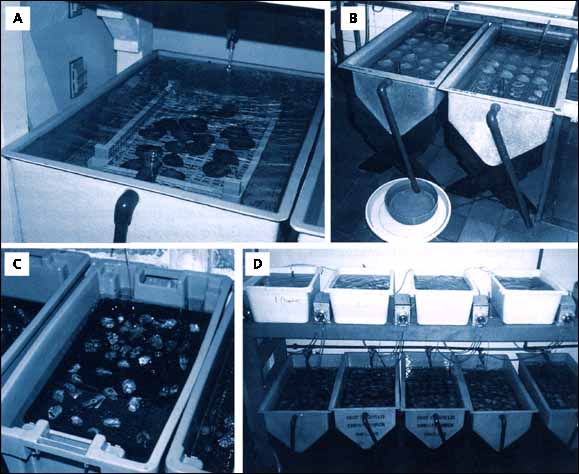
Figure 36: de A à D - Différents exemples de types variés de bacs à flux ouvert utilisés pour le conditionnement de géniteurs. Le plateau à la sortie du flux d'eau dans B - contient un tamis, utilisé pour retenir les larves de l'huître plate européenne qui seraient sinon perdues dans l'eau de vidange dès leur expulsion. C et D - Système expérimental où chaque bac de géniteurs reçoit un régime alimentaire spécifique par l'intermédiaire d'une pompe péristaltique connectée à un réservoir placé juste à côté.
L'eau de mer utilisée n'est pas nécessairement filtrée: la diversité des espèces d'algues présente dans l'eau de mer non filtrée est bénéfique pour le processus de conditionnement. Mais en revanche, il est possible que les géniteurs soient exposés à des parasites ou à des microorganismes potentiellement pathogènes présents dans l'eau de mer, et l'économie ainsi réalisée en évitant la filtration de l'eau l'emporte souvent sur le risque de contamination. Dans la plupart des cas, le conditionnement a lieu dans des systèmes d'eau à flux ouvert, qui peut contenir ou pas un élément de re-circulation d'eau pour pouvoir récupérer les algues de culture ajoutées en tant que nourriture.
Il est possible de conditionner les bivalves dans des systèmes de re-circulation où la biomasse totale (poids total - coquille inclue - de tous les animaux dans le bac) n'excède pas 2 ou 3 g par litre. Dans ce cas, il est recommandé de vider et remplir le volume total d'eau dans le système au moins deux fois par semaine pour éviter la prolifération des bactéries et l'accumulation des métabolites.
Aussi bien la température que la salinité, doivent être appropriées aux espèces en conditionnement. La plupart des espèces de bivalves classiquement cultivées présentent une maturation de gamètes à des salinités supérieures à 25 PSU (unité pratique de salinité, équivalente à parties par mille) et à des températures variant entre 16 et 24 °C. Cependant, chaque espèce a un preferendum pour ces deux paramètres. Par exemple, la palourde japonaise et l'huître du Pacifique, répondent mieux à des températures d'eau variant entre 22 et 24 °C. Les huîtres du Pacifique peuvent être conditionnées dans une gamme assez large de salinités (de 15 à 34 PSU), alors que la palourde japonaise préfère des salinités élevées variant entre 25 et 34 PSU avec un optimum de 30 PSU. L'huître américaine (de Virginie), Crassostrea virginica, a besoin d'être conditionnée à des salinités beaucoup plus basses. Comme on pouvait s'y attendre, les espèces des eaux profondes nécessitent des températures plus froides et des salinités voisines de celles de l'océan.
Le débit d'eau pour le conditionnement doit excéder 25 ml par minute par adulte et la biomasse du stock maintenu dans un bac de 120 à 150 litres ne doit pas dépasser 5 kg (figure 37). L'eau ne doit pas être recyclée ni réutilisée dans de tels petits bacs à forte charge. Quand des bivalves provenant de sites éloignés sont utilisés comme géniteurs, les effluents des bacs de conditionnement doivent être déversés dans des bacs de traitement pour éviter tout transfert de pathogènes et de parasites dans l'environnement proche. Les effluents doivent être traités avec du chlore libre à des concentrations >100 mg par litre ou un produit similaire et efficace de désinfection/stérilisation (par exemple ozone) pendant une période minimale de 24 heures (préférablement 48 heures) avant d'être rejetés en mer.

Figure 37: Un bac de conditionnement de géniteurs de 120 litres contenant 55 huîtres dont le poids total moyen est de 80 g. Pour un stock d'une telle densité le débit minimum de l'eau de mer enrichie, est de 1 375 litres par minute.
Les écloseries disposent normalement d'une salle pour le conditionnement des géniteurs ou un endroit calme dans les installations où les bacs de conditionnement sont installés loin des perturbations fréquentes. La plupart des espèces réagissent aux ombres et aux vibrations en fermant les valves de leurs coquilles. Lorsqu'ils sont peu dérangés les géniteurs consacrent plus de temps à se nourrir.
Les petites et moyennes écloseries disposent normalement de 5 à 20 bacs de conditionnement pour élever les différentes espèces et permettre l'introduction régulière d'un nouveau stock pour assurer une rotation des géniteurs et un approvisionnement continu en larves. Les grandes écloseries peuvent avoir plus de bacs de petites tailles ou quelques-uns de grandes tailles. Quand une production régulière de naissain d'une espèce particulière est demandée pendant une période prolongée de l'année, un nouveau stock est entré dans l'écloserie pour démarrer le processus de conditionnement sur une base hebdomadaire ou bimensuelle. De cette manière, des adultes sont prêts à pondre chaque semaine.
Les espèces d'algues marines cultivées sont les plus fréquemment utilisées comme principale source de nourriture pendant la phase de conditionnement. Les sources alternatives sont le phytoplancton naturel cultivé extensivement dans des bacs ou étangs en plein air, ou des pâtes d'algues disponibles dans le commerce.
Les espèces d'algues d'intérêt qui peuvent être cultivées intensivement à grande échelle sont Tetraselmis (espèces variées, incluant T. chuii, T. tetrahele et T. suecica), Isochrysis galbana (et le clone T-Iso), Pavlova lutherii, Chaetoceros muelleri (antérieurement nommée C. gracilis), Thalassiosira pseudonana et T. weisfloggii et Skeletonema costatum. (Cette liste n'est en aucun cas exhaustive). Un mélange de ces espèces, sur une base proportionnelle, est plus bénéfique qu'un régime alimentaire basé sur une seule espèce d'algue. Il est recommandé de ne pas nourrir avec des espèces relativement indigestes (par exemple Chlorella sp.) ou des espèces connues par leur manque en acides gras insaturés (par exemple Dunaliella tertiolecta).
Un exemple des conséquences de l'utilisation d'un régime déficient est la moindre production de larves d'Ostrea edulis quand les géniteurs sont maintenus dans de l'eau filtrée et uniquement nourris par Dunaliella tertiolecta (tableau 8). Dunaliella est une espèce qui ne contient pas les acides gras insaturés C20 et C22 considérés comme étant essentiels, d'un point de vue nutritionnel. Dans cet essai, un groupe de 60 adultes a été gardé dans des bacs à système ouvert, avec de l'eau de mer non filtrée ou filtrée à 2 mm. (Les bacs expérimentaux sont illustrés en bas du côté droit de la photo de la figure 36D.) Une ration journalière de 3 pour cent basée sur le poids sec de chair des huîtres a été fournie à trois groupes. Dunaliella a été apportée seule ou en association avec Tetraselmis suecica ou T-Iso. Les groupes témoins ont été gardés aussi bien dans de l'eau de mer filtrée que dans de l'eau de mer non filtrée sans addition de culture d'algues.
|
Tableau 8. Effet du régime alimentaire sur la production de larves d'Ostrea edulis. Clé: Eau de mer (EM) traitement, F et NF font référence à l'eau de mer filtrée et non filtrée respectivement; Régime, Dt - Dunaliella tertiolecta, Ts - Tetraselmis suecica, T-Iso - Isochrysis galbana (Clone T-ISO). Jours - fait référence au nombre de jours à partir du début de conditionnement jusqu'à la libération des premières larves. Total larves est le nombre de larves produit par chaque groupe d'adultes pendant une période de 70 jours et cette valeur divisée par le nombre d'adultes dans le groupe se traduit par le nombre de larves/huître. A partir de Millican et Helm (1994). Voir le texte pour plus de détails. |
||||
|
Traitement EM |
Régime |
Jours |
Total larve |
Larve/huître |
|
F |
Rien |
35 |
1,16 |
19 367 |
|
F |
Dt |
49 |
0,65 |
10 280 |
|
F |
Dt + Ts |
31 |
3,00 |
49 950 |
|
F |
Dt + T-Iso |
32 |
4,70 |
78 250 |
|
UF |
Rien |
33 |
8,12 |
135 317 |
Le temps écoulé entre le début du conditionnement et la libération des premières larves dans chaque groupe a été noté et les larves émises ont été dénombrées chaque jour durant une période de 10 semaines correspondant à la durée de l'essai. Les résultats présentés dans le tableau 8 montrent que chez les espèces dont le régime alimentaire est composé d'une seule espèce de Dunaliella il y a un retard dans la production larvaire, également moins importante que celle liée aux autres traitements. Il est intéressant de noter qu'un nombre considérablement élevé de larves a été libéré par des huîtres adultes maintenues dans de l'eau de mer non filtrée sans addition d'algues comparé à celui obtenu à partir d'individus qui ont subit d'autres traitements. Ceci renforce ce qui a été précisé antérieurement c'est à dire qu'il peut être bénéfique d'un point de vue économique d'utiliser de l'eau de mer non filtrée pour le conditionnement.
La durée de l'essai décrit ci-dessus inclut la floraison phytoplanctonique printanière quand la chlorophylle á dans l'eau de mer non filtrée témoin, est de 1,68 mg par m3 vs 0,35 mg par m3 dans l'eau de mer filtrée témoin. En moyenne, les teneurs en particules lipidiques sont de 62 ng par litre (nanogramme par litre) vs 9,7 ng par litre respectivement.
Les méthodes pour les deux types de culture algale, intensive et extensive, sont décrites dans le chapitre 3 de ce manuel. Les étapes de calcul de la ration alimentaire nécessaire sont détaillées ultérieurement dans la section 4.1.2.3. Le calcul ne peut cependant pas s'appliquer aux cultures extensives où la diversité des espèces, l'abondance et les valeurs nutritionnelles fluctuent de jour en jour. Dans ce cas, une approximation de l'abondance peut être faite par détermination du poids sec sans cendre de la matière particulaire par unité de volume ou par des analyses de carbone organique. Ou alors, l'opérateur peut diluer l'eau de mer enrichie «au juger» pour apporter une ration adéquate.
Les pâtes des différentes espèces d'algues d'intérêt nutritionnel, sont pratiques à utiliser et les fournisseurs apportent des informations sur le nombre équivalent de cellules par unité de volume du produit. Le contenu des principaux constituants nutritionnels de plusieurs de ces produits est souvent détaillé sur l'emballage. Une fois ouverts, les produits inertes ont une durée de vie relativement longue quand les instructions des fabricants sont rigoureusement respectées. De telles pâtes sont probablement mieux adaptées aux systèmes de conditionnement à flux ouvert et une attention particulière doit être portée à l'hygiène des bacs.
Une ration alimentaire de bonne valeur nutritive durant le conditionnement a un effet bénéfique considérable sur la production d'ovocytes.
La ration alimentaire nécessaire au conditionnement est basée sur le poids sec de chair des adultes. Elle varie normalement entre 2 à 4 pour cent du poids sec moyen de chair des adultes au début de conditionnement en poids sec d'algues apportées quotidiennement. Les rations excédant 6 pour cent ne sont pas favorables à un bon conditionnement: les bivalves vont croître fortement en réponse à des niveaux d'alimentation et température de conditionnement élevés au dépend du développement gonadique.
Il est facile de déterminer le poids sec de chair d'un stock de bivalves à conditionner dont le poids frais total est connu à son arrivée à l'écloserie. L'ouverture d'un échantillon de 10 ou 12 individus sélectionnés au hasard, l'extraction des tissus mous et leur pesée après séchage à l'étuve jusqu'à obtention d'un poids constant (60 à 80 °C pendant 48 à 72 heures), fourniront les données pour le calcul de la ration. L'équation ci-après permettra de déterminer le poids sec nécessaire d'algues par adulte pour une ration journalière de 3 pour cent.
Ration g par jour par adulte = 3 x moyenne poids sec chair (g)/100
Ainsi, une ration de 3 pour cent pour un adulte de 0,75 g de poids sec est de 0,0225 g de poids sec d'algues par jour. Des données relatives au poids sec des différentes espèces d'algues sont présentées dans le tableau 1 de la section 3.1. et montrent qu'1 million de cellules de Tetraselmis ont un poids sec (organique) de 0,2 mg.
En supposant, que 50 pour cent des 3 pour cent de la ration journalière (= 1,5 pour cent) fournie aux géniteurs est l'algue Tetraselmis et que le poids sec total de chair du stock est de 50 g (convertis en mg dans l'équation en dessous), on a alors:
|
|
Ration (1,5%) par jour (en millions de cells) |
= [(1,5x (50x1 000))/100]/0,2 |
|
|
= 3 750 millions de cells |
|
Si, par exemple, la densité de récolte de Tetraselmis à un jour donné est de 1,5 millions de cells par ml, le volume nécessaire pour nourrir le stock avec une ration de 1,5 pour cent, sera de 3 750/1,5 = 2 500 ml, ou 2,5 litres. Le calcul du reste de la ration est similaire pour les autres espèces constituant le régime. Si au lieu de, ou en addition à Tetraselmis, Chaetoceros muelleri est utilisée comme aliment à une densité de récolte de 7 millions cells par ml, le volume nécessaire pour une ration de 1,5 pour cent sera 3,57 litres. Chaetoceros muelleri a un poids sec approximatif de 0,03 mg par million de cellules.
En calculant la ration, la configuration des bacs et le système dans lequel les adultes sont conditionnés doivent être pris en compte. Ceci, est sans intérêt particulier dans les systèmes fermés, où la nourriture non consommée, n'est pas perdue sauf par sédimentation ou dépôt sur les parois. Cependant, dans les systèmes ouverts et le type de bacs montrés dans les figures 32, 36 et 37, une partie des algues fournies sera inévitablement non consommée et sera perdue dans l'eau sortante. Pour cette raison, des bacs de stockage adéquats de 100 à 150 litres avec un débit lent d'échange d'eau sont préférables.
Par expérience, un taux total d'échange d'eau excédant 90 minutes, minimise les pertes d'algues, en permettant aux géniteurs d'avoir le temps adéquat pour filtrer et consommer 60 à 80 pour cent de la nourriture. Par exemple, un bac de 150 litres contenant 50 huîtres ou Coquilles Saint-Jacques de 75 à 100 g de poids frais nécessite un flux de 1,25 litres par minute à une moyenne de 25 ml par minute par adulte. A ce débit, le taux d'échange du volume est de 120 minutes. Quand des petits bivalves, par exemple la palourde japonaise, sont stockés le nombre d'adultes par bac doit être augmenté en se basant sur le poids frais de la biomasse correspondante.
Il est également souhaitable que la ration soit dosée de manière continue dans le flux entrant au moyen d'une pompe péristaltique pour assurer un meilleur mélange. Dans certaines écloserie, la ration journalière de nourriture est apportée en plusieurs fois. L'arrivée d'eau de mer est arrêtée pendant une heure ou plus après chaque alimentation. Ceci peut être problématique en terme de contamination, qui peut être causée par les déchets des métabolites, si l'eau n'est pas remise à circuler dans les bacs au bon moment.
En cas d'absence de moyens pour déterminer le pourcentage de rétention entre flux entrant et flux sortant dans un bac à flux ouvert, il est recommandé d'ajuster l'apport de nourriture à 4 pour cent pour compenser les pertes pré-discutées. Si l'opérateur a la possibilité d'utiliser un compteur électronique de particules ou (par exemple un Coulter Counter - figure 21), des ajustements de la ration alimentaire peuvent être alors faits sur la base de données plus précises.
Le conditionnement est une procédure qui peut être divisée en deux parties. En début de saison, dans les climats tempérés et froids, quand les adultes du milieu naturel n'ont pas encore commencé leur développement gonadique, il est souvent avantageux de leur fournir de la nourriture de bonne qualité à une température intermédiaire entre température ambiante et température de conditionnement. L'objectif est d'augmenter le niveau des réserves des adultes qui seront par la suite mobilisées pendant le développement des gamètes. Ceci est beaucoup plus important chez les femelles que chez les mâles parce que le développement et la maturation des ovocytes nécessitent considérablement plus d'énergie. Après avoir maintenu les géniteurs à une ration alimentaire élevée durant 4 à 6 semaines ainsi qu'à une température modérée, cette dernière est élevée graduellement (1 à 2 °C par jour) et l'apport de nourriture légèrement réduit (à partir de 4 à 6 pour cent jusqu'à 2 à 3 pour cent par jour).
L'apport en nourriture pendant le premier stade, qui peut être appelé stade de pré-conditionnement, peut être sous forme de pâtes d'algue, de floraisons phytoplanctoniques naturelles provoquées (à partir des cultures extensives, section 3.4.6) ou d'espèces d'algues intensivement cultivées. Il est important de garder à l'esprit que durant ce stade, la structure des lipides (phospholipides) et leurs compositions, pendant les premiers stades des oocytes, sont principalement influencées par le régime et la ration alimentaire apportés aux géniteurs. Ainsi, un régime déficient en acides gras polyinsaturés (AGPI), incluant AEP (acide EicosaPentaenoique, 20:5n-3) et ADH (acide DocosaHexaenoique, 20:6n-3), dont l'importance est connue, sera reflété sur les œufs spécialement au niveau des membranes des cellules qui présenteront un manque en ces éléments. Pour cette raison, la ration alimentaire doit contenir des diatomées de grande valeur nutritive, (par exemple Chaetoceros muelleri ou Thalassiosira sp.) et des flagellés telles que Pavlova lutherii ou Isochrysis galbana, toutes riches en un ou plusieurs de ces AGPIs.
Les Triacylglycérols - les lipides neutres qui constituent les réserves dans les œufs matures - sont accumulés durant les derniers stades de la deuxième partie du conditionnement, lors de la phase d'augmentation thermique. Ces lipides sont utilisés comme source d'énergie durant le développement embryonnaire et larvaire. Leur composition semble être plus dépendante des lipides mobilisables directement à partir de la nourriture ingérée par les adultes que ceux issus des réserves maternelles.
Il a été mentionné au début de ce chapitre que plusieurs espèces de bivalves tropicaux ont l'habitude de pondre à différents intervalles ou de manière séquentielle intermittente durant presque toute l'année. Ceci pose un problème pour l'obtention régulière d'un nombre suffisant de larves afin de satisfaire les besoins des écloseries situées sous des climats tropicaux et sub-tropicaux.
Quand il y a une petite variation de température de l'eau de mer et de disponibilité de nourriture au cours de l'année, les bivalves ne rentreront pas dans une période de repos sexuel - comme c'est le cas des espèces d'eaux froides et tempérées - ce qui déclenche la synchronisation de la gamétogenèse du stock. Cette «hivernalisation» peut être réalisée dans les écloserie tropicales en maintenant le stock dans de l'eau de mer refroidie entre 5 et 10 °C en dessous de la température ambiante avec une ration alimentaire adéquate pendant 4 à 6 semaines. Après cette période la température est progressivement augmentée pour atteindre les conditions ambiantes jusqu'à ce que la plupart des adultes maturent de façon synchrone. Il s'agit d'une approche similaire à celle décrite dans la section 4.1.2.5.
La technique a été utilisée pour l'huître de mangrove, C. rhizophorae, à Cuba. Une méthodologie similaire a été appliquée avec succès pour le conditionnement des huîtres du Pacifique, C. gigas, dans quelques régions du Brésil. Le problème est différent dans ce dernier cas. Les huîtres du Pacifique (des espèces exotiques introduites) grandissent extrêmement bien dans les étangs les plus au sud du pays mais elles n'atteignent pas une maturité sexuelle suffisante leur autorisant une ponte.
Un résumé d'informations pertinentes relatives au conditionnement et à la production d'œufs et de larves d'un nombre de bivalves communément cultivés est présenté dans le tableau 9.
|
Tableau 9: Résumé d'informations relatives au conditionnement et à la production d'œufs (ou larves) pour un nombre de bivalves classiquement cultivés. Une clé de la signification des symboles sous l'étiquette Type Sexuel est présentée à la fin du tableau. La durée du conditionnement concerne des adultes ramenés à l'écloserie au début de saison (*temps en jours varie considérablement selon le stade de la gamétogenèse des adultes quand ils sont introduits en écloserie). Les valeurs de fécondité présentent seulement une indication et varieront selon la taille des adultes pondus, leurs conditions et autres facteurs. La longueur moyenne des larves entièrement développées au stade précoce, larve D (2-3 jours après fécondation) est rapportée dans un but comparatif. |
|||||
|
Groupe/Espèces |
Type sexuel |
Periode (jours*) conditionnement |
Temp. (°C) |
Fécondité (millions) |
larve-D taille (µm) |
|
Huîtres: |
|||||
|
C. gigas |
O-D |
28 - 42 |
20 - 24 |
50+ |
70 - 75 |
|
C. virginica |
O-D |
28 - 42 |
20 - 22 |
50+ |
60 - 65 |
|
C. rhizophorae |
O-D |
21 - 35 |
20 - 22 |
7 - 12 |
55 - 60 |
|
O. edulis |
L-A |
28 - 56 |
18 - 22 |
1 - 3 |
170 - 190 |
|
T. lutaria |
L-A |
28 - 56 |
18 - 20 |
0,02 - 0,05 |
450 - 490 |
|
Palourdes: |
|||||
|
T. philippinarum |
O-D |
28 - 42 |
20 - 22 |
5 - 12 |
90 - 100 |
|
M. mercenaria |
O-D |
28 - 42 |
20 - 22 |
10 - 20 |
90 - 100 |
|
Pectinidés: |
|||||
|
P. yessoensis |
O-D |
14 - 21 |
7 - 8 |
20 - 80 |
100 - 115 |
|
P. magellanicus |
O-D |
28 - 42 |
12 - 15 |
20 - 80 |
80 - 90 |
|
P. maximus |
O-M |
35 - 56 |
10 - 15 |
20 - 80 |
90 - 100 |
|
P. ziczac |
O-M |
14 - 28 |
20 - 22 |
7 - 15 |
90 - 100 |
|
A. gibbus |
O-M |
14 - 28 |
20 - 22 |
4 - 7 |
90 - 100 |
|
A. irradians |
O-M |
21 - 35 |
20 - 22 |
4 - 7 |
90 - 100 |
|
Moules: |
|||||
|
M. edulis |
O-D |
28 - 35 |
12 - 16 |
5 - 12 |
90 - 100 |
|
Clé des symboles relatifs au sexe: O - ovipares (gamètes émis dans l'eau); L - larvipares (adultes porteurs de larves qui seront émises dans l'eau); D - Dioïques (sexes séparés); M - monoïques (hermaphrodite - les deux sexes sont portés par le même animal); A - sexualité rythmique ou alternée (l'individu change de sexe après chaque ponte). |
|||||
Plusieurs bivalves des eaux tempérées et des eaux froides nécessitent 4 à 8 semaines de conditionnement pour arriver à la ponte à la fin de l'hiver et au début du printemps (figure 38). Progressivement, une période plus courte sera nécessaire quand la saison de reproduction en milieu naturel s'approche. Le temps précis dépend des espèces conditionnées, de l'état initial des géniteurs, de leur stade de gamétogenèse en début de conditionnement et de facteurs propres à l'écloserie, dont les plus importants sont la température, le régime et la ration alimentaire. Les gérants d'écloserie utilisent généralement des stocks qui ont déjà amorcé leur gamétogenèse en mer, au lieu de démarrer le conditionnement avec des adultes indifférenciés. Ainsi, durant la période de reproduction naturelle une meilleure qualité des ovocytes sur le plan des réserves (particulièrement lipidiques) est souvent constatée chez les adultes prélevés en mer. Ces géniteurs peuvent avoir seulement besoin de 7 à 12 jours de conditionnement, à une température et ration alimentaire appropriées pour achever la maturation de leurs gamètes.

Figure 38: Une palourde japonaise femelle en cours de ponte (photo de Brian Edwards).
Quand une nourriture adéquate leur est fournie, de nombreux bivalves des eaux tempérées côtières et estuariennes ont besoin de 350 à 650 degré-jours (deg j) du début du conditionnement, à la fin de l'hiver/début du printemps, jusqu'au moment de la ponte. Le gérant d'écloserie a besoin de savoir à quelle température le développement sexuel des espèces concernées s'enclenche dans le milieu naturel. Celle ci oscille souvent entre 8 et 12 °C - le «zéro biologique» (b0) pour la gamétogenèse - pour les espèces communément cultivées telles que, Crassostrea gigas, Ostrea edulis, Pecten maximus et Tapes philippinarum. En connaissant la valeur de la température b0 efficace pour le développement sexuel et la température de l'eau de mer durant la période de conditionnement, le nombre de jours nécessaire au conditionnement peut être calculé. Si par exemple, la température moyenne de conditionnement est de 20 °C et la température b0 pour le développement sexuel est de 10 °C, chaque jour qui passe le nombre de degré-jours augmentera de 20 moins 10 = 10. Ainsi, une période de conditionnement de 30 jours à 20 °C correspondra à 300 degré j et la même période à 22 °C à 360 degré j. Ceci représente probablement la période minimale à la fin du printemps avant que le stock ne soit apte à la ponte. Evidemment, quand un nouveau stock est introduit en écloserie pour conditionnement il a déjà entamé sa gamétogenèse et le nombre de degré-jours sera moindre pour le préparer à la ponte.
Dans les eaux froides le nombre de degré-jours pour les pectinidés, tels que Pecten maximus et Placopecten magellanicus, du début du conditionnement jusqu'à leur aptitude à la ponte est du même ordre. Mais la période de conditionnement pour les bivalves des eaux froides peut être plus longue (parfois plus de 8 semaines) parce que la température maximale de conditionnement n'excède pas 15-16 °C et peut être aussi basse que 10-12 °C. Les bivalves des eaux froides sont souvent acclimatés graduellement à la température de conditionnement demandée en augmentant la température ambiante de 1 à 2 °C par semaine. Ceci prolonge aussi la période de conditionnement.
Après la période de conditionnement, les individus, suite à un stimulus, répondent en libérant leurs gamètes matures: c'est la ponte. Dans le cas des espèces de palourde et de pectinidés, des embryons viables ne peuvent être obtenus à partir de gamètes «lacérées» (voir la section ci-après pour l'explication du terme «lacération»). Les œufs ont besoin d'entreprendre un processus de maturation durant leur passage dans l'oviducte avant qu'ils ne puissent être fécondés avec succès.
Les gamètes matures de l'huître du Pacifique, Crassostrea gigas, de l'huître américaine (côte est), Crassostrea virginica, de l'huître de mangrove, Crassostrea rhizophorae et d'autres espèces ovipares similaires peuvent être entièrement lacérés. Il s'agit d'une méthode classique et pratique de reproduction de ces espèces, suite à leur conditionnement.
Cette procédure implique le sacrifice d'un certain nombre d'adultes matures quand il y a un besoin en larves (figure 39). L'enlèvement de la valve plate (supérieure) de la coquille révèle les tissus mous de l'huître. La gonade s'étale sur les tissus de l'appareil digestif vers l'umbo et la charnière de la coquille et quand elle est très mature s'étend autour des muscles adducteurs. La gonade peut être lacérée à maintes reprises avec un scalpel et les gamètes sont obtenus par lavage dans un bécher ou seau rempli partiellement d'eau de mer, ou une pipette Pasteur propre est insérée sous l'épithélium de la gonade étalée et les gamètes sont alors prélevés en exerçant une douce aspiration. Le contenu de la pipette est ensuite transféré dans un bécher ou seau contenant de l'eau de mer à la température de culture. Dans les deux cas, un petit échantillon est prélevé préalablement à partir de chaque lot d'huîtres ouvertes. Ces échantillons sont examinés au microscope à un grossissement de 40 à 100 pour déterminer le sexe et l'état des gamètes. Le sperme doit être mobile et les œufs, qui ont normalement la forme d'une poire quand ils sont prélevés pour la première fois, doivent s'arrondir quand ils se trouvent en contact avec l'eau de mer durant 20 minutes. La valve supérieure de la coquille doit être replacée sur l'huître, en attendant le prélèvement des gamètes afin d'éviter la dessiccation.

Figure 39: Lacération et transfert de gamètes d'une huître du Pacifique dans un bécher contenant de l'eau de mer filtrée à l'aide d'une pipette Pasteur.
En supposant que les gamètes soient pleinement matures, le processus d'extraction des gamètes à partir des huîtres ouvertes - dont le sexe est dorénavant identifié - continue en s'intéressant d'abord aux femelles. Celles des huîtres Crassostrea sont extrêmement fécondes. Des femelles de 70 à 90 g peuvent porter chacune 80 à 120 millions d'œufs, et n'ont donc pas toutes besoin d'être lacérées.
Des précautions doivent être prises afin de ne pas percer la glande digestive durant la lacération afin d'éviter la contamination des gamètes avec les tissus, les bactéries ou autres microorganismes d'origine gastrointestinale. Les ovocytes de chaque femelle sont soit collectés séparément dans un bécher propre en verre de 2 à 5 litres ou ils peuvent être tous mélangés dans un bécher en plastique de 10 à 20 litres, rempli au 3/4 avec de l'eau de mer désinfectée aux ultraviolets à la température demandée (normalement 24±2 °C).
Une fois les ovocytes prélevés, les mâles sont traités de la même manière. La seule différence réside dans la constitution d'un mélange de gamètes mâles obtenu à partir de petits échantillons de sperme prélevés sur chaque mâle transférés dans un bécher en verre d'1 litre, rempli partiellement avec de l'eau de mer filtrée, désinfectée aux ultraviolets à la même température, en s'assurant que la solution spermatique finale n'est pas trop dense. Le fait de pouvoir visualiser des objets proches à travers le bécher et son contenu constitue un bon indicateur. Les gamètes sont alors prêts à la fécondation.
Avant d'examiner la ponte chez les palourdes, pectinidés et moules, il est à noter que les huîtres du genre Ostrea et Tiostrea présentent un cas particulier. Ces dernières, à l'encontre des autres bivalves communément cultivés, n'ont pas besoin d'être stimulées pour le déclenchement de la ponte. Ces huîtres peuvent pondre de leur plein gré durant le processus de conditionnement et porteront les larves à l'intérieur de la cavité de leur manteau pendant des périodes variables selon les espèces et la température. Ce groupe d'huîtres, incluant l'huître plate européenne (ou «Belon»), Ostrea edulis (figure 40), l'huître de la Nouvelle-Zélande («renflée» ou de vase), Tiostrea lutaria, et son apparentée l'huître plate du Chili Tiostrea chilensis, sont considérées comme des larvipares. Les deux dernières espèces émettent leurs larves dans le milieu environnant après environ 20- jours d'incubation, quand la longueur de la coquille des larves varie entre 450 et 490 mm et sont presque prêtes à se fixer. En revanche, l'huître européenne plate émet ses larves, après une période d'incubation de 6 à 8 jours à des températures de conditionnement normales, quand la longueur de leurs coquilles atteint 170 à 190 mm et nécessitent 10 à 12 jours de plus de culture avant qu'elles n'arrivent à maturité et soient prêtes à se fixer. Les œufs de l'huître de Nouvelle-Zélande et de l'huître plate du Chili ont un diamètre de 350 mm alors que celui de l'huître plate européenne n'est que de 150 mm.
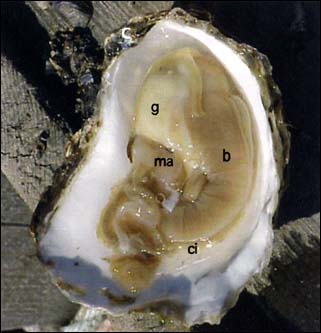
Figure 40: Anatomie d'une huître plate développée, Ostrea edulis; ma - muscle adducteur; g - tissus gonadiques étalés sur la glande digestive; b - branchies; c - crochet; ci - chambre inhalante de la cavité du manteau. A la ponte, les ovocytes passent à travers les branchies dans la chambre inhalante de la cavité du manteau où ils se développent entièrement en larves coquillées durant une semaine ou plus, dépendant des espèces. L'adulte émet les larves quand elles sont capables d'ingérer et digérer les algues. (L'anatomie des huîtres du genre Tiostrea et Ostrea est quasiment similaire).
Les espèces citées ci-dessus ne sont pas des espèces à ponte massive. Ce sont plutôt, des géniteurs qui produisent des larves durant une période prolongée. Il est extrêmement rare de voir des mâles émettant du sperme dans l'environnement voisin et il est supposé qu'ils libèrent périodiquement du sperme en petite quantité. Les huîtres femelles, en phase adjacente, (ces espèces présentent une sexualité alternée) aspirent du sperme grâce à leur courant inhalant, de la même manière que les particules de nourriture, et en réponse, libèrent leurs ovocytes dans la chambre exhalante de la cavité du manteau - comme le cas des espèces ovipares. Cependant, les ovocytes ne sont pas émis dans le milieu naturel. Au lieu de cela ils passent à travers les filaments des branchies dans la chambre inhalante de la cavité du manteau où ils seront fécondés et se développeront pendant une période prolongée (figure 41), pour être entièrement mobiles, et véligères au moment de l'émission (figure 42).
Des techniciens d'écloserie expérimentés dans la culture de ces espèces, peuvent souvent identifier la phase de la ponte et de l'incubation chez les huîtres à partir de petites quantités d'ovocytes qui échappent de la cavité du manteau et se déposent sur la valve externe de la coquille, adjacente soit à l'ouverture inhalante ou exhalante du manteau. Les huîtres femelles portant les œufs ont tendance à être presque inactives, avec un minimum de mouvement de la coquille pendant de longues périodes.
Quand les larves des huîtres larvipares sont libérées dans l'eau, elles nagent à la surface en formant un «radeau» comme c'est le cas d'O. edulis ou elles cherchent immédiatement une surface sur laquelle elles se fixent et se métamorphosent comme chez Tiostrea sp.

Figure 41: Stades d'incubation de l'huître plate européenne, Ostrea edulis. W - Le stade blanc qui commence juste après le passage des gamètes femelles dans la chambre de la cavité du manteau; G - Le stade «ardoisé», qui suit le stade trochophore, quand les valves de la coquille sont bien développées mais les organes larvaires incomplets (3 à 5 jours après la ponte); B - Le stade noir durant lequel les larves sont presque entièrement développées et prêtes à être libérées. Les stades blanc, gris et noir sont des termes traditionnels appliqués aux huîtres incubatrices en Europe.
Dans ce cas, des supports de fixation convenables doivent être placés dans les bacs de géniteurs avant la libération des larves. Ces supports peuvent être soit des coquilles soit des collecteurs ou filets en plastique (voir la section prochaine traitant la fixation des bivalves).
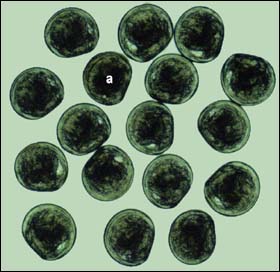
Figure 42: Aspect de la larve véligère d'Ostrea edulis (la longueur moyenne de la coquille est de 175 mm) à l'émission. Toutes les larves sont normalement formées à l'exception de - a - qui montre un développement incomplet d'une valve de la coquille.
Quand chez O. edulis, la période d'émission attendue est atteinte, les bacs doivent être examinés toutes les 2 ou 3 heures pour déceler des signes d'émission de larves. Les larves en suspension peuvent être récoltées à la surface de l'eau à partir du bac de conditionnement avec un bécher ou un petit filet dont la maille est de 90 mm et transférées dans un seau rempli d'eau. Elles peuvent passer par le flux sortant dans un plus grand tamis de même maillage, partiellement immergé dans un plateau rempli d'eau de mer (figure 43). Il est toujours conseillé de collecter les larves le plus tôt possible après leur libération pour éviter qu'elles ne se contaminent par les matières fécales expulsées dans l'eau ou ne soient filtrées par les adultes.

Figure 43: Conditionnement expérimental des géniteurs d'Ostrea edulis. Noter le tamis vert immergé dans un plateau de faible profondeur pour récupérer et retenir les larves.
Une fois les larves collectées, elles sont dénombrées (voir après) et distribuées dans les bacs de culture à des densités appropriées. Les phases femelles de l'huître européenne de 70 à 90 g (la taille des huîtres dans la figure 41) libéreront un groupe de 1 à 2,5 millions de jeunes larves. En revanche, la phase femelle de l'huître Tiostrea, qui produit des œufs considérablement plus gros, libérera de plus petits groupes de 20 000 à 50 000 larves.
Les larves peuvent être récupérées à partir de géniteurs identifiés en incubation soit dans les bacs de conditionnement, ou, dans le cas du stock transféré, dans les zones de grossissement - ou à partir de populations sauvages - durant la saison naturelle de reproduction. Les étapes de cette procédure sont illustrées dans la figure 44. Cette méthode est parfois utilisée pour obtenir des larves avant qu'elles ne développent un intestin fonctionnel dans les derniers stades d'incubation. Ceci peut être pertinent en été quand les bactéries pathogènes sont potentiellement dominantes. Les larves commencent probablement à se nourrir pendant qu'elles sont encore dans la cavité du manteau parental et, elles peuvent donc être exposées à une charge bactérienne et autres micro-organismes accumulés et aussi aux déchets fécaux provenant des parents et du stock adjacent.
Que les larves soient libérées naturellement par les géniteurs ou récupérées avant l'émission, elles sont élevées suivant la méthodologie standard décrite ultérieurement dans la section réservée à l'élevage larvaire de ce manuel. Les meilleurs résultats sont obtenus avec des groupes de larves qui ont pu se développer jusqu'à l'obtention d'une coquille entière, mobile, au stade de larve D. Si les larves sont enlevées à un stade de développement précoce, la nourriture est gardée jusqu'à ce qu'elles développent un système alimentaire fonctionnel - visible à travers les valves transparentes de la coquille comme une structure foncée en forme de S, qui peut être observée dans la figure 42. Ceci peut prendre 2 ou 3 jours à partir de leur récupération. Avant ce stade, les tissus mous sont denses, granulaires, de couleur grise et les larves sont peu mobiles (voir figure 41 - le stade de larve «ardoisé»).

Figure 44: Récupération des larves d'Ostrea edulis à partir d'un adulte porteur d'œufs. B - La valve supérieure de la coquille est enlevée, puis les larves incubées sont nettoyées à travers un tamis de 90 mm placé audessus d'un seau rempli d'eau de mer filtrée (C). D - La plupart des larves nagent rapidement vers la surface de l'eau où elles se regroupent (radeau). Elles sont alors prêtes pour le comptage et la détermination de la taille. Les photos ont été prises dans l'écloserie d'huître à Harwen en Nouvelle Ecosse (avec l'aimable autorisation de John et Krista Harding).
D'autres espèces commerciales cultivées en écloserie sont connues comme ovipares comparées aux espèces d'huîtres larvipares discutées auparavant. Les espèces ovipares émettent leurs ovocytes et/ou sperme dans l'eau environnante où la fécondation a lieu.
Différents stimuli peuvent être appliqués pour induire la ponte; les plus performants sont ceux qui sont naturels et minimisent le stress. La description suivante concerne une technique connue comme le choc thermique, qui est la méthode la plus largement utilisée pour les espèces ovipares. En règle générale, si les géniteurs ne répondent pas au stimulus thermique durant une période de temps raisonnable, les gamètes qu'ils portent ne sont probablement pas complètement matures.
L'utilisation de sérotonine et autres déclencheurs chimiques pour induire la ponte est rarement bénéfique. Les œufs libérés utilisant de telles méthodes sont souvent moins viables que ceux émis après le choc thermique.
Les bivalves matures prélevés du bac de conditionnement sont nettoyés pour enlever toutes sortes de débris et d'organismes indésirables (fouling) de leurs coquilles et sont ensuite bien rincés avec de l'eau de mer filtrée. Après nettoyage ils sont placés dans un récipient de ponte ou bac. Le type de bac recommandé est un plateau en fibre de verre peu profond (approximativement 150x50x15 cm de profondeur - 10 cm de profondeur d'eau) (figure 45). Il doit avoir une taille qui peut être vue par deux opérateurs ou plus qui ont l'expérience dans la détection du déclenchement de la ponte des adultes (un point important dans la ponte des espèces monoïques - voir ci-après).
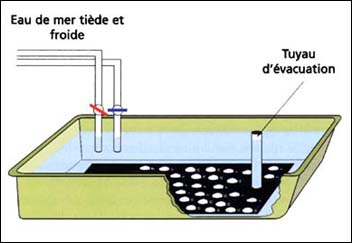
Figure 45: Diagramme d'un bac classiquement utilisé pour la ponte des bivalves ovipares (d'après Utting et Spencer, 1991).
Le pondoir est souvent pourvu d'un tuyau vertical d'évacuation et de deux apports d'eau de mer filtrée, une chauffée ou refroidie de 12 à 15 °C et l'autre de 25 à 28 °C (par exemple pour les espèces de Crassostrea et de la palourde japonaise). Des températures inférieures s'appliquent aux espèces d'eau froide. L'importance est la différence entre la température la plus basse et la plus élevée, qui sera normalement de 10 °C.
La base du pondoir est peinte avec une couleur matte ou couverte par une feuille en plastique noire pour assombrir le fond sur lequel les gamètes qui viennent d'être libérés puissent être facilement aperçus (figure 45).
Le pondoir est rempli avec de l'eau froide jusqu'à une profondeur d'environ 10 cm et une petite quantité d'algues de culture est rajoutée pour stimuler l'ouverture des valves des adultes et initier les activités de pompage. Après 30 ou 40 minutes, l'eau est vidée et remplacée par de l'eau à une température plus élevée, encore avec une petite quantité d'algues. Cette eau est de nouveau évacuée après un temps similaire et remplacée par de l'eau plus froide et la procédure est répétée encore une fois.
Le nombre de cycles froid/chaud nécessaire à l'induction de la ponte dépend de l'état de maturité des gamètes et de l'empressement des adultes à la ponte. En été les adultes peuvent pondre une heure après l'induction, mais en début de cycle cela peut prendre 3 ou 4 heures avant que le premier adulte ne commence à pondre. Généralement, si les adultes ne réagissent pas dans les 2 à 3 heures, ils sont replacés dans les bacs de conditionnement pour une semaine supplémentaire. Les adultes peuvent déclencher la ponte aussi bien dans la période froide ou chaude du cycle, mais plus couramment dans sa partie chaude. Généralement, ce sont les mâles qui émettent en premier, mais ceci n'est pas toujours vrai.
Des stimuli additionnels peuvent être apportés sous forme d'ovocytes incubés ou sperme à partir d'un mâle ouvert. La gonade est localisée à la base du pied de la palourde. Chez les pectinidés, il s'agit de deux organes séparés qui peuvent être visualisés quand le manteau et les tissus branchiaux sont soulevés. Si la gonade est percée avec précaution et à l'aide d'une pipette Pasteur une succion est pratiquée, des quantités de gamètes peuvent être aspirées et peuvent être mélangées dans une petite quantité d'eau de mer filtrée avant d'être rajoutée à l'eau de mer filtrée contenue dans la cuve. Dans le cas des palourdes, ayant des siphons discrets, les gamètes dilués sont acheminés vers le siphon inhalant des palourdes actives avec une pipette Pasteur pour être aspirés vers la cavité du manteau par le pompage pratiqué par les adultes. Le siphon inhalant est le siphon le plus éloigné du crochet et a une ouverture d'un diamètre plus large. Quand la ponte se produit dans les palourdes, les gamètes sont émis à travers le siphon exhalant comme il a été montré dans la figure 38. Le choc thermique durant la seconde partie chaude du cycle donne presque toujours une ponte au bout d'1 à 2 heures, chez les palourdes matures et autres bivalves ovipares entièrement matures.
Dans le cas des espèces dioïques (tableau 9), chez lesquelles les premiers adultes qui pondent sont presque invariablement mâles, il est conseillé de les enlever du pondoir et de les garder hors d'eau jusqu'à ce que suffisamment d'ovocytes soient collectés après la ponte des femelles. En effet, le sperme vieilli plus rapidement que les ovocytes et s'ils ont plus d'une heure au moment de la fécondation, le taux de fécondation peut être réduit.
Quand chaque femelle commence à pondre, il est important de l'enlever du pondoir et de la transférer dans un plateau individuel de ponte ou dans un bécher rempli partiellement d'eau de mer filtrée à 24-26 °C (figure 46). Le plateau/bécher est placé dans un bain-marie pour maintenir la même température. La même procédure est appliquée aux mâles émettant, qui se caractérisent par un courant fluide laiteux s'échappant du siphon exhalant bien différent de l'apparence granulaire ou de paquets d'ovocytes émis par la femelle. Les femelles peuvent commencer la ponte 30 à 60 minutes après que le premier mâle a commencé à libérer le sperme.
La durée de la ponte pour un individu est variable mais elle excède rarement plus de 40 à 60 minutes, avec souvent une période plus courte pour les femelles. Il est parfois nécessaire d'enlever une pondeuse de son récipient et de la transférer dans un nouveau bécher quand un grand nombre d'ovocytes est émis. En effet, la présence de fortes concentrations d'ovocytes dans l'eau inhibe l'activité de pompage et donc l'expulsion d'ovocytes supplémentaires. De plus, la femelle peut commencer à filtrer les ovocytes qui sont en suspension.

Figure 46: A - Des adultes de Pecten ziczac subissant un choc thermique dans un pondoir. Noter la thermistance d'aquarium utilisée pour maintenir la température à des valeurs élevées. Un plateau similaire, contenant de l'eau refroidie par l'intermédiaire de pains de glace, est utilisé pour assurer le choc froid. B - Des coquilles pondeuses placées isolément dans des béchers en plastique de 3 litres immergés dans des bains-marie à température constante. Bien que cette espèce ne soit pas dioïque, l'illustration s'applique aux procédures utilisées pour la ponte de n'importe quelle espèce.
Les ovocytes peuvent être émis en paquet et peuvent éventuellement se déposer sur le fond du plateau ou du bécher. Ces ovocytes sont alors séparés quand la ponte est achevée en versant le contenu du bécher à travers un tamis en nylon de 90 mm (les ovocytes ne sont pas retenus par cette maille), en retenant les ovocytes séparés sur un tamis de maille de 20 à 40 mm. Les ovocytes sont par la suite lavés dans un bécher propre ou un récipient en plastique contenant de l'eau de mer filtrée à la température demandée. Souvent les ovocytes agrégés ne sont pas bien fécondés. Le meilleur résultat est obtenu le plus souvent quand les femelles libèrent des nuages d'ovocytes bien séparés qui restent longtemps en suspension contrairement aux ovocytes agrégés.
Quand les ovocytes viennent d'être libérés, ils ont la forme d'une poire mais ils s'hydratent rapidement et prennent une forme sphérique au contact de l'eau de mer. Les ovocytes provenant de différentes femelles sont collectés séparément pour permettre l'estimation visuelle de la qualité en utilisant un microscope à un grossissement d'environ 100. Les groupes d'ovocytes qui ne s'arrondissent pas après avoir séjourné 15 à 20 minutes dans de l'eau de mer doivent être écartés. Le développement sexuel chez les femelles ovipares des bivalves est asynchrone et, de ce fait, les ovocytes émis par les diverses femelles sont à différents stades de maturation. Quand la séparation et l'examen des ovocytes sont terminés, ceux qui apparaissent en bon état peuvent être regroupés et mis dans un plus grand volume d'eau.
Le sperme libéré par les différents mâles est rassemblé de la même manière. Il est préférable d'utiliser les ovocytes d'au moins 6 femelles et le sperme d'un nombre équivalent de mâles pour fournir des larves destinées à la production. Ceci assure une variabilité génétique satisfaisante parmi les descendants, cette variabilité dépendant plus du degré d'hétérozygotie des parents. Des suspensions de petits volumes de sperme sont mélangés à des ovocytes par agitation douce du contenu du récipient avec une proportion de 1 à 2 ml de sperme par litre d'ovocytes en suspension.
La procédure de ponte des espèces hermaphrodites, incluant plusieurs espèces de pectinidés, chez lesquelles les œufs et le sperme d'un même individu sont matures concomitamment, est plus complexe. Dans ce cas, l'objectif est de minimiser les chances de fécondation des ovocytes par le sperme appartenant au même individu (autofécondation), même s'il est rare qu'un adulte émette des œufs et du sperme simultanément. Plus souvent le sperme est libéré en premier suivi par les ovocytes et les individus ne recommencent à émettre leur sperme qu'une fois les ovocytes émis.
Il y a deux approches pour optimiser les fécondations croisées. Un grand nombre d'adultes peut pondre dans des bacs profonds à grand volume. Ces derniers sont aménagés en système ouvert si bien que la contribution du sperme provenant d'un individu particulier est minime par rapport au total et la quantité globale de sperme est continuellement diluée par le débit de l'eau en circulation. Quand les individus basculent en femelles, les ovocytes plus denses sont retenus dans le bac de telle façon que les gamètes femelles de cet individu vont être plus vraisemblablement fécondés par le sperme appartenant à d'autres individus que par son propre sperme. Cette méthode - applicable aussi à la ponte des espèces dioïques à grande échelle, où l'autofécondation ne pose pas de problèmes - est utilisée dans les installations de production en masse pour Argopecten purpuratus au Chili et également dans les cultures de bivalves en étangs en Asie.
Ou bien pour permettre un contrôle de l'autofécondation, chaque adulte est transféré dans un petit récipient contenant de l'eau de mer à la température souhaitée (figure 47). Le récipient est identifié par une étiquette portant la date et un numéro de référence qui permettra de suivre l'évolution d'un adulte particulier pendant toute sa période d'émission de gamètes. Quand l'adulte pond et opacifie l'eau avec ses gamètes, il est déplacé dans un nouveau récipient propre, après avoir été préalablement rincé avec de l'eau de mer filtrée. Le temps de transfert ainsi que le même numéro de référence de l'adulte sont marqués sur le récipient. Des observations méticuleuses doivent être apportées sur chaque bécher contenant l'adulte émettant son sperme afin de déceler l'expulsion des ovocytes qui apparaît brusquement la plupart du temps. Quand chaque adulte bascule en femelle pour produire des ovocytes il est immédiatement enlevé et transféré dans un autre récipient après rinçage, en conservant le même numéro de référence et en notant le temps d'inversion sexuelle. Une fois que suffisamment d'ovocytes ont été pondus, les adultes sont enlevés des béchers avant qu'ils ne recommencent la production de sperme. De cette manière, les ovocytes et le sperme de chaque adulte, identifiés à l'origine par différents numéros de référence et le temps d'émission, sont séparés.
Les adultes, matures prélevés directement en mer, portant des gamètes prêts à être émis, peuvent être induits pour la ponte en écloserie de la même manière.
Avant la fécondation, si cela n'a pas été préalablement réalisé, les œufs en suspension doivent être filtrés avec précaution à travers un tamis de maillage convenable (90 mm ou plus) maintenu de manière à ce que le fond du tamis soit en dessous du niveau de l'eau dans un récipient ou seau de grand volume. Cette étape permet d'enlever les déchets fécaux provenant des adultes, et préalablement à l'addition du sperme, afin de réduire le risque d'une prolifération bactérienne ultérieure et autres organismes au cours du processus de culture qui s'en suit.
La méthode utilisée pour féconder les œufs est quasiment la même aussi bien chez les espèces monoïques que dioïques. Une seule exception existe chez les bivalves hermaphrodites où il faut s'assurer que les ovocytes sont fécondés par du sperme provenant d'adultes autres que ceux qui les ont émis. Pour cette raison, les ovocytes originaires de différents adultes sont gardés séparément et fécondés avec du sperme obtenu à partir de 3 ou 4 mâles avec un ratio de 2 ml de sperme par 1 litre d'ovocytes en suspension. Après l'addition du sperme, on les laisse au repos pendant 60 à 90 minutes avant qu'ils ne soient mélangés - si besoin était - avec d'autres œufs fécondés provenant d'autres adultes.

Figure 47: Série de photos illustrant la ponte du pétoncle calico, Argopecten gibbus, pectinidé monoïque, à la Station de recherche biologique des Bermudes, Inc. (SRBB).
A - Les géniteurs sont conditionnés en écloserie à une température de 20-22 °C pendant 2 à 4 semaines à la fin de l'hiver et au début du printemps. Un flux constant d'eau de mer est maintenu dans le bac et la nourriture est rajoutée tous les jours.
B - Apparence d'un pectinidé mature; la couleur orange de l'ovaire et blanche du testicule occupant respectivement les parties distale et proximale de la gonade. Le muscle adducteur est au centre droit ainsi que le tissu de couleur brune qui comporte les branchies et le manteau, qui ont été soulevés pour montrer la gonade.
C - Jusqu'à 20 coquilles de pectinidés ont pondu en même temps dans des plateaux transparents dont la profondeur d'eau est de 75 x 45 x 5 cm approximativement. Les plateaux contiennent de l'eau de mer filtrée à 1 mm en quantité suffisante pour recouvrir entièrement les coquilles. L'un est refroidi à la température de 12 °C avec des pains de glace et l'autre est chauffé à une température de 25 à 27 °C à l'aide d'une thermistance d'aquarium de 150 W. Les pectinidés sont exposés à ces deux températures suivant un cycle comme expliqué dans le texte.
D - Le personnel surveille attentivement les coquilles pour identifier celles qui commencent à pondre dans le pondoir rempli d'eau tiède. Les pondeurs sont rincés avec de l'eau de mer filtrée et transférés individuellement dans des béchers en plastique étiquetés contenant 0,5 à 1 litre d'eau de mer positionnés dans un autre plateau contenant de l'eau de mer thermostatée à la température de ponte.
E - Après émission du sperme, les pectinidés changent soudainement pour émettre des ovocytes de couleur orange. Aussitôt que cette bascule s'opère, il est important d'enlever, de rincer, et de remettre les pectinidés dans des béchers propres contenant de l'eau de mer filtrée pour poursuivre l'émission des ovocytes. Si cette dernière est rapide et prolifique, le sperme provenant d'autres pectinidés est souvent rajouté à ce moment.
F - Les œufs de bonne qualité, déterminés par un examen microscopique, sont regroupés dans des béchers de 10 litres. Noter le disque en plastique perforé utilisé pour agiter le contenu du seau afin de maintenir les œufs en suspension. Le bécher peut contenir 5 à 10 millions d'œufs - estimé à première vue.
Durant cette période, à la température appropriée, les œufs fécondés commencent à se diviser, au départ presque d'une manière égale en deux cellules et par la suite en 4 cellules où une grande cellule apparaîtra couronnée par 3 plus petites cellules. Le premier signe d'une fécondation réussie, cependant, avant que la division cellulaire ne commence, est l'apparition à partir de l'oeuf d'une petite structure transparente (dôme), qui est le premier globule polaire (figures 48 et 49). L'évaluation du pourcentage d'œufs qui se sont développés normalement peut être faite à l'aide d'un microscope au grossissement 20 à 40. Les taux de fécondation (presque invariables) excèdent 90 pour cent en supposant que les œufs sont entièrement matures.
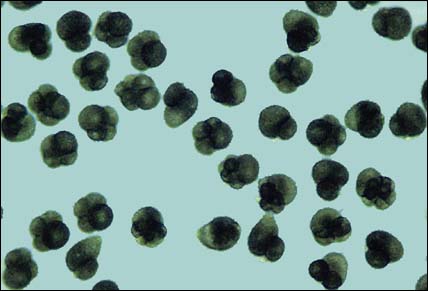
Figure 48: Division de l'oeuf de Crassostrea gigas 50 minutes après fécondation. La plupart de ces œufs se développent normalement et sont aux stades de 2 à 4 cellules.
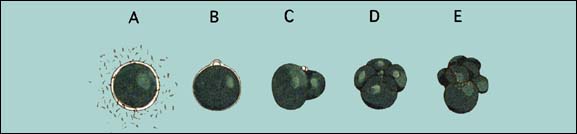
Figure 49: Les premiers stades de développement des œufs; A - Spermatozoïdes fourmillant autour de l'oeuf; B - Apparition du premier globule polaire suite à la fécondation; C - Stade de deux cellules montrant aussi le second globule polaire; D - Stade de quatre cellules; E - Stade de huit cellules. Les œufs de la plupart des bivalves ovipares présentent une gamme de taille qui varie de 60 à 80 mm, selon les espèces. Le temps entre la fécondation et les différents stades de développement dépend des espèces et de la température du milieu.
Il est préférable d'estimer le nombre d'œufs avant ou au cours des 20 à 30 minutes qui suivent la fécondation car le développement s'affaiblira si la densité des embryons par unité de volume, au-delà des premiers stades de clivage, excède certaines limites spécifiées. Cette densité est précisée ultérieurement et la méthode de détermination du nombre d'œufs et larves est décrite dans la section 5.1.2.3.
Bourne, N., Hodgson, C.A. et Whyte, J.N.C. 1989. A Manual for Scallop Culture in British Columbia. Canadian Tech. Rep. Fish and Aquatic Sciences, No. 1694: 215 pp.
Breese, W.P. et Malouf, R.E. 1975. Hatchery manual for the Pacific oyster. Sea Grant Program Publ., No. ORESU-H-75-002. Oregon State Univ., Corvallis, Oregon, USA: 22 pp.
Castagna, A. et Kraeuter, J.N. 1981. Manual for growing the hard clam, Mercenaria. Spec. Rep. Virginia Institute of Marine Sci., Gloucester Point, Virginia, USA
Chew, K.K., Beattie, J.H. et Donaldson, J.D. 1987. Bivalve mollusc hatchery techniques, maturation and triggering of spawning, p 229-248. In: Working Group on Technology, Growth and Employment (eds.) Shellfish Culture Development and Management. International Seminar, La Rochelle, France, March 4-9, 1985, IFREMER, Centre de Brest, France
Couturier, C., Dabinett, P. et Lanteigne, M. 1995. Scallop culture in Atlantic Canada. p. 297-340. In: A.D. Boghen (ed.) Cold-Water Aquaculture in Atlantic Canada. The Canadian Institute for Research on Regional Development, Moncton, Canada: 672 pp.
Dao, J.C., Buestel, D., Gerard, A., Halary, C. et Cochard, J.C. 1988. Scallop (Pecten maximus) restocking program in France: goals, results and prospects. Can. Transl. Fish Aquat. Sci., 5343: 22 pp.
Dupuy, J.L., Windsor, N.T. et Sutton, C.F. 1977. Manual for design and operation of an oyster hatchery. Spec. Rep. Appl. Mar. Sci. Ocean Eng., No. 142. Virginia Inst. Mar. Sci., Gloucester Point, Virginia, USA: 104 pp.
Helm, M.M. 1990a. Modern design and operation of bivalve mollusc hatcheries. p 59- 73. Proc. 4th Int. Conf. on Aquafarming, Acquacultura 88, October 14-15, Verona, Italy: 216 pp.
Helm, M.M. 1990b. Managing Production Costs - Molluscan Shellfish Culture. p 143-149. Congress Proceedings, Aquaculture International, September 4-7, 1990, Vancouver, BC, Canada: 480 pp.
Helm, M.M. 1991. Development of industrial scale hatchery production of seed of the mangrove oyster, Crassostrea rhizophorae, in Cuba. Food and Agriculture Organization of the United Nations, FAO: TCP/CUB/8958: 46 pp.
Helm, M.M., Holland, D.L. et Stephenson, R.R. 1973. The effect of supplementary algal feeding of a hatchery breeding stock of Ostrea edulis L. on larval vigour. J. Mar. Biol. Assoc. UK, 53: 673-684
Helm, M.M., Holland, D.L., Utting, S.D. et East, J. 1991. Fatty acid composition of early non-feeding larvae of the European flat oyster, Ostrea edulis L., J. Mar. Biol. Assoc. UK, 71: 691-705
Helm, M.M. et Pellizzato, M. 1990. Riproduzione ed allevamento in schiuditoio della specie Tapes philippinarum. p 117-140. In: G. Alessandra (ed) Tapes philippinarum: Biologia e Sperimentazione. Ente Svillupo Agricolo Veneto, Venice, Italy: 299 pp.
Jia, J. et Chen, J. 2001. Sea farming and sea ranching in China. FAO Fisheries Tech. Paper, No 418, Food and Agriculture Organization, UN, Rome: 71 pp.
Lewis, T.E., Garland, C.D. et McMeekin, T.A. 1986. Manual of hygiene for shellfish hatcheries. Department of Agricultural Science, University of Tasmania. University of Tasmania Printing Dept., Hobart, Tasmania: 45 pp.
Loosanoff, V.L. et Davis, H.C. 1963. Rearing of bivalve mollusks. Advances in Marine Biology, 1, Academic Press Ltd, London: 1-136
Matsutani, T. et Nomura, T. 1982. Induction of spawning by serotonin in the scallop, Patinopecten yessoensis (Jay). Mar. Biol. Lett., 4: 353-358
Millican, P.F. et Helm, M.M. 1994. Effects of nutrition on larvae production in the European flat oyster, Ostrea edulis. Aquaculture, 123: 83-94
Morse, D.E., Hooker, H., Duncan, H. et Morse, A. 1977. Hydrogen peroxide induces spawning in molluscs, with activation of prostaglandin endoperoxide synthetase. Science, 196: 298-300
Muniz, E.C., Jacob, S.A. et Helm, M.M. 1986. Condition index, meat yield and biochemical composition of Crassostrea brasiliana and Crassostrea gigas grown in Cabo Frio, Brazil. Aquaculture, 59: 235-250
Rosenthal, H., Allen, J.H., Helm, M.M. et McInerney-Northcott, M. 1995. Aquaculture Technology: Its Application, Development, and Transfer. p 393-450. In: Boghen, A.D. (ed) Cold-Water Aquaculture in Atlantic Canada. The Canadian Institute for Research on Regional Development, Moncton, Canada: 672 pp.
Utting, S.D., Helm, M.M. et Millican, P.F. 1991. Recent studies on the fecundity of European flat oyster (Ostrea edulis) spawning stock in the Solent. J. Mar. Biol. Assoc. UK, 71: 909-911
Utting, S.D. et Millican, P.F. 1997. Techniques for the hatchery conditioning of bivalve broodstocks and the subsequent effect on egg quality and larval viability. Aquaculture, 155: 45-54
Utting, S.D. et Millican, P.F. 1998. The role of diet in hatchery conditioning of Pecten maximus L.: a review. Aquaculture, 165: 167-178
Walne, P.R. 1974. Culture of Bivalve Molluscs. Fishing News (Books) Ltd, Surrey, England: 189 pp.