por
R. Quirós y C. Baigún
Instituto Nacional de Investigación y Desarrollo Pesquero
Mar del Plata, Argentina
Resumen
Sobre un conjunto de lagos y embalses andino-patagónicos y patagónicos se realizó un muestreo limnológico-pesquero de carácter extensivo, durante el verano de 1984. El conjunto de ambientes se presenta como sumamente heterogéneo en lo que respecta a sus características físicas, químicas y biológicas; dicho conjunto se halla situado entre 37°55'-43°05'S y 68°40' – 71°40'W.
Un análisis de clasificación-ordenación de la composición en especies de las capturas de peces, ubica a los ambientes sobre un eje físico oeste-este, que va desde la cordillera de los Andes hacia la planicie patagónica. La comunidad de peces de los lagos andinos aparece, en general, dominada por salmónidos, y la de los lagos de la planicie por percíctidos y aterínidos. Dicha distribución coincide con una variación continue en la caracterización trófica de los ambientes, desde lagos profundos y oligotróficos en la cordillera, hacia lagos poco profundos y eutróficos en la planicie.
Se especula sobre las causas geográficas, ambientales e históricas que llevaron a la distribución observada de estructura de la comunidad de peces.
Abstract
A limnological-fisheries extensive sampling was performed on a set of patagonian and andean-patagonian lakes and reservoirs, during the summer of 1984. The set of environments is very heterogeneous with respect to its physical, chemical and biological characteristics. These environments are located within 37°55' – 43°05'S and 68°40' – 71°40'W.
A classification-ordenation analysis of the species composition of fish captures situates the environments on a physical west-east axis, that goes from the Andean range towards the patagonian plain. The fish community in the Andean lakes generally appears dominated by salmonids and those in the plain by percichthyids and atherinids. This distribution agrees with a continuous variation in the trophic characterization of the environments, from deep oligotraphic lakes in the Andean range to shallow eutrophic lakes in the plain.
We speculate about the geographical, environmental and historical causes that have lead to the observed distribution of the fish community structure.
1. INTRODUCCION
Uno de los sistemas de lagos menos conocido, en lo que respecta a sus características limnológicas en general y a la abundancia y composición de sus comunidades de peces en particular, es el compuesto por los lagos patagónicos y andino-patagónicos, tanto argentinos como chilenos.
Sobre una cantidad de varios centenares de lagos sólo se posee información limnológica de algunos de ellos (Cordini, 1939, 1950, 1964; Löffler, 1959; Drago, 1974; Campos et al., 1974, 1977, 1978, 1978a, 1980, 1981, 1982, 1983; INALI, 1972; Conzonno et al., 1981; Lund de Castello, 1981; Quirós et al., 1984), y con respecto a sus poblaciones de peces, la información disponible es casi exclusivamente de tipo faunístico y zoogeográfico (Marini, 1939; Bruno Videla, 1944; Gonzalez Regalado, 1945; Fuster de Plaza, 1950; MacDonagh, 1950; Campos, 1970, 1973; Campos et al., 1974) con muy pocas excepciones (MACNBR, 1981).
La falta de información mencionada llevó al surgimiento de una serie de mitos, en particular con respecto a la interacción entre las especies indígenas y las introducidas, así como al éxito de estas últimas (Margalef, 1983).
El número de especies en todos los lagos de la región patagónica es bajo, aún considerando las introducidas (Campos, Bucarey y Arenas, 1974; Ringuelet, 1975).
La gran mayoría de los lagos patagónicos argentinos no están prácticamente explotados, sea comercial o deportivamente, y de los que lo están no se posee información estadística fidedigna ni una evaluación del nivel de explotación. Basándonos en tales antecedentes, o sea un casi total desconocimiento de las características limnológicas y pesqueras, se elaboró un programa de estudios basado en un enfoque de tipo extensivo. Dicho programa tiende a lograr la caracterización limnológica del conjunto total de lagos patagónicos argentinos, a determinar la abundancia de peces en un subconjunto y a ordenar relativamente el conjunto total según su producción pesquera potencial (Ryder, 1981).
Este trabajo resume alguno de los resultados preliminares en 33 lagos y embalses.
Dado que pretendemos que este sea un primer enfoque del problema, los ambientes fueron elegidos tal que la heterogeneidad sea máxima, y los resultados permitan un ordenamiento primario, tanto con respecto a la abundancia y composición de sus comunidades de peces, como a sus características ambientales (Tonn, Magnuson y Forbes, 1983).
Para el análisis de clasificación - ordenación se adoptó un conjunto de técnicas complementarias y útiles (Orloci, 1978) con el objetivo de estudiar la influencia de los gradientes ambientales sobre la estructura de las comunidades de peces. Ello se incluye en un intento de aclarar, dentro de lo posible, tanto el ajuste de las distintas poblaciones a un tipo de ambiente, como el de separar los efectos producidos por el proceso de coevolución de las poblaciones índigenas con su ambiente, y por otro los producidos por los procesos de interacción entre las especies introducidas, las indígenas y el ambiente.
2. MATERIALES Y METODOS
El conjunto de lagos y embalses está situado entre 37°55' – 43°05'S y 68°40' – 71°40'W (Fig. 1). Fue elegido abarcando un rango amplio de características climáticas, físicas y morfométricas (Quirós et al., 1984), y tomando también en cuenta la facilidad de acceso. Cada lago fue muestreado sólo una vez durante el verano de 1984 (febrero 10 –abril 10). Los lagos 18, 23, 25, 31, 32 y 33 fueron muestredos cinco veces, trimestralmente, en el período febrero 1983 – febrero 1984.
La información ambiental utilizada y las metodologías de muestreo y análisis se encuentran descriptas en Quirós et al. (1984).
2.1 Muestreo de peces
El muestreo de peces se realizó con una batería de 9 redes agalleras de nylon multifilamento, de 50 m de longitud cada una, con 21, 25, 30, 35, 39, 52.5, 60, 70 y 85 mm entre nudos y fueron colocadas, en superficie, en tres trenes de tres redes cada uno, con el menor tamaño de malla hacia la costa, perpendiculares a la misma, separados uno de otro por unos 300 m.
Los lagos pequeños fueron muestreados, en una estación, durante un día y los mayores durante 2–4 días (Tabla I). Los lagos más extensos (12, 25, 32, 33) fueron muestreados en dos estaciones. Los peces capturados fueron identificados, pesados y medidos en el campo y sólo se consideró la captura nocturna (7 p.m. – 7 a.m.).
La captura por unidad es esfuerzo (CPUE), total y por especie (Tabla I), fue expresada en kg por batería y por noche. Dado la profundidad desigual de cada una de las redes componentes de la batería, las CPUE totales y por especie fueron estandarizados a una superficie de 900 m2 de batería, o sea 100 m2 de malla de cada una de las nueve redes componentes (Delfino et al., 1984).
En el presente análisis no fueron consideradas las especies de los géneros Aplochiton y Galaxias. Las primeras porque sólo fueron capturadas en dos del total de ambientes, y las segundas porque sus hábitos no serían vulnerables, de manera similar al resto de las especies consideradas, al arte y metodología de pesca utilizados. En ambos casos sus capturas fueron prácticamente despreciables sobre el total.
Se consideraron las siguientes “especies” capturadas: Salmo gairdnieri (AIR), Salmo trutta (MAR), Percichthys trucha (BCH), Percichthys colhuapiensis (BGDE), Salvelinus fontinalis (TAR).
En el caso de los aterínidos de la región patagónica argentina no existe a la fecha un acuerdo taxonómico aceptable, agravado esto por la introducción de una especie originaria de la región central de Argentina. Por ello se considera bajo el item pejerrey (PEJ) todos los ejemplares de la familia Atherinidae capturados.
2.2 Análisis de los datos
La composición en especies de las capturas fue comparada con los resultados de otros estudios en los cuales se utilizaron metodologías de pesca y análisis de información similares a los utilizados por nosotros, y períodos de muestreo prolongados. De resultados de ello la composición en especies del embalse Ramos Mexia (7, Tabla I) corresponde a MACNBR (1981), al igual que la clasificación taxonómica de los ejemplares del género Percichthys del L. Pellegrini.
Seis lagos de la Provincia del Chubut (18, 23, 25, 31, 32 y 33, Tabla I), fueron muestreados con mayor intensidad y con idéntica metodología en el período febrero 1983 - febrero 1984 (Baigún y De Nichilo, inédito). De manera de evitar, en lo posible, el cómputo de capturas excepcionales en nuestro análsis, para dichos lagos se consideró como CPUE total y por especie el promedio de cinco muestreos.
Los análisis se realizaron tanto sobre la base de datos original como sobre la corregida, y los resultados no presentaron diferencias sustanciales. Previo al análisis de clasificación - ordenación y sobre las respectivas matrices de correlación, se realizó el test de esfericidad de Bartlett con el objeto de determinar la presencia de estructura en los datos (Green, 1979).
Para clasificar los ambientes, según su composición en especies, utilizamos análisis de clusters según el método de unión promedio con medias aritméticas ponderadas (Davis, 1973). Como medida de similitud utilizamos el coeficiente de correlación (CLUST 1) y el coeficiente de distancia (CLUST 2). Aunque el primero de ellos no es recomendado en la clasificación de “sitios” (Davis, 1973; Green, 1979), sólo se lo utilizó con fines comparativos. En ambos análisis las variables fueron transformadas según log (X + 1).
El análisis multivariado de ordenación se realizó según componentes principales (PCA) (Davis, 1973), con las variables transformadas según (X + 1) y sin normalizar (Gauch, 1977).
3. RESULTADOS
3.1 Clasificación-Ordenación de los ambientes según La composición de las capturas
El análisis multivariado de clasificación, de tipo exploratorio, de la matriz de datos (Tabla I), se realizó sobre las capturas por especie transformadas según log (X + 1) (Green, 1979). Sólo fueron considerados 31 ambientes dejando fuera del análisis el L. Agrio.
Utilizando como coeficiente de similitud el coeficiente de correlación (CLUST 1) los lagos agruparon en general según su composición en especies (Fig. 2). Los ambientes del agrupamiento A se caracterizan por poseer en común AIR y MAR y los del B por poseer AIR; ambos agrupamientos están formados por lagos típicamente andinos que no presentaron BGDE y sólo un PEJ. El agrupamiento C tiene en común AIR y PEJ sin BGDE y está compuesto por lagos de cordillera (9), de cordillera con extensión hacia la precordillera (12), de precordillera (31) y de planicie con altura superior a 1000 m (13). El agrupamiento D está compuesto por ambientes de planicie y sus elementos tienen en común BGDE y PEJ. El G está compuesto por tres ambientes con características ambientales bastante disímiles, que tienen en común AIR y BCH, ninguno de ellos típicamente andino. El H agrupa sólo a dos ambientes con BCH en común, pero sin ninguna similitud ambiental o en la composición total en especies.
El resto de los ambientes, debido a su composición, forma agrupamientos de un solo elemento al nivel de r = 0.70 analizado. Al nivel de 5 = 0.40, se unen A y B en un solo grupo de 13 lagos andinos con AIR en común, también lo hacen D, E y F con BCH y PEJ, y G, H e I con BCH en común.
Utilizando como coeficiente de disimilitud la distancia euclidiana (Orloci, 1978) (CLUST 2), los lagos parecen agrupar en función de sus CPUE totales además de su composición en especies (Fig. 3). El agrupamiento A presenta lagos típicamente andinos, con CPUE de medias a altas, AIR y MAR en común y solo uno con PEJ. El B agrupa ambientes con características ambientales disímiles, con CPUE de medianas a bajas, ninguno presentó MAR ni BGDE ni es típico de planicie. El C abarca dos embalses de planicie con la misma composición relativa en especies y CPUE altas, y el resto no agrupa a un nivel de análisis de d = 0.90 (Fig. 3).
Los lagos andinos que se agrupan en A y B de la primera ordenación (CLUST 1, Fig. 2) se encuentran en el agrupamiento A del CLUST 2 (Fig. 3), con excepción de los 6, 14 y 16, que aunque presentaron sólo salmónidos, debido a sus CPUE bajas, pasan a agrupar los lagos de tales características.
Como primer paso en la ordenación de los ambientes se realizó un análisis de componentes principales (PCA) con las variables transformadas según log (X + 1) y sin estandarización.
El primer autovector (Tabla II) da cuenta del 41.8 por ciento de la varianza y pesa principalmente la contribución positiva de las variables BCH, BGDE y PEJ, y en menor proporción las negativas de MAR y AIR. El segundo dá cuenta del 26.3 por ciento de la varianza y pesa negativamente, principalmente a AIR y BCH. La posición de los ambientes en un gráfico según las dos primeras variables compuestas PCF-1 y PCF-2 (Fig. 4) nos muestra la formación de, basicamente, cuatro agrupamientos. Uno de ellos con cuatro ambientes, todos de planicie con excepción del 21 pero cuya CPUE estuvo compuesta fundamentalmente por BCH y PEJ. El segundo, y más numeroso, de los agrupamientos, incluye desde lagos típicamente andinos hasta de planicie. Se observó una gradación contínua según PCF-1; a valores negativos son todos lagos andinos y a valores positivos predominan los de precordillera y planicie. Los lagos 2, 23 y 32 forman agrupamientos de un solo elemento. Si se realiza el análisis de PCA con las variables sin transformar pero normalizadas, el patrón de agrupamiento no cambia básicamente, pero la separación entre los dos agrupamientos mayores tiende a desaparecer y los ambientes tienden a ordenarse continuamente según un componente que pesa principalmente BGDE y PEJ como negativas y AIR, MAR y TAR como positivas. Se ordenan así los ambientes según la composición de sus comunidades de peces, desde lagos andinos con comunidades dominadas por salmónidos hacia lagos de planicie con comunidades dominadas por percíctidos y aterínidos.
Un patrón de ordenación similar se obtiene realizando PCA, con log (X + 1), sin considerar a 23, un ambiente precordillerano poco profundo, cuyas CPUE excepcionales contribuyen en mucho a la heterogeneidad de la base de datos. A un sólo autovector que explica el 44 por ciento de la varianza, le corresponde un autovalor mayor que 1; pesa negativamente BCH, BGDE y PEJ, y positivamente MAR y AIR (Tabla III).
Los ambientes se ordenan según un eje salmónidos-percíctidos y aterínidos (Fig. 5, PCF-1) que coincide con un gradiente ambiental que va desde lagos profundos oligotróficos, con altitudes mayores al promedio, y estaciones de crecimiento menores, hacia lagos poco profundos, eutróficos, de altitudes menores y estaciones de crecimiento más prolongadas (Quirós et al., 1984; Tabla I). Es de resaltar la similitud de dicha ordenación con la obtenida realizando el ordenamiento con la frecuencia de salmónidos en la captura (Fig. 6), con la excepción manifiesta del número 30 (L. Cronómetro).
La apreciable heterogeneidad de la base de datos, así como la no linearidad de la distribución de las abundancias por especie, con respecto a los gradientes ambientales subyacentes, hace que PCA no sea el mejor método de ordenación en este caso. Para disminuir dicha heterogeneidad (Gauch, 1977) se dividió el conjunto de ambientes en dos, el primero de ellos incluyendo 18 lagos andinos con concentraciones de clorofila inferiores a 0.75 g m-3 y frecuencia de salmónidos en las capturas superiores a 0.27 y sin BGDE. En PCA a un sólo autovector le corresponde un autovalor mayor que uno, y explica el 50.1 por ciento de la varianza. Pesa, casi exclusivamente AIR y MAR, ordenando los ambientes según su captura en salmónidos.
Los ambientes restantes (N =13), conforman un subconjunto bastante heterogéneo desde el punto de vista ambiental; no presentan TAR y solo uno MAR. En PCA tres autovectores explican un porcentaje de 45.0, 27.8 y 14.1 respectivamente de la varianza total. Es decir, se necesitan tres ejes para ordenar este subconjunto, de acuerdo con su heterogeneidad, tanto ambiental como a nivel de la comunidad de peces (Tabla IV). El primer eje separa los ambientes principalmente según sus abundancias en BCH y el segundo según BGDE y BCH; el tercero a su vez, los separa según AIR y PEJ. Agrupan los ambientes pocos profundos y con CPUE bajas (Fig. 7), que parecen presentar stress a nivel de sus comunidades de peces (5, 13 y 30); los ambientes de planicie tipo embalse, con presencia de BGDE, junto con un lago de planicie de gran superficie y poco profundo y un lago de cordillera - precordillera sin salmónidos (3, 4, 7, 21, 25 y 33); por último permanecen sin agrupar 2, 23 y 32, aunque este último presenta cierta tendencia a hacerlo con el segundo de los agrupamientos considerados. En este subconjunto, aunque la tendencia general es la del conjunto total, los factores históricos deben ser muy importantes en explicar su composición y abundancia de especies.
Además dichas variables están relacionadas en eje espacial oeste-este, con lagos andinos, profundos y genéricamente oligotróficos al oeste, pasando por lagos menos profundos y con moderados niveles de nutrientes en la precordillera, hasta los ambientes de planicie al este, con menores altitudes, mayores niveles de nutrientes y menores profundidades (Fig. 1, y Quirós et al., 1984, Tabla I). De alguna manera dicho eje espacial resume el efecto del conjunto de variables ambientales, tanto a nivel de la abundancia de peces, como a nivel de la estructura de las comunidades. Por ejemplo, y como un enfoque primario a la ordenación ambiental, las abundancias de salmónidos, percíctidos y aterínidos en función de los niveles de clorofila (Fig. 8) parecen presentar máximos a niveles intermedios de clorofila. A su vez, dichos máximos están corridos hacia mayores niveles de clorofila en el orden salmónidos - percíctidos y aterínidos, aunque para este último parecería existir un “plateau”.
La ordenación obtenida según la composición de las capturas (Tabla II, Fig. 4) es explicada por el gradiente ambiental citado. Por ejemplo, tanto la conductividad eléctrica (Fig. 9) como el total de sólidos disueltos, que aumentan desde la región andina hacia la planicie patagónica, explican el 47 por ciento de la variación en PCF-1.
Relacionando la ordenación de ambientes realizadas según la composición de las capturas (PCF-1, Fig. 5) con la ordenación lograda con base en el bloque ambiental (PCA-1) (Fig. 7, Quirós et al., 1984) se puede observar que los ambientes con menores niveles de nutrientes, mayores profundidades y estaciones de crecimiento menos extensas, presentan además las menores biomasas fitoplanctónicas y una comunidad de peces dominada por salmónidos. Los ambientes con características ambientales inversas presentarían los mayores niveles de biomasa fitoplanctónica y una comunidad de peces dominada por percíctidos y aterínidos. En esta doble ordenación, un grupo de ambientes aparece como excepcional (“outliner”), 5, 13 y 30, por presentar características ambientales acordes a una mayor abundancia total de peces.
4. DISCUSION Y CONCLUSIONES
La interpretación de los resultados de la ordenación debe tomar en cuenta, además de las interacciones de las especies entre sí y con el medio ambiente, las causes históricas y las de la mayor o menor interrelación entre los ambientes a causa de su vecindad geográfica (Gauch, 1977). Poco podemos decir sobre las interacciones intra e interespecíficas en los ambientes acuáticos patagónicos, y por lo tanto, nuestro análisis se basará exclusivamente en el resto de tales factores. Por supuesto que ello debe encuadrarse tomando en cuenta el apreciable “ruido” dado el tipo de muestreo extensivo realizado.
El análisis de clusters según el coeficiente de correlación CLUST 1 (Fig. 2) da resultados equivalentes, en general, a los obtenidos con el análisis de componentes principales (Fig. 4), en lo que respecta a la composición en especies de las capturas. El primero separa por un lado agrupamientos que incluyen ambientes de cordillera y precordillera, y por otro ambientes de precordillera y planicie, con comunidades de peces dominadas respectivamente por salmónidos y por percíctidos-aterínidos.
En ambos análisis quedan sin agrupar, o formando agrupamientos de un solo componente, distintos ambientes, ello puede ser explicado por las distintas abundancias absolutas, a través del análisis de clusters basado en el coeficiente de distancia (CLUST 2). Por ejemplo, 23 aparece como un “outlier” en PCA (Fig. 4), y agrupado con 5 y 32 en CLUST 1 por su similitud en la composición, pero se encuentra apartado del primero en CLUST 2 por su abundancie de peces considerablemente mayor. Tanto 5 como 23 son similares en el análisis del bloque ambiental (Quirós et al., 1984) lo que explicaría su similitud en la composición de especies. Sin embargo 5 presentó un hipolimnio a 5 m de profundidad con niveles de oxígeno disuelto por debajo de 2 mg m-3 (Quirós et al., 1984) lo cual representa un ambiente poco favorable para su población de salmónidos, y posiblemente de percíctidos, explicando así la disminuída abundancia de peces.
Otro caso particular, es la relación entre 7 y 27. Tanto en CLUST 1 como en CLUST 2 ambos aparecen separados del resto y más relacionados entre sí, y en PCA se hallan en extremos opuestos del agrupamiento más numeroso. Este puede ser explicado por presentar 27 exclusivamente MAR y por ser las poblaciones de ésta, importantes en 7; además las CPUE en ambos ambientes fueron similares. Ambos son ambientalmente distintos y su similitud sólo podría explicarse por causes históricas, dado que ella está basada en especies introducidas.
El agrupamiento de 18 también presenta problemas, dado que presenta TAR como único componente, y ella es introducida. En CLUST 1 aparece como un “outlier” y en CLUST 2 agrupa con los ambientes con bajas abundancias de peces. Esto último podría ser explicado por el extremo desbalance de su comunidad de peces.
Otro ambiente en el que las causas históricas pueden ser de importancia es 13. Ambientalmente se presenta como poco profundo, genéricamente eutrófico y con una apreciable turbidez de tipo inorgánico. Ello podría explicar las bajas abundancias de salmónidos. Por otra parte, recientemente sufrió la introducción de PEJ y actualmente se presenta como una composición de su comunidad atípica para su caracterización ambiental, pero podría esperarse que la dinámica de las interacciones entre AIR y PEJ lo lleve a un predominio de esta última, con el consiguiente aumento de la abundancia total. Otro caso en que la caracterización ambiental no concuerda totalmente con la composición de especies es el 21 (Fig. 10). Este ambiente se presenta potencialmente apto para soportar poblaciones de salmónidos de importancia, en particular de AIR, pero no fueron detectadas. Ello podría deberse a que nunca fueron introducidas o a una captura excepcional en nuestro muestreo.
La presencia de BCH y BGDE, y en especial de esta última, como especies de importancia en la ordenación de los ambientes de planicie, se encuentra limitada debido a su introducción en otras regiones no incluidas en su distribución geográfica original (Ringuelet, 1975). Ello, creemos, no las invalida, como determinantes en la separación entre ambientes típicamente andinos por un lado y de precordillera y de planicie por otro.
La influencia antrópica, aparte de la introducción de especies, sólo se manifiesta en 2 y 30. El primero de ellos soporta una pesquería comercial, cuyos registros históricos de composición de especies concuerdan con nuestro muestreo. El segundo, 30, aunque potencialmente apto para soportar poblaciones importantes de percíctidos y aterínidos, se encuentra bajo “esfuerzo” provocado por el uso de plagicidas para desparasitar el ganado en sus costas.
La interelación de causas ambientales e históricas que ayudan a explicar la composición en especies de los ambientes, así como el nivel de precisión del muestreo realizado y la posible variación contínua, tanto ambiental como biológica, son las causas fundamentales de que no encontremos una función discriminante basada en el bloque ambiental que nos separe estrictamente dos grupos de ambientes, uno típicamente cordillerano, con predominio de salmónidos y otro precordillerano y de planicie con predominio de percíctidos y aterínidos.
Posiblemente los agrupamientos obtenidos por CLUST 1 y CLUST 2 no representen “tipos” estrictos de ambientes y las estructuras de sus comunidades varían continuamente en el especio ambiental, tal como lo insinúa la relación entre PCF-1 y PCA-1 (Fig. 10), aunque esto, a este nivel de análisis y de información sólo sea materia de especulación.
Es conocido el efecto de los procesos de cambio de “estado trófico” sobre la abundancia y estructura de la comunidad de peces en un determinado ambiente (FAO, 1980), así como, la importancia de poder predecir los efectos de tales cambios. Creemos que la distribución de abundancia de las tres familias de peces consideradas por nosotros, en función de ciertos indicadores de “estado trófico” son de utilidad para predecir cambios en la abundancia y estructura de las comunidades por efecto de la mayor actividad humana. Como ejemplo de tales indicadores podrían utilizarse la concentración de pigmentos fotosintéticos (Fig. 8) o una variable compuesta obtenida por PCA, similar a PCA-1 (Fig. 10), que tome en cuenta sólo parámetros indicadores de “estado trófico”.
La inclusión de las especies correspondientes a los géneros Aplochiton y Galaxias así como el ajuste de la determinación taxonómica y la distribución de los aterínidos y percíctidos presentes en la patagonia argentina, posiblemente mejore en mucho la ordenación obtenida.
En los sistemas ecológicos es raro encontrar que la estructura de datos sea lineal y contínua, cuando en general, las especies responden de una manera no lineal a la influencia ambiental (Orloci, 1979). Y aún una manipulación de los datos, por transformación, sería de poca utilidad en caso en que la base de datos sea fuertemente no lineal, como es el nuestro. Por lo tanto un estudio más profundo de la estructura de la base de datos utilizada permitirá también mejorar la ordenación presentada.
La conclusión principal del presente trabajo es que la abundancia y composición de especies de este conjunto de lagos patagónicos presenta una estructuración acorde a los gradientes ambientales sobre un eje cordillera, precordillera, planicie patagónica y que el clima, la morfometría y las condiciones edáficas, aparte de las históricas, dan cuenta de tal estructuración.
Un análisis de doble ordenación como este, permite comenzar a disponer de una base racional para el manejo de las pesquerías, tanto a nivel de su explotación como al de planificar las políticas de siembra de peces; además de permitir la evaluación de las políticas de introducción de especies tanto pasadas como presentes.
5. BIBLIOGRAFIA
Bruno Videla, P.H., 1944 Algunos controles efectuados sobre peces existentes en la región de los lagos. Rev.Fac.Agron.Vet.Univ.B.Aires, 10(1):1–33
Campos, H., 1970 Introducción de especies exóticas y su relación con los peces de agua dulce de Chile. Notas Mens.Mus.Nac.Hist.Nat.Chile, (14):3–10
Campos, H., 1973 Lista de peces de aguas continentales de Chile. Notas Mens.Mus.Nac.Hist. Nat.Chile, (17):3–14
Campos, H., E. Bucarey y J.N. Arenas, 1974 Estudios limnológicos del Lago Riñihue y Río Valdivia (Chile). Bol.Soc.Biol.Concepción, (48):47–67
Campos, H., et al., 1977 Estudio limnológico, morfométrico, físico y químico del lago Neltume (Valdivia, Chile). Medio Ambiente, 3(1):37–47
Campos, H., 1978 Estudios limnológicos en el lago Pirehueico: morfometría y características físico-químicas. Medio Ambiente, 3(2):76–88
Campos, H., 1978a Physical and chemical limnology of Lake Riñihue (Valdivia, Chile). Arch. Hydrobiol., 84(4):405–29
Campos, H., 1980 Limnologische Untersuchungen an den Seen Pellaifa und Calafquen in Chile. Beitr.Hydrol., 7:99–137
Campos, H., 1981 Morphometrical, physical and chemical limnology of Lake Panguipulli (Valdivia, Chile). Jb.Geol.Paläontol.Mh., 10:603–25
Campos, H., 1982 Limnological study of Lake Ranco (Chile), morphometry, physics, chemistry and plankton. Arch.Hydrobiol., 94:137–71
Campos, H., et al., 1983 Limnological studies in Lake Villarrica. Morphometric, physical, chemical, planktonical factors and primary productivity. Arch.Hydrobiol., Suppl. 65(4):371–406
Conzonno, V.H., et al., 1981 Estudio limnológico en el lago Pellegrini. (Río Negro, Argentina). ECOSUR, 8:153–70
Cordini, I.R., 1939 El lago Nahuel Huapi. Contribución a su conocimiento limnológico. Bol. Minist.Agric.Dir.Minas Geol.Argent., (47):56 p.
Cordini, I.R., 1950 Algunas características limnológicas del lago Nahuel Haupi. An.Mus.Nahuel Huapi Argent., 2:113–27
Cordini, I.R., 1964 El lago Lacar del Parque Nacional Lanín (Neuquén). An.Parques Nac., B.Aires, 10:111–83
Davis, J.C., 1973 Statistics and data analysis in geology. Nueva York, John Wiley y Sons, 550 p.
Delfino, R., et al., 1984 Programa de operación y evaluación del funcionamiento y eficiencia de los pasajes de peces. Inf.INAPE(ROU)/INIDEP(RA), (1):35 p.
Drago, E., 1974 Estructura térmica del lago Mascardi (Provincia de Río Negro, Argentina). Physis (B), 33:207–16
FAO, 1980 Comparative studies on freshwater fisheries. Report of a Workshop held at the Istituto Italiano di Idrobiologia. Pallanza, Italy, 4–8 September, 1978. FAO Fish.Tech.Pap., (198):46 p.
Fuster De Plaza, M., 1950 Reconocimiento y determinación de las especies de salmones introducidos en el Parque Nacional Nahuel Huapi. Publ.Misc.Minist.Agric.Ganad.Argent., (336):1–61
Gauch, H.G., Jr., 1977 ORDIFLEX. Release B. Ecology and systematics. Ithaca, Nueva York, Cornell University, 185 p.
Gonzalez Regalado, T., 1945 Peces de los parques nacionales Nahuel Huapi, Lanín y Los Alerces. An.Mus.Patagonia, Argent., 1:121–8
Green, R.H., 1979 Sampling design and statistical methods for environmental biologists. Nueva York, John Wiley y Sons, 257 p.
INALI, 1972 Patagonian lakes. In Report of IBP/PF Projects. Buenos Aires, Argentina, Instituto Nacional de Limnología/CONICET, pp. 27–44
Löeffler, H., 1959 Limnologische Untersuchungen an chilenischen und peruanischen Binnengewässern. Ark.Geofis., 3(10):155–254
Lund de Castello, H., 1981 Algunos aspectos limnológicos abióticos de las cuencas de los ríos Limay y Neuquén, con especial referencia al embalse Ramos Mexia. ECOSUR, 8:1–27
MacDonagh, E.J., 1950 Las razas de percas o truchas criollas (Percychtys) y su valor para la repoblación pesquera. Rev.Mus.La Plata (Nueva Ser.)(Secc.Zool.), 4:139–93
MACNBR, 1981 Plan de estudios ecológicos de la cuenca del Río Negro. En Informe final de la segunda etapa. Convenio Hidronor S.A./Museo Argentino de Ciencias Naturales Bernadino Rivadavia, Tomo 3:413 p.
Margalef, R., 1983 Limnología. Barcelona, España, Ediciones Omega S.A., 1010 p.
Marini, T.L., 1936 Los salmónidos en nuestro Parque Nacional Nahuel Nuapi. An.Soc.Cient.Argent., B.Aires, 1936:1–24
Orloci, L., 1978 Multivariate analysis in vegetarian research. The Hague, Dr. W. Junk B.V. Publishers, 451 p. 2nd ed.
Orloci, L., 1979 Non-linear data structures and their description. En Multivariate methods in ecological work, editado por L. Orloci, C.R. Rao y W.M. Stiteler. Fairland, Maryland, International Co-operative in Publishing House, pp. 191–202
Quirós, R., S. Cuch y C. Baigun, 1984 Relación entre abundancia de peces y ciertas propiedades físicas, químicas y biológicas en lagos y embalses patagónicos (Argentina). Documento presentado al Taller sobre Ecología y manejo de peces en lagos naturales y artificiales. FAO/Unesco/Universidad de Chile, 5–10 noviembre 1984, Santiago, Chile (mimeo)
Quirós, R., et al., 1984 Características morfométricas, químicas y físicas de 33 lagos patagónicos (Argentina). Contrib.Nac.Invest.Desarr.Pesq., B.Aires
Ringuelet, R.A., 1975 Zoogeografía y ecología de los peces de aguas continentales de la Argentina y consideraciones sobre las áreas ictiológicas de América del Sur. ECOSUR, 2(3):1–122
Ryder, R., 1981 Recomendaciones para el gobierno argentino (INIDEP) para implementar un inventario de los recursos de pesca continental. B.Aires, INIDEP (Traducción), 29 p.
Tonn, W.M., J.J. Magnuson and A.M. Forbes, 1983 Community analysis in fishery management: an application with northern Wisconsin lakes. Trans.Am.Fish.Soc., 112:368–77
Tabla I
Lista de ambientes y capturas totales (CPUE) y por especie (en kg/batería noche)
| CPUE | AIR | MAR | BCH | BGDE | TAR | PEJ | ||
| 1 | - L Agrio | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 |
| 2 | - L. Pollogrini | 50.8 | 0.0 | 0.0 | 0.0 | 18.6 | 0.0 | 32.2 |
| 3 | - E. Mari Menuco | 31.4 | 2.1 | 0.0 | 4.2 | 11.6 | 0.0 | 13.5 |
| 4 | - E. Los Barreales | 14.3 | 5.2 | 0.0 | 0.8 | 7.7 | 0.0 | 0.6 |
| 5 | - L. Blanca | 5.6 | 2.4 | 0.0 | 3.2 | 0.0 | 0.0 | 0.0 |
| 6 | - L. Aluminé | 1.2 | 1.2 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 |
| 7 | - E. Ramos Mexia | 14.3 | 0.9 | 5.9 | 3.4 | 2.4 | 0.0 | 1.7 |
| 8 | - L. Norquinco | 3.5 | 3.0 | 4.4 | 0.4 | 0.0 | 0.6 | 0.0 |
| 9 | - L. Quillen | 3.1 | 1.4 | 0.0 | 0.7 | 0.0 | 0.0 | 1.0 |
| 10 | - L. Huechulaufquen | 36.8 | 32.7 | 4.0 | 0.0 | 0.0 | 0.0 | 0.0 |
| 11 | - L. Lacar | 11.9 | 9.2 | 2.1 | 0.5 | 0.0 | 0.0 | 0.0 |
| 12 | - L. Nahuel Huapl | 10.0 | 3.3 | 0.0 | 2.1 | 0.0 | 0.9 | 3.7 |
| 13 | - L. Ne-Luan | 5.8 | 4.2 | 0.0 | 0.0 | 0.0 | 0.0 | 1.6 |
| 14 | - L. Cutierrez | 7.9 | 7.9 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 |
| 15 | - L. Mascardi | 25.2 | 8.3 | 15.3 | 0.0 | 0.0 | 1.1 | 0.0 |
| 16 | - L. Guillelmo | 4.3 | 3.7 | 0.0 | 0.0 | 0.0 | 0.6 | 0.0 |
| 17 | - L. Steffen | 14.8 | 5.4 | 9.8 | 0.0 | 0.0 | 0.0 | 0.0 |
| 18 | - L. Las Chultas | 1.8 | 0.0 | 0.0 | 0.0 | 0.0 | 1.7 | 0.0 |
| 19 | - L. Epuyen | 5.0 | 0.2 | 0.0 | 3.4 | 0.0 | 1.1 | 0.2 |
| 20 | - L. Puelo | 15.2 | 5.0 | 2.6 | 6.9 | 0.0 | 0.0 | 0.7 |
| 21 | - L. Lezama | 22.6 | 0.0 | 0.0 | 10.8 | 0.0 | 0.0 | 11.9 |
| 22 | - L. Rivadnvia | 12.7 | 10.5 | 1.2 | 0.4 | 0.0 | 0.6 | 0.0 |
| 23 | - L. Esquel | 200.5 | 44.2 | 0.0 | 136.3 | 0.0 | 0.0 | 0.0 |
| 24 | - L. Verdo | 20.0 | 10.4 | 5.8 | 3.8 | 0.0 | 0.0 | 0.0 |
| 25 | - E. Fl. Ameahino | 47.1 | 2.7 | 0.0 | 9.1 | 23.1 | 0.0 | 12.2 |
| 26 | - L. Futalaufquen | 13.7 | 6.2 | 6.2 | 1.1 | 0.0 | 0.2 | 0.0 |
| 27 | - L. Largo | 12.1 | 0.0 | 12.1 | 0.0 | 0.0 | 0.0 | 0.0 |
| 28 | - L. Kruger | ? | - | - | - | - | - | - |
| 29 | - E. Amutui Quimei | 8.9 | 3.2 | 5.1 | 0.0 | 0.0 | 0.5 | 0.0 |
| 30 | - L. Cronómetro | 1.9 | 0.0 | 0.0 | 1.0 | 0.0 | 0.0 | 0.0 |
| 31 | - L. Rosario | 31.5 | 7.6 | 0.0 | 0.0 | 0.0 | 0.0 | 23.6 |
| 32 | - L. Musters | 53.1 | 6.8 | 0.0 | 48.4 | 1.2 | 0.0 | 1.7 |
| 33 | - L. Colhue Huapi | 43.9 | 0.0 | 0.0 | 26.1 | 16.2 | 0.0 | 1.6 |
Tabla II
Primeros tres autovectores, autovalores y varianza explicada, del PCA, sobre 31 ambientes, con seis variables de abundancia por “especie”, transformadas según log (X + 1)
| I | II | III | |
| λ | 2.488 | 1.563 | 0.775 |
| % | 41.79 | 26.25 | 13.01 |
| AIR | -0.219 | -0.526 | 0.646 |
| MAR | -0.392 | -0.043 | 0.452 |
| BCH | 0.510 | -0.766 | -0.207 |
| BGDE | 0.513 | 0.191 | 0.400 |
| TAR | -0.058 | 0.034 | -0.088 |
| PEJ | 0.522 | 0.312 | 0.409 |
Tabla III
Primeros dos autovectores, autovalores y varianza explicada, del PCA, sobre 30 ambientes (sin 23), con seis variables de abundancia por “especie”, transformadas según log (X + 1)
| I | II | ||
| λ | 2.350 | 0.876 | |
| % | 44.11 | 16.44 | |
| AIR | 0.319 | 0.251 | |
| MAR | 0.435 | 0.357 | |
| BCH | -0.439 | 0.795 | |
| BGDE | -0.481 | 0.175 | |
| TAR | 0.056 | -0.052 | |
| PEJ | -0.530 | -0.379 | |
Tabla IV
Primeros tres autovectores, autovalores y varianza explicada, del PCA sobre 13 ambientes con cinco variables de abundancia por “especie” transformadas según log (X + 1)
| I | II | III | |
| λ | 3.357 | 2.07 | 1.049 |
| % | 45.01 | 27.75 | 14.06 |
| AIR | 0.391 | -0.062 | 0.653 |
| MAR | -0.010 | -0.023 | -0.148 |
| BCH | 0.700 | 0.610 | -0.002 |
| BGDE | -0.350 | 0.728 | -0.242 |
| PEJ | -0.484 | 0.306 | 0.702 |
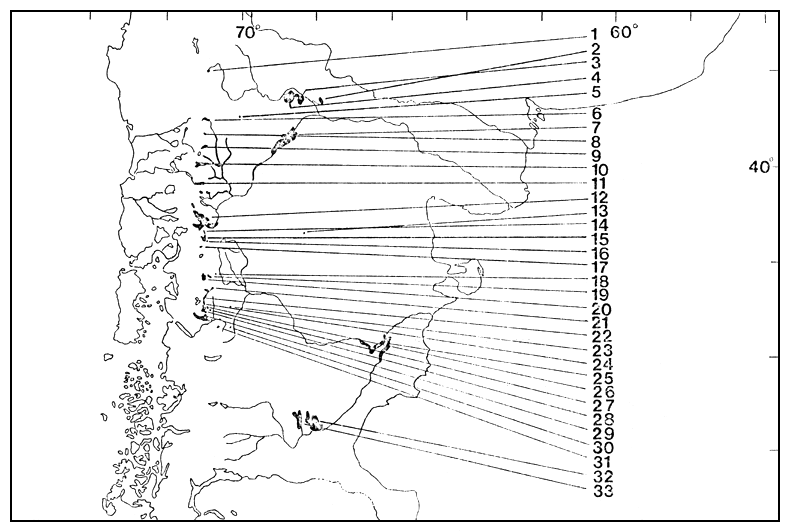
Fig. 1. Región patagónica considerada y ubicación geográfica de los ambientes muestreados (ver Tabla I)
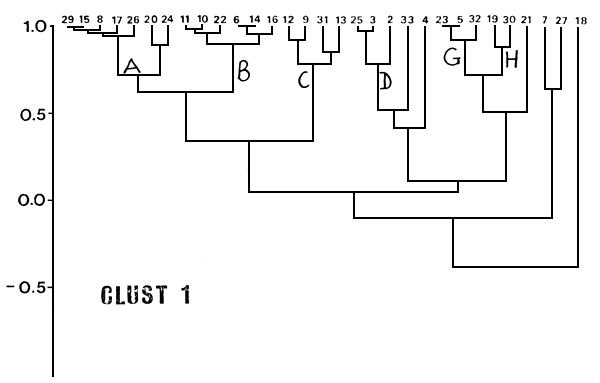
Fig. 2. Dendograma resultante del análisis de agrupamientos según el coeficiente de correlación (CLUST 1).
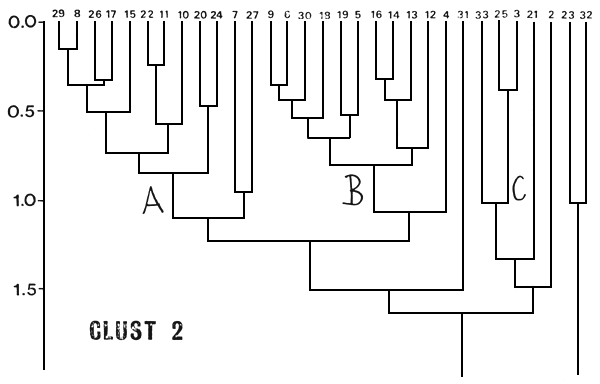
Fig. 3. Dendograma resultante del análisis de agrupamientos según el coeficiente de distancia euclidiana (CLUST 2).
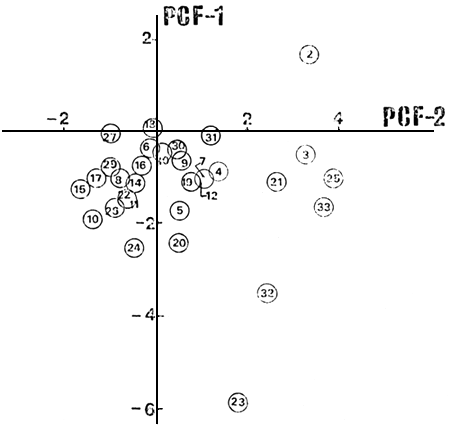
Fig. 4. Posición de los ambientes en el espacio de componentes principales, según las abundancias en especies.
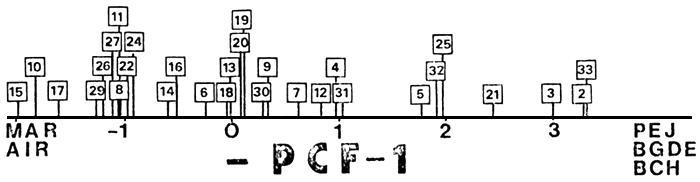
Fig. 5. Posición de los ambientes según el primer eje de ordenación ambiental (N = 30), (ver explicación en el texto).
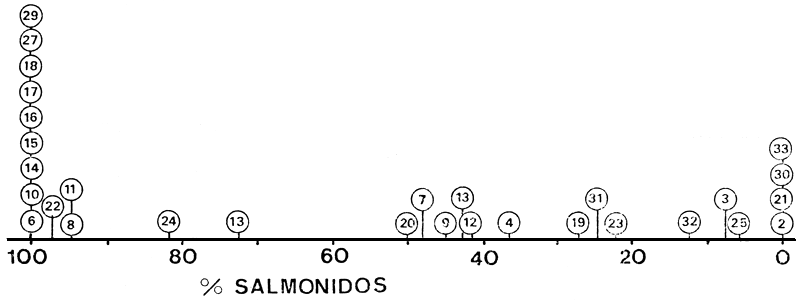
Fig. 6. Posición de los ambientes (N = 31) según su frecuencia de salmónidos en la captura.
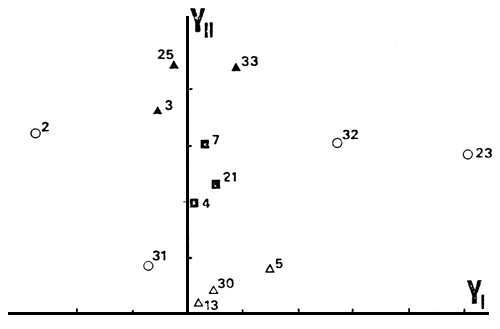 | 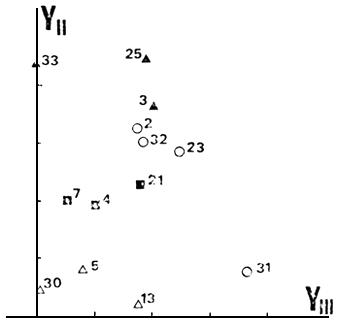 |
Fig. 7. Posición de 13 ambientes en el espacio de componentes principales según las abundancias en especies (ver explicación en el texto).
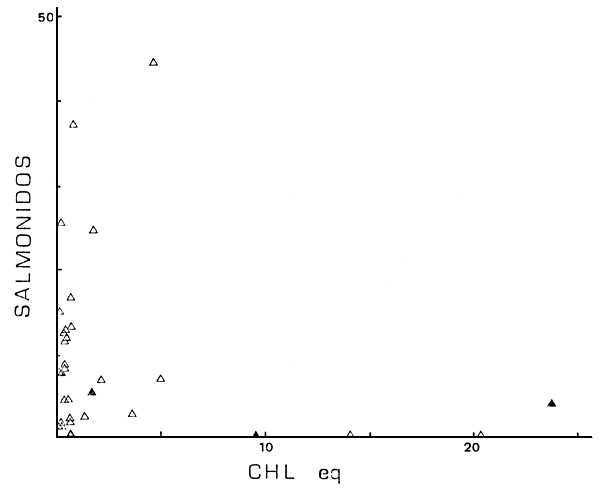
Fig. 8a. CPUE de salmónidos vs Chleq (en mg m-3), (▲), en ambientes con “stress” ambiental manifiesto.
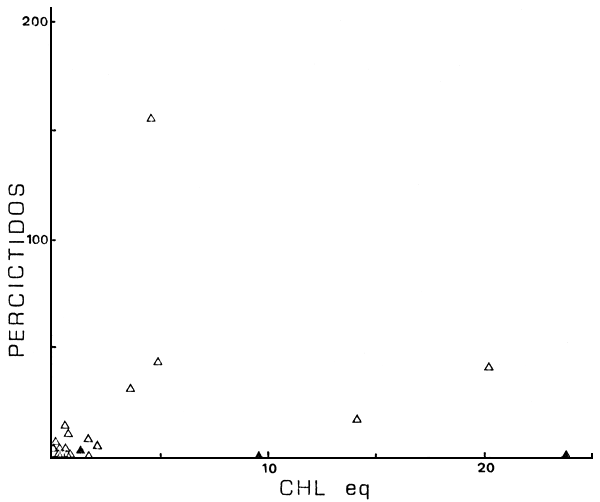
Fig. 8b. CPUE de percíctidos vs Chleq (en mg m-3). (▲), ambientes con “stress” ambiental manifiesto.
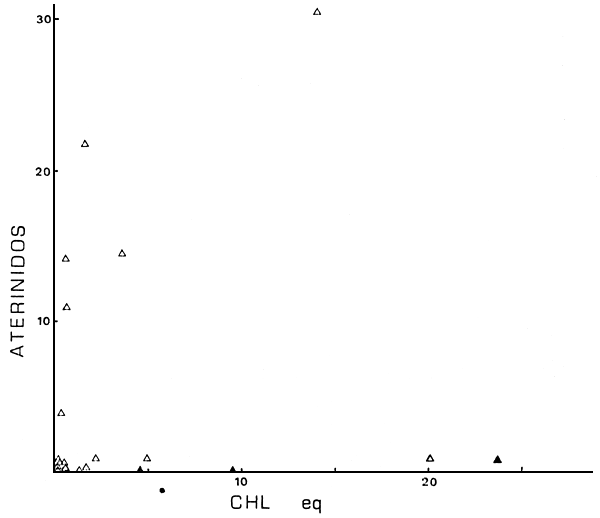
Fig. 8c. CPUE en aterínidos vs Chleq (en mg m-3). (▲), ambientes con “stress” ambiental manifiesto.
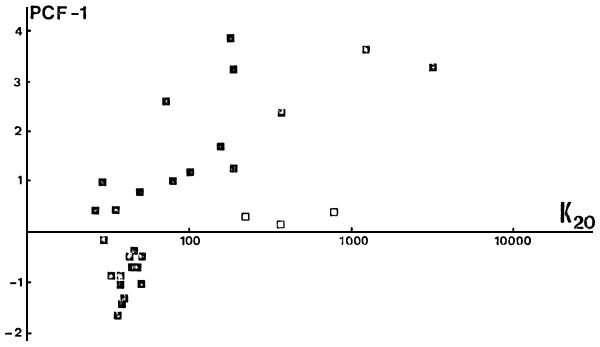
Fig. 9. Primer eje de ordenación según la abundancia de “especies” (PCF-1) vs la conductividad eléctrica (K20)
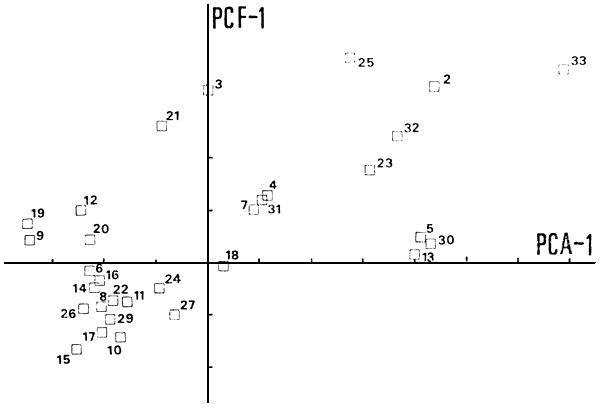
Fig. 10. Posición de los ambientes en los espacios de componentes principales. PCF-1, primer eje de ordenación según las abundancias en “especies”; PCA-1, primer eje de ordenación según sus características ambientales.