por
R. Quirós, S. Cuch y C. Baigún
Instituto Nacional de Investigación y Desarrollo Pesquero
Mar del Plata, Argentina
Resumen
Durante el verano de 1984 se realizó un muestreo limnológico-pesquero sobre un conjunto de 33 lagos y embalses patagónicos. Dicho conjunto se presenta como altamente heterogéneo en lo que respecta a sus características climáticas, morfométricas, edáficas e hidrológicas.
Las abundancias totales de peces, determinadas como captura por unidad de esfuerzo (CPUE) se relacionan positivamente con la temperatura media anual del aire, los niveles de sólidos disueltos y de nutrientes y la concentración de pigmentos fotosintéticos en superficie, y negativamente con la altitud, la profundidad media y la visibilidad del disco de Secchi.
Los ambientes acuáticos se ordenan, con respecto a sus mayores abundancies de peces, en un eje oeste-este, desde la cordillera de los Andes hacia la planicie patagónica.
A pesar de que los lagos andinos tienen comunidades de peces dominadas por salmónidos y los de planicie por percíctidos y aterínidos, la abundancia total de peces parece ser independiente de la composición en especies de la comunidad.
Abstract
During the summer of 1984 a limnological fisheries sampling was performed on a set of 33 patagonian lakes and reservoirs. This set appears as highly heterogeneous with respect to its climatic, morphometric, edaphic and hidrological characteristics.
The total fish abundances determined as capture per unit effort (CPUE) are positively related with the annual mean temperature of the air, the dissolved solids and nutrients levels and the surface photosynthetic pigment levels, and negatively connected with lake altitude, mean depth and Secchi disc visibility.
The aquatic environments show, with respect to their fish abundances a disposition on a west-east axis, from the Andean range towards the Patagonian plain.
Although the Andean lakes have fish communities dominated by salmonids and those in the plain by percichthyids and atherinids, the total fish abundance seems to be independent of the species composition of the community.
1. INTRODUCCION
Los ambientes acuáticos patagónicos son poco conocidos y la información disponible escasa (Quirós y Baigún, 1984) lo cual impidió, a la fecha, cualquier análisis global de este conjunto. El hecho de que las generalizaciones realizadas a partir de un estudio intensivo en un ambiente acuático o en un número pequeño de ellos puedan ser válidas como no serlo (Collins y Sprules, 1983), nos llevó a un planteamiento de tipo extensivo en el intento de relacionar la abundancia de peces con las características limnológicas en un conjunto amplio de lagos y embalses patagónicos (Ryder, 1981).
Es conocido el valor predictivo de la profundidad media (Rawson, 1955), el total de sólidos disueltos (Rawson, 1951), los niveles de nutrientes (Hanson y Legget, 1982), la biomasa del fitoplancton (Oglesby, 1977), la temperatura media ambiente del aire (Schlesinger y Regier, 1982), entre otros parámetros, como predictores del rendimiento pesquero potencial en conjuntos homogéneos de lagos. Varias de tales relaciones mostraron ser válidas también en embalses (Jenkins, 1976, 1982) tanto como predictores de rendimiento pesquero como de biomasa. También es conocido el valor predictivo de variables compuestas como el índice morfoedáfico (MEI) (Ryder, 1965) que relaciona el efecto combinado de la morfometría y el de los niveles de nutrientes con los rendimientos pesqueros.
Es reconocida también la utilidad de los muestreos limnológicos-pesqueros, de carácter extensivo, con el fin de obtener indicadores válidos de la producción potencial de ambientes acuáticos (Northcote y Larkin, 1956).
Además de los mencionados enfoques univariados, sea este con una variable simple o compuesta, un enfoque de tipo multivariado puede permitir una mayor profundización en la comprensión de las relaciones de grupos de especies con la base de datos ambientales (FAO, 1980).
Es nuestro propósito el obtener relaciones entre abundancia de peces y variables simples y compuestas que nos permitan ordenar relativamente los ambientes acuáticos patagónicos según sus abundancias de peces. Dicho ordenamiento nos permitirá poseer una base empírica mínima para estimar sus producciones totales de peces.
2. MATERIALES Y METODOS
2.1 Descripción del conjunto de ambientes
El conjunto de ambientes acuáticos considerado se halla ubicado en una región que se extiende entre 60°40' y 71°40'W, desde aproximadamente 100 km de la costa atlántica hasta la cordillera de los Andes, y entre 37°55' y 43°05'S en una región que abarca desde el sur del R. Colorado hasta el sur de la Provincia del Chubut (Fig. 1; Quirós y Baigún, 1984). Dicha región abarca tipos de clima templados, desde el árido de meseta al este hasta el húmedo andino al oeste. Las precipitaciones medias anuales del aire van desde los 200 mm y 13°C al este hasta 800 mm y 5°C al oeste respectivamente; ellas en general disminuyen en el sentido norte-sur y pueden variar con la altitud que aumenta de este a oeste. Los suelos, en general, son del tipo Aridisoles con presencia de Vertisoles en la planicie patagónica, tienden a ser de tipo Vertisoles con presencia de Aridisoles hacia el noroeste y del tipo Inceptisoles con Molisoles hacia el oeste en dirección a la cordillera de los Andes.
Con respecto a la morfometría, comprende desde lagos profundos de origen glacial en la cordillera, lagos de profundidad intermedia en la precordillera y grandes lagos, pero poco profundos al sudeste sobre la meseta patagónica. Abarca además lagos pequeños y muy poco profundos (“lagunas”) y embalses formados sobre lagos, en depresiones de la meseta y por creación de represas en valles de ríos; sus tiempos medios de permanencia del agua varian entre más de diez y menos de un año (Quirós et al., 1984). Presenta además lagos cordilleranos de vertiente pacífica y de vertiente atlántica. El conjunto de ambientes es, por lo tanto, sumamente heterogéneo en lo que respecta a sus condiciones climáticas, morfométricas, edáficas e hidrológicas (Tabla I).
2.2 Muestreo limnológico extensivo
Abarcó la realización de la batimetría por ecosondaje en 16 lagos andinos, y por el uso de una soga graduada en metros y un contrapeso, en los lagos más pequeños de la Provincia del Chubut (18, 23, 27, 30 y 31). Las características morfométricas del resto de los ambientes fue tomada de la literatura (Quirós et al., 1984).
En cada ambiente tipo lago fue ubicada una sola estación en su parte más profunda; en los lagos con más de una cubeta se ubicaron dos estaciones limnológicas. En los ambientes tipo embalse se ubicó una estación en una “zona de integración” cercana a la represa (Quirós et al., 1984).
El muestreo limnológico en sí, se extendió entre febrero 10 y abril 10 de 1984, y cada ambiente fue muestreado una sola vez. Incluyó la determinación de perfiles de temperatura, oxígeno disuelto, conductividad y potencial redox; la determinación de la alcalinidad total a tres profundidades, la lectura del disco de Secchi, la turbidez y el color real previa filtración por membrana de 0.45 μ. Se tomó una muestra a 0.5 m de profundidad, sin conservador sobre la cual se determinaron los aniones y cationes mayores. Otra muestra, con H2SO4 como conservador, fue tomada para la determinación de fósforo total, nitrógeno orgánico total y demanda química de oxígeno al dicromato.
Para la determinación de los pigmentos fotosintéticos se filtraron muestras a través de filtros Whatman GF/C sobre carbonato de magnesio. Los filtros fueron conservados en la oscuridad y sobre sustancias desecantes. Todas las muestras fueron mantenidas refrigeradas y todas las determinaciones analíticas se realizaron por duplicado. Las técnicas analíticas utilizadas se describen en Quirós et al., 1984.
El muestreo de peces, así como la metodología de análisis utilizada, se detalla en Quirós y Baigún, 1984.
También se tomaron muestras integradas por etapas, con red, de zooplancton y de fitoplancton.
2.3 Análisis de los datos
Como variables, a ser explicadas en el presente análisis, se tomaron la captura por unidad de esfuerzo (CPUE), y las capturas por especie (en realidad entidades taxonómicas, ver Quirós y Baigún, 1984) según: Salmo gairdneri (AIR), Salmo trutta (MAR), Percichthys trucha (BCH), Percichthys colhuapiensis (BGDE), Salvelinus fontinalis (TAR) y familia Atherinidae (PEJ).
Las variables del bloque ambiental se eligieron tal que sean representativas de la situación climática, morfometría, transparencia, niveles de nutrientes y abundancia de fitoplancton. Se realizó un análisis de regresión y correlación simple (Draper y Smith, 1966) tomando como variables dependientes la CPUE total y por especie, y como independientes: temperaturas del aire media anual (TAMB), período libre de heladas (PLH), altitud (ALT), profundidad media (Z), lectura del disco de Secchi (LS), color real (COL), alcalinidad total (TA), sólidos disueltos totales (TDS), concentración de pigmentos fotosintéticos totales (Chleq), fósforo total (PT), nitrógeno orgánico total (NOT) y carbono orgánico total (COT). Previo al análisis, las variables ambientales y la CPUE fueron transformadas logaritmicamente, en cambio las abundancias por especie fueron transformadas según log (X + 1). También se consideró una variable compuesta MEI (TDS Z-1), (Ryder, 1965). Las pruebas de significación, en los análisis de correlación y de regresión fueron realizadas según los tests de t y de F, respectivamente.
La información climática y ALT corresponden a Quirós et al., 1983, modificada según Quirós y Drago, 1984. Tanto TAMB como PLH se consideran de baja precisión en particular entre los ambientes de la región cordillerana.
Sobre el bloque de variables ambientales se realizó un análisis de componentes principales (PCA) con el objeto de reducir la base de datos (Davis, 1973) y obtener variables compuestas, no correlacionadas, para ser utilizadas en un análisis de regresión-correlación posterior (Zimmerman et al., 1983).
Las variables fueron transformadas logarítmicamente y luego normalizadas. El análisis de PCA se realizó también sobre las variables no transformadas y normalizadas; los resultados obtenidos en la ordenación de ambientes fueron similares.
Dada la heterogeneidad de la base de datos ambientales (Tabla I) y la presencia de casos excepcionales (“outliers”) con respecto a las abundancias totales de peces, y con respecto a las características ambientales, el análisis se realizó por etapas. Ello permite aumentar progresivamente la homogeneidad del conjunto y hallar causas probables de cada caso excepcional.
El análisis se efectuó sobre el conjunto de lagos (N = 31) en los cuales se realizaron muestreos de peces (Quirós y Baigún, 1984) con excepción de L. Agrio, cuya cuenca de drenaje abarca una región volcánica, que presentó un pH de 2.7 en toda la columna de agua (Quirós et al., 1984) y en el cual durante dos noches de muestreo no fue capturado ningún pez.
Los ambientes 5, 13 y 30 fueron separados luego de la primera etapa del análisis. El primero de ellos presentó un hipolimnio a 5 m de profundidad con niveles de oxígeno inferiores a 2 g m-3; el segundo, además de ser un ambiente poco profundo y con turbidez de tipo inorgánico apreciable, sufrió en los últimos cinco años la introducción de PEJ, y el tercero parece sufrir un “stress” ambiental debido al uso de biocidas, sobre sus costas, con el objeto de desparasitar el ganado.
Luego de la segunda etapa del análisis, sobre el conjunto restante (N = 28), se eliminan los lagos 2 y 33. Ambos presentan aguas de tipo cloruro-sulfato a diferencia de los restantes lagos, con tipos de agua carbonato-bicarbonato, y el segundo alta turbidez inorgánica (Quirós et al., 1984). Al finalizar la tercera etapa del análisis se deja de lado el ambiente 23, de escasa profundidad media y abundante macrofitia, que presentó capturas de peces excepcionalmente altas (Quirós y Baigún, 1984).
En todo el análisis se presupone que las CPUE total y por especie son indicadores válidos de las respectivas abundancias de peces.
3. RESULTADOS
El análisis de correlación del bloque de variables ambientales, para el conjunto total de ambientes (N = 31), muestra que todas las variables con excepción de ALT se encuentran significativamente correlacionadas (Tabla II). De ellas correlacionan significativamente con CPUE las siguientes: TAMB, TDS, K20, COT y CHleq al nivel de significación de 0.05 y sólo ALT al nivel de 0.01. De ellas Chleq y TAMB serían los mejores predictores de las abundancias por especie (Tabla III).
La primera reducción del número de ambientes (N = 28, sin 5, 13 y 30) disminuye la relación de COL con el resto de las variables ambientales, pero aumenta la de ALT, manteniéndose el bloque de variables ambientales altamente relacionado. Todas ellas correlacionan significativamente con CPUE, explicando Chleq el 40 por ciento de la variación en la misma (r = 0.631, P < 0.001) (Fig. 1), y LS, PT y TDS porcentajes de 38, 35 y 33 respectivamente (Figs. 2, 3 y 4). El MEI explica sólo el 30 por ciento de la variación en CPUE (Fig. 5), pero el conjunto es aún sumamente heterogéneo como para cumplir con las condiciones de su aplicación (Ryder, 1978). Tanto TA como Chleq serían los mejores predictores de las abundancias por especies.
Realizando el análisis sobre 28 como sobre cualquier número intermedio de ambientes hasta 25, tanto MEI como Z, PT, NOT, COT y Chleq llegan a explicar, en la relación lineal, un porcentaje de la varianza en CPUE, mucho mayor que en la relación logarítmica. Aunque ello Ileva a que no se cumplan algunas de las condiciones necesarias para un análisis de regresión, dichas relaciones pueden ser de utilidad práctica en la estimación de abundancias totales de peces, en especial a valores altos de la variable independiente. Por ejemplo, en la relación lineal entre CPUE y PT (N = 27), esta última explica el 89 por ciento de la variación en la primera (Fig. 6). En dicha relación fue dejado de lado el L. Colhue Huapi (33) por presentar alta turbidez de tipo inorgánico y altos niveles de PT ligados a ella.
En el análisis sobre 26 ambientes (sin 2 y 33) las relaciones del COL solo se mantienen significativas con LS, Chleq, NOT y COT. Las de ALT sólo con los niveles de sólidos disueltos, LS, PLH y TAMB. La CPUE correlaciona significativamente con todas las variables del bloque ambiental con excepción de COL, PLH y ALT, siendo Chleq y PT las que explican el mayor porcentaje de su variación. TA y Chleq siguen siendo los mejores predictores de las abundancias por especies, siempre con excepción de AIR.
El análisis sobre 25 ambientes da resultados similares al anterior, a nivel de la matriz de correlación del bloque ambiental de variables (Tabla IV). CPUE correlaciona significativamente con todas las variables ambientales con exclusión de Z, NOT, COL, PLH y MEI (Tabla 5). La no correlación significativa con la última de esas variables se debe fundamentalmente a que, al eliminar 23 del análisis, prácticamente se desbalancea la base de datos total, debido fundamentalmente a las capturas relativamente altas para sus características ambientales en 10 y 15, y las relativamente bajas en 18. Este último caso no podría considerarse un caso excepcional de captura, ya que fue muestreado en cinco oportunidades y muestra, además, un excesivo desbalance de su comunidad de peces (Quirós y Baigún, 1984). El mayor porcentaje de la variación en CPUE es explicado por LS y Chleq, y a nivel de especies por TA, K20 y Chleq, sin embargo ninguna de las variables del bloque ambiental explica la abundancia de AIR en la relación logarítmica.
En el análisis de componentes principales (PCA) del bloque ambiental de variables, sobre el conjunto total de lagos (N = 31), el primer autovector (Tabla VI) explica el 65.8 por ciento de la variación total y pesa positivamente la TAMB y las variables ligadas a los niveles de nutrientes y de sólidos disuelto, por otra parte pesa negativamente Z y LS. En el segundo autovector que explica el 13.5 por ciento de la variación pesan fundamentalmente las variables ligadas a las condiciones climáticas y la altitud.
Los ambientes se ordenan sobre el primer eje (PCA-1) según sus mayores niveles de sólidos disueltos y de nutrientes y TAMB, y según sus menores transparencias y profundidades medias (Fig. 7). Sobre el segundo eje (PCA-2) según sus menores TAMB, PLH, y sus mayores altitudes. El primer eje coincide, en primera aproximación, con el eje físico oeste-este desde la cordillera de los Andes hacia la planicie patagónica pasando por la precordillera. El segundo eje ordena a su vez los ambientes de cordillera según su altitud, y a los restantes los ordena según sea de precordillera o de planicie.
El análisis de PCA se repitió para los distintos conjuntos de ambientes previa separación de los casos excepcionales, los resultados obtenidos son aproximadamente equivalentes.
Como una forma de evaluar la capacidad predictiva de las nuevas variables compuestas obtenidas se las correlacionó linealmente con CPUE y las abundancias por especie. Los resultados obtenidos (Tabla VII) indican a las respectivas PCA-1 como mejores predictores de la CPUE en los conjuntos más homogéneos de 26 y 25 ambientes. Por ejemplo, PCA-1 explica el 52 por ciento de la variación en CPUE para N = 25, siendo la regresión altamente significativa (F = 24.4, P < 0.001), quedando fuera de los límites del 95 por ciento de confianza sólo 10 y 18.
Aunque las abundancias por especie correlacionan significativamente con las variables simples tanto como con las compuestas obtenidas por PCA, dichas relaciones parecen tener sólo valor predictivo. La distribución de abundancias por especies en función de las variables simples y compuestas no es lineal, ni se lineariza por transformación logarítmica (Quirós y Baigún, 1984) lo cual constituye una limitación importante de las técnicas utilizadas (FAO, 1980).
4. DISCUSION Y CONCLUSIONES
Dada la heterogeneidad ambiental de la muestra, resulta muy difícil, sino imposible, adjudicar causalidad a determinadas características ambientales sobre la abundancia de peces. En general, los ambientes con mayores temperaturas ambientes y menores altitudes, que presentan también los niveles de nutrientes más elevados y las menores profundidades, tienen a su vez las mayores abundancias de peces. Confluyen así en una misma dirección los factores climáticos, morfométricos y edáficos, que afectan la productividad de un lago (Rawson, 1955).
El análisis del efecto de TAMB hemos decidido no profundizarlo, dada la baja precisión de dicha información, en especial en la región cordillerana. Lo anterior no invalida la comparación de los lagos cordilleranos y los de la planicie con respecto a dicho parámetro (Quirós y Drago, 1984). Por otra parte está demostrada su utilidad en el desarrollo de modelos globales de estimación de rendimiento pesquero potencial (Schlesinger y Regier, 1982).
El nivel de clorofila en el epilimnio se mantiene a lo largo de todos los análisis realizados hasta N = 25, como el mayor predictor de la abundancia total de peces, y uno de los mejores a nivel de especies y de familias de peces. Sin embargo, tampoco da cuenta de la distribución de abundancia de Salmo gairdneri, posiblemente por la captura excepcional en el lago Huechulaufquen (Quirós y Baigún, 1984).
Este conjunto de lagos y embalses se caracteriza por una comunidad de peces dominada por salmónidos en los lagos cordilleranos y por percíctidos y aterínidos en la planicie patagónica. Sin embargo, la abundancia total de peces parece ser independiente de la composición de especies, y depender solamente del gradiente ambiental. Creemos que este resultado es de importancia ecológica por el hecho de presentar un ejemplo de uniformidad no dependiente de la estructura de la trama trófica (Ryder et al., 1974; Kerr, 1974).
El análisis de regresión simple de CPUE versus determinadas variables indicadoras de la producción potencial de peces en un ambiente acuático, por ejemplo la profundidad media, los niveles de nutrientes y la biomasa del fitoplancton (Rawson, 1951, 1955; Oglesby, 1977; Ryder, 1965) los indica como buenos predictores de la abundancia relativa de peces en este conjunto de lagos patagónicos (Tabla VIII, Figs. 1 a 5) previa eliminación del análisis de aquellos que presentan “stress” manifiesto a nivel de comunidades de peces. La consideración de otros factores contemplados en el presente análisis, por ejemplo, un estudio más detallado del efecto de la morfometría, del tiempo de permanencia del agua y de la estructura térmica (Quirós y Drago, 1984), así como de la tipología de aguas, permitirá acotar aún más tales predicciones.
Una de las razones de que tales relaciones resulten significativas es la extrema variabilidad ambiental de la muestra, pero ella fue seleccionada así, “a priori”, con el objeto de disminuir el efecto del extremo “ruido” producido por el carácter extensivo de nuestro muestreo. Creemos que lo que perdimos en precisión lo ganamos en la comprensión general del sistema de lagos andino-patagónicos y sus comunidades de peces asociadas. Ellos nos permite una ordenación primaria y provisoria de tales lagos, con la información limnológica adecuada y dentro del rango ambiental de nuestra muestra, según sus abundancias relativas de peces.
5. BIBLIOGRAFIA
Collins, N. and W.G. Sprules, 1983 Introduction to large-scale comparative studies of lakes. Can.J.Fish.Aquat.Sci., 40(10):1750–1
Davis, J.C., 1973 Statistics and data analysis in geology. Nueva York, John Wiley y Sons, 550 p.
Draper, N. and H. Smith, 1966 Applied regression analysis. Nueva York, John Wiley y Sons, 407 p.
FAO, 1980 Comparative studies on freshwater fisheries. Report of a Workshop held at the Istituto Italiano di Idrobiologia. Pallanza, Italy, 4–8 September 1978. FAO Fish.Tech.Pap., (198):46 p.
Hanson, J.M. and W.C. Leggett, 1982 Empirical prediction of fish biomass and yield. Can.J.Fish. Aquat.Sci., 39(2):257–63
Jenkins, R.M., 1976 Prediction of fish production in Oklahoma reservoirs on the basis of environmental variables. Ann.Okla.Acad.Sci., 5:11–20
Jenkins, R.M., 1982 The morphoedaphic index and reservoir fish production. Trans.Am.Fish.Soc., 111:133–40
Kerr, S.R., 1974 Structural analysis of aquatic communities. En Proceedings of the First International Congress of ecology, editado por W.H. van Dobben, G.R. Gradwell and A.J. Cave. Wageningen, Centre for Agricultural Publications and Documentation, pp. 69–74
Northcote, T.G. and P.A. Larkin, 1956 Indices of productivity in British Columbia lakes. J.Fish.Res.Board Can., 13(4):515–40
Oglesby, R.T., 1977 Relationships of fish yield to lake phytoplankton standing crop, production, and morphoedaphic factors. J.Fish.Res.Board Can., 34(12):2271–9
Quriós, R. y C. Baigún, 1984 Prospección pesquera en 33 lagos y emblases patagónicos (Argentina). Documento presentado al Taller Internacional sobre Ecología y manejo de peces en lagos naturales y artificiales. FAO/Unesco/Universidad de Chile, 5–10 noviembre 1984, Santiago, Chile (mimeo)
Quirós, R. y E. Drago, 1984 Relación entre variables físicas, morfométricas y climáticas en lagos patagónicos (inédito)
Quirós, R. et al., 1983 Diccionario geográfico de ambientes acuáticos continentales de la República Argentina. Parte I, Ambientes lénticos. Contrib.Inst.Nac.Invest. Desarr.Pesq., B.Aires, (435):475 p.
Quirós, R., et al., 1984 Características morfométricas, químicas y físicas de 33 lagos patagónicos (Argentina). Contrib.Inst.Nac.Invest.Desarr.Pesq., B.Aires
Rawson, D.S., 1951 The total mineral content of lake waters. Ecology, 32:669–72
Rawson, D.S., 1955 Morphometry as a dominant factor in the productivity of large lakes. Verh. Int.Ver.Theor.Angew.Limnol., 12:164–75
Ryder, R.A., 1965 A method for estimating the potential fish production of north-temperate lakes. Trans.Am.Fish.Soc., 94:214–8
Ryder, R.A., 1978 Fish yield assessment of large lakes and reservoirs - a prelude to management. En Ecology of freshwater fish production, editado por S.D. Gerking. Oxford, Blackwell Scientific Publications, pp. 403–22
Ryder, R.A., 1981 Recomendaciones para el Gobierno Argentino (INIDEP) para implementar un inventario de los recursos de pesca continental. Mar del Plata, Argentina, Instituto Nacional de Investigación y Desarrollo Pesquero, 29 p. (Traducción)
Ryder, R.A., et al., 1974 The morphoedaphic index, a fish yield estimator - review and evaluation. J.Fish.Res.Board Can., 31(5):663–88
Schlesinger, D.A. and H.A. Regier, 1982 Climatic and morphoedaphic indices of fish yield from natural lakes. Trans.Am.Fish.Soc., 111:141–50
Zimmerman, A.P., et al., 1983 Physicochemical typologies of south-central Ontario lakes. Can. J.Fish.Aquat.Sci., 40(10):1788–803
Tabla I
Lista de ambientes y ciertas características ambientales (ver explicación en el texto)
| A | Z | TDS | TA | LS | Chleq | PT | NOT | ALT | TAMB | |
| (km2) | (m) | (g m-3) | (mM) | (m) | (mg m-3) | (mg m-3) | μM | (m) | (C) | |
| 1- L. Agrio | 9.7 | 50.8 | 479 | 0,00 | 9,0 | 0.61 | 238 | 21 | 1650 | 6.0 |
| 2- L. Pellegrini | 100.7 | 9.4 | 2133 | 1.84 | 2.0 | 14.07 | 23.5 | 45 | 270 | 14.5 |
| 3- E. Mari Menuco | 174.0 | 79.4 | 140 | 1.08 | 8.5 | 0.66 | 3.5 | 6 | 421 | 13.0 |
| 4- E. Los Barreales | 411.0 | 68.3 | 131 | 1.04 | 2.1 | 1.73 | 8.5 | 12 | 422 | 13.0 |
| 5- L. Blanca | 17.0 | 8.4 | 654 | 8.62 | 5.5 | 1.43 | 102 | 115 | 1230 | 10.0 |
| 6- L. Aluminé | 57.0 | 69.4 | 35 | 0.25 | 13.3 | 0.81 | 2.5 | 14 | 1125 | 4.0 |
| 7- E. Ramos Mexia | 816.0 | 24.7 | 64 | 0.58 | 4.0 | 2.16 | 9 | 15 | 381 | 12.0 |
| 8- L. Norquinco | 5.4 | 41.9 | 38 | 0.35 | 7.8 | 0.43 | 4.5 | 17 | 1025 | 3.0 |
| 9- L. Quillen | 23.0 | 59.0 | 30 | 0.26 | 16.5 | 0.29 | 3 | 6 | 975 | 4.0 |
| 10- L. Huechulaufquen | 78.2 | 142.4 | 39 | 0.32 | 7.5 | 0.74 | 13.5 | 14 | 875 | 5.0 |
| 11- L. Lacar | 49.0 | 166.0 | 45 | 0.49 | 14.5 | 0.37 | 3.5 | 21 | 625 | 5.0 |
| 12- L. Nahuel Huapi | 557 | 157.0 | 25 | 0.22 | 12.5 | 0.41 | 3.8 | 15 | 764 | 5.0 |
| 13- L. Ne-Luan | 0.6 | 6.4 | 202 | 3.31 | 0.6 | 23.75 | 68 | 48 | 1000 | 9.6 |
| 14- L. Gutierrez | 16.4 | 79.7 | 45 | 0.49 | 10.5 | 0.39 | 2 | 14 | 750 | 5.0 |
| 15- L. Mascardi | 39.2 | 111.0 | 31 | 0.26 | 9.5 | 0.22 | 3.3 | 9 | 750 | 5.0 |
| 16- L. Guillelmo | 5.4 | 61.3 | 46 | 0.35 | 11.0 | 0.55 | 4 | 14 | 826 | 5.0 |
| 17- L. Steffen | 6.3 | 46.7 | 39 | 0.33 | 13.0 | 0.21 | 3 | 13 | 525 | 6.0 |
| 18- L. Las Chultas | 0.6 | 11.4 | 58 | 0.71 | 9.0 | 0.69 | 9 | 29 | 585 | 7.0 |
| 19- L. Epuyen | 17.4 | 92.4 | 44 | 0.47 | 19.0 | 0.16 | 1 | 9 | 250 | 5.0 |
| 20- L. Puelo | 44.0 | 111.4 | 39 | 0.30 | 7.0 | 0.23 | 2.5 | 9 | 150 | 5.0 |
| 21- L. Lezama | 7.5 | 36.0 | 64 | 0.79 | 16.0 | 0.74 | 4 | 20 | 750 | 5.0 |
| 22- L. Rivadavia | 21.7 | 103.7 | 46 | 0.35 | 11.5 | 0.35 | 2.5 | 17 | 527 | 5.0 |
| 23- L. Esquel | 2.8 | 2.1 | 153 | 1.79 | 2.8 | 4.62 | 68 | 71 | 650 | 8.0 |
| 24- L. Verde | 1.4 | 18.3 | 47 | 0.37 | 11.0 | 0.68 | 4 | 23 | 520 | 5.0 |
| 25- E. Fl. Ameghino | 65 | 24.6 | 172 | 1.79 | 2.3 | 3.67 | 20.7 | 51 | 169 | 11.0 |
| 26- L. Futalaufquen | 44.6 | 101.1 | 36 | 0.28 | 14.0 | 0.50 | 1 | 13 | 518 | 5.0 |
| 27- L. Largo | 2.8 | 19.5 | 55 | 0.61 | 13.5 | 0.49 | 6.7 | 21 | 800 ? | 5.0 |
| 28- L. Kruger | 4.4 | ? | - | 0.28 | 3.8 | - | 5 | 23 | 515 | 5.0 |
| 29- E. Amutui Quimei | 86.7 | 64.7 | 33 | 0.26 | 10.5 | 0.68 | 3 | 22 | 502 | 5.0 |
| 30- L. Cronómetro | 5.8 | (4.4) | 260 | 3.07 | 1.2 | 9.56 | 294 | 120 | 850 ? | 8.0 |
| 31- L. Rosario | 14.5 | 24.9 | 89 | 1.11 | 5.0 | 1.76 | 15.3 | 38 | 650 | 8.0 |
| 32- L. Musters | 414 | 20 | 342 | 3.57 | 1.2 | 4.95 | 34.5 | 62 | 275 | 10.9 |
| 33- L. Colhue Huapi | 810 | 2 | 1110 | 9.42 | 0.8 | 20.2 | 744 | 143 | 265 | 10.9 |
Tabla II
Matriz de correlación entre 12 variables ambientales, y con CPUE total, para N = 31 (ver explicación en el texto)
| TA | TDS | Z | LS | Chleq | PT | NOT | COT | COL | PLH | ALT | TAMB | ||
| TA | 1 | ||||||||||||
| TDS | 0.905 | 1 | |||||||||||
| Z | -0.794 | -0.731 | 1 | ||||||||||
| LS | -0.800 | -0.772 | 0.698 | 1 | |||||||||
| Chleq | 0.828 | 0.839 | -0.801 | -0.928 | 1 | ||||||||
| PT | 0.882 | 0.798 | -0.851 | -0.842 | 0.869 | 1 | |||||||
| NOT | 0.838 | 0.752 | -0.839 | -0.712 | 0.796 | 0.887 | 1 | ||||||
| COT | 0.823 | 0.780 | -0.788 | -0.682 | 0.780 | 0.854 | 0.858 | 1 | |||||
| COL | 0.407 | 0.392 | -0.344 | -0.423 | 0.453 | 0.453 | 0.504 | 0.536 | 1 | ||||
| PLH | 0.628 | 0.665 | -0.426 | -0.544 | 0.545 | 0.461 | 0.355 | 0.373 | 0.145 | 1 | |||
| ALT | -0.157 | -0.282 | 0.014 | 0.259 | -0.172 | -0.012 | -0.029 | 0.009 | 0.101 | -0.461 | 1 | ||
| TAMB | 0.752 | 0.800 | -0.527 | -0.732 | 0.743 | 0.610 | 0.485 | 0.647 | 0.384 | 0.707 | -0.428 | 1 | |
| CPUE | 0.260 | 0.342* | -0.174 | -0.299 | 0.327* | 0.231 | 0.204 | 0.309* | 0.197 | 0.267 | -0.451** | 0.403* | |
| P < 0.05, r ≥ 0.301 | |||||||||||||
| P < 0.01, r ≥ 0.416 | |||||||||||||
Tabla III
Coeficiente de correlación de CPUE total y por “especie” con ciertas variables ambientales, para N = 31 (ver explicación en el texto)
| TA | K20 | Z-1 | LS | Chleq | PT | COT | NOT | MEI | ALT | TAMB | |||
| AIR | -0.249 | -0.298 | -0.233 | 0.031 | -0.127 | -0.133 | -0.126 | -0.154 | -0.289 | 0.090 | -0.119 | ||
| MAR | -0.504** | -0.472** | -0.315* | 0.363* | -0.414* | -0.368* | -0.341* | -0.269 | -0.414* | 0.045 | -0.389* | ||
| BCH | 0.471** | 0.334* | 0.440 | -0.353* | 0.355* | 0.401* | 0.396* | 0.351* | 0.436** | 0.429** | 0.344* | ||
| BGDE | 0.469** | 0,656** | 0.261 | -0.509** | 0.524** | 0.356* | 0.214 | 0.366* | 0.474** | -0.603** | 0.745** | ||
| TAR | -0.383* | -0.360* | -0.275 | 0.360* | -0.401* | -0.347* | -0.259 | -0.394* | -0.352* | 0.065 | -0.359* | ||
| PEJ | 0.301* | 0.468** | 0.137 | -0.267 | 0.391* | 0.159 | 0.116 | 0.275 | 0.301* | -0.354* | 0.526** | ||
| CPUE | 0.260 | 0.343* | 0.197 | -0.299 | 0.327 | 0.231 | 0.204 | 0.309* | 0.284 | -0.451** | 0.403* | ||
| P < 0.05, r ≥ 0.301 | |||||||||||||
| P < 0.01, r ≥ 0.416 | |||||||||||||
Tabla IV
Matriz de correlación entre 12 variables ambientales, y con CPUE total, para N = 25 (ver explicación en el texto)
| TA | TDS | Z | LS | Chleq | PT | NOT | COT | COL | PLH | ALT | TAMB | ||
| TA | 1 | ||||||||||||
| TSD | 0.971 | 1 | |||||||||||
| Z | -0.553 | -0.483 | 1 | ||||||||||
| LS | -0.750 | 0.814 | 0.372 | 1 | |||||||||
| Chleq | 0.793 | 0.811 | -0.556 | -0.847 | 1 | ||||||||
| PT | 0.708 | 0.691 | -0.566 | -0.793 | 0.838 | 1 | |||||||
| NOT | 0.595 | 0.518 | -0.609 | -0.527 | 0.694 | 0.683 | 1 | ||||||
| COT | 0.583 | 0.541 | -0.513 | -0.458 | 0.624 | 0.659 | 0.662 | 1 | |||||
| COL | 0.172 | 0.223 | -0.119 | -0.307 | 0.366 | 0.323 | 0.390 | 0.431 | 1 | ||||
| PLH | 0.692 | 0.731 | -0.388 | -0.605 | 0.601 | 0.483 | 0.216 | 0.207 | 0.031 | 1 | |||
| ALT | -0.458 | -0.502 | 0.101 | 0.492 | -0.314 | -0.157 | -0.190 | -0.031 | 0.054 | -0.495 | 1 | ||
| TAMB | 0.763 | 0.819 | -0.336 | -0.737 | 0.735 | 0.574 | 0.257 | 0.516 | 0.262 | 0.659 | -0.545 | 1 | |
| CPUE | 0.501** | 0.529** | -0.047 | -0.521** | 0.507** | 0.471** | 0.313 | 0.435* | 0.263 | 0.256 | -0.408* | 0.477** | |
| P < 0.05, r ≥ 0.337 | |||||||||||||
| P < 0.01, r ≥ 0.462 | |||||||||||||
Tabla V
Coeficiente de correlación de CPUE total y por “especie” con ciertas variables ambientales, para N = 25 (ver explicación en el texto)
| TA | K20 | Z-1 | LS | Chleq | PT | NOT | COT | MEI | ALT | TAMB | ||
| AIR | -0.132 | -0.048 | -0.328 | -0.293 | 0.161 | 0.177 | 0.086 | 0.049 | -0.237 | -0.020 | 0.049 | |
| MAR | -0.418* | -0.404* | -0.048 | 0.195 | -0.260 | -0.158 | -0.115 | -0.007 | -0.233 | 0.093 | -0.268 | |
| BCH | 0.593** | 0.586** | 0.228 | -0.493** | 0.478** | 0.306 | 0.286 | 0.221 | 0.466** | -0.654** | 0.438* | |
| BGDE | 0.628** | 0.749** | 0.179 | -0.630** | 0.609** | 0.431* | 0.111 | 0.308 | 0.483** | -0.511** | 0.811** | |
| TAR | -0.299 | -0.287 | -0.089 | 0.271 | -0.341* | -0.248 | -0.075 | -0.298 | -0.236 | 0.107 | -0.272 | |
| PEJ | 0.566** | 0.553** | 0.245 | -0.326 | 0.508** | 0.409* | 0.237 | 0.412* | 0.430* | -0.250 | 0.528** | |
| CPUE | 0.501** | 0.535** | 0.052 | -0.521** | 0.507** | 0.471** | 0.313 | 0.435* | 0.304 | -0.408* | 0.477** | |
| P < 0.05, r ≥ 0.337 | ||||||||||||
| P < 0.01, r ≥ 0.462 | ||||||||||||
Tabla VI
Primeros tres autovectores, autovalores y varianza explicada, sobre 31 ambientes, con doce variables ambientales transformadas logarítmicamente y normalizadas
| I | II | |
| λ | 7.9 | 1.625 |
| % | 65.83 | 13.54 |
| TA | 0.336 | - 0.007 |
| TDS | 0.328 | - 0.119 |
| Z | - 0.304 | - 0.172 |
| LS | - 0.317 | 0.067 |
| Chleq | 0.333 | 0.008 |
| PT | 0.330 | 0.170 |
| NOT | 0.311 | 0.238 |
| COT | 0.314 | 0.211 |
| COL | 0.183 | 0.282 |
| PLH | 0.225 | - 0.456 |
| ALT | - 0.073 | 0.661 |
| TAMB | 0.286 | - 0.311 |
Tabla VII
Coeficiente de correlación lineal, correlación entre CPUE total
y por especie con el respectivo primer eje de ordenación ambiental, PCA-1
(ver explicación en el texto)
| N= 31 | N= 28 | N= 26 | N= 25 | |
| CPUE | 0.385* | 0.548** | 0.619** | 0.717** |
| AIR | 0.012 | 0.090 | 0.314 | -0.008 |
| MAR | -0.350* | -0.302 | -0.261 | -0.228 |
| BCH | 0.340* | 0.438** | 0.560** | 0.633** |
| BGDE | 0.525** | 0.698** | 0.489** | 0.572** |
| TAR | -0.363* | -0.321 | -0.298 | -0.272 |
| PEJ | 0.313* | 0.435** | 0.369* | 0.451* |
Tabla VIII
Regresión simple de abundancia total de peces (CPUE) sobre ciertas variables de estado y el MEI (ver explicación en el texto)
| No | N | ECUACION | r2 | P |
| 1 | 28 | log CPUE = 1.215 + 0.549 log Chleq | 0.40 | 0.001 |
| 2 | 28 | log CPUE = 0.787 + 0.473 log PT | 0.35 | 0.001 |
| 3 | 28 | log CPUE = 1.084 + 0.292 log MEI' | 0.31 | 0.01 |
| 4 | 28 | log CPUE = 1.829 - 0.780 log LS | 0.38 | 0.001 |
| 5 | 28 | log CPUE = 0.078 + 0.587 log TDS | 0.33 | 0.01 |
| 6 | 28 | log CPUE = 1.323 + 0.714 log TA | 0.36 | 0.001 |
| 7 | 27 | CPUE = 0.694 + 2.541 PT | 0.89 | 0.001 |
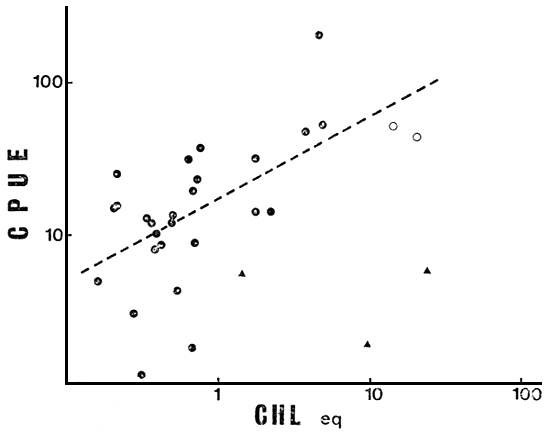
Fig. 1. CPUE total vs Chleq (en mg m-3) en el conjunto total de lagos (N = 31): ( ▲ ) ambientes no considerados en la regresión.
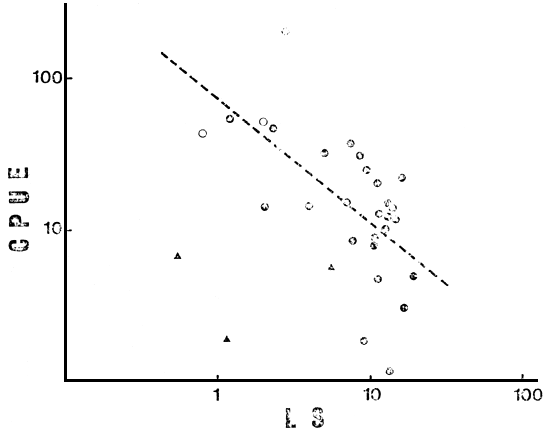
Fig. 2. CPUE total vs LS (en m) en el conjunto total de lagos (N = 31); ( ▲ ) ambientes no considerados en la regresión.
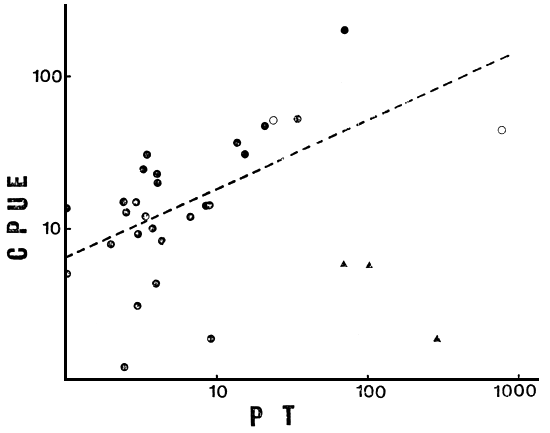
Fig. 3. CPUE total vs PT (en mg m-3) en el conjunto total de lagos (N = 31) ( ▲ ) ambientes no considerados en la regresión.
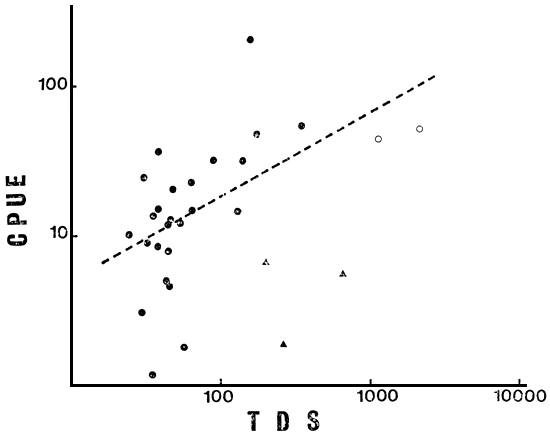
Fig. 4. CPUE total vs TDS (en g m-3) en el conjunto total de lagos (N = 31); ( ▲ ) ambientes no considerados en la regresión.
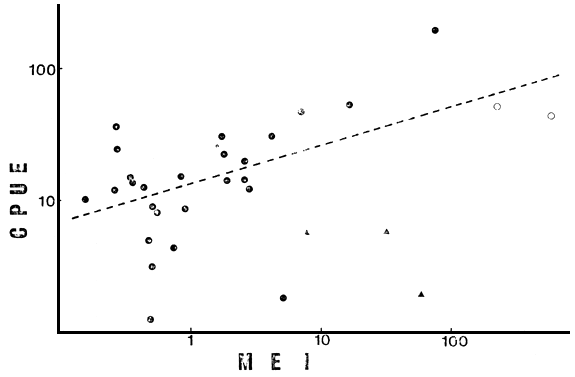
Fig. 5. CPUE vs MEI (TDS/Z) en el conjunto total de lagos (N = 31); ( ▲ ) ambientes no considerados en la regresión.
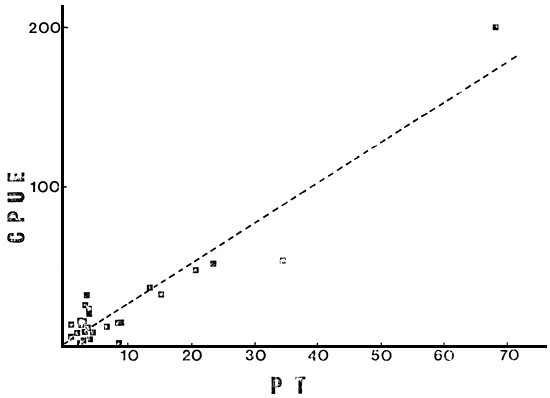
Fig. 6. CPUE total vs PT (en mg m-3) para 27 ambientes.
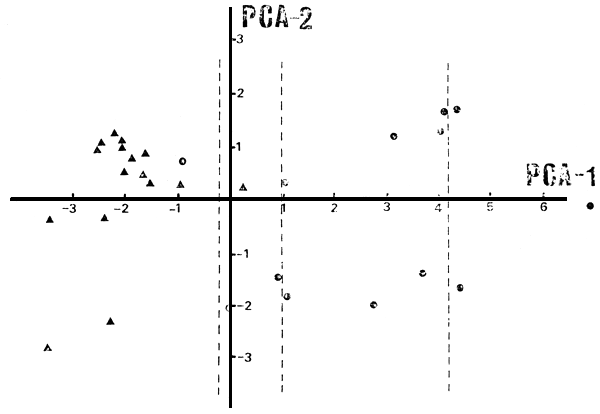
Fig. 7. Posición de los ambientes en el espacio de componentes principales, según sus características ambientales.
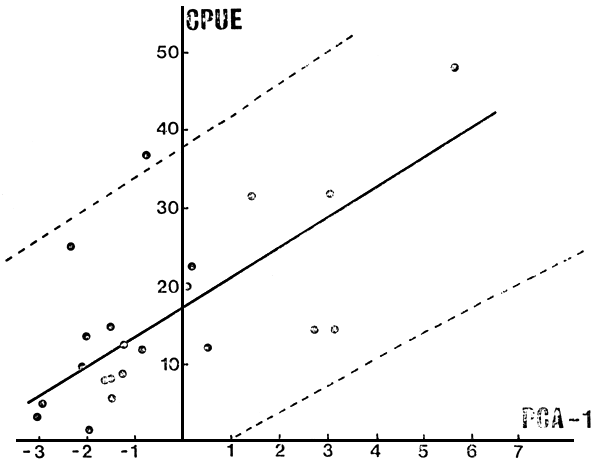
Fig. 8. CPUE total vs PCA-l, para el conjunto más homogéneo considerado (N = 25), (ver explicación en el texto).