R. Delfino y C. Baigún
Instituto Nacional de Investigación y Desarrollo Pesquero
Mar del Plata, Argentina
1.1 RESUMEN
Se analizan los cambios ocurridos en la estructura de las comunidades de peces, sobre la base de la variación de los Cambios de la Captura por Unidad de Esfuerzo (CPUE) en el período 1980–84. Se detectó una disminución de la abundancia de peces en el embalse, a partir de un incrmento trófico en 1981. Las modificaciones en la composición de las especies se analizan a la luz de las características tróficas de varios taxa. Los depredadores pequeños y las especies detritívoras parecieran ser las más significativas, luego del represamiento; sin embargo, las especies omnívoras fueron más importantes en el último año.
ABSTRACT
The changes in the fish community structure are analized, on the basis of the variation in the CPUE in the 1980–84 period. After an early trofic increase (1981), a diminution in the fish abundance in the whole reservoir was detected. The modifications registered in the species composition, are discussed according to the trophic characteristics of several taxa. Small predators and detritivorous species appeared to be more significative after the impoundment, but the omnivorous fish became more important in the last year.
1.2 INTRODUCCION
Uno de los aspectos ecológicos más interesantes de observar en la formación de un embalse, está dado por las variaciones cuantitativas y cualitativas producidas en las distintas comunidades. Específicamente en el caso de los peces, su taxocenosis en las etapas inmediatas al llenado del embalse dependerá de varios factores. Por un lado, es importante la estructura de la comunidad original del río, la cual, debido a las nuevas condiciones ecológicas, es susceptible de ser modificada (Hanson et al. 1977). Por otra parte, ciertas características del nuevo ambiente, como turbidez, vegetación acuática, inundada, velocidad de corriente, etc., determinan la composición de la comunidad. Consecuentemente se produce un proceso de sucesión, en el cual el sistema trata de alcanzar un nuevo estado de equilibrio y que se halla vinculado a factores ambientales que impactan directa o indirectamente sobre la comunidad, condicionando su estructura.
En efecto, el presente trabajo trata los cambios observados en la composición de la ictiofauna luego del llenado del embalse y hasta cinco años después de su formación, integrando y analizando los resultados registrados por Prenski y Baigún (1984) y Chediak et al. 1985), desde un punto de vista ecológico.
1.3 CARACTERISTICAS AMBIENTALES DEL EMBALSE DE SALTO GRANDE
El embalse de Salto Grande se formó en septiembre de 1979, después de un período de llenado de tres meses (Comisión Técnica Mixta, 1980). Consta de un canal central y cinco brazos, los cuales exhiben diferencias limnológicas entre sí y con el cauce principal (Quirós y Cuch, 1982). Los brazos se formaron sobre cauces preexistentes y de escaso caudal (Figura 1).
La morfometría y el régimen hidrológico revelan que se trata de un embalse de escasa profundidad, gran desarrollo costero y alta tasa de lavado (Chediak et al, 1986). Estas características lo ubican como un embalse de canal principal, con escaso tiempo de retención de agua (FAO, 1980), en el cual el nivel hidrométrico se halla sometido a rápidas variaciones, dependiendo de las necesidades energéticas de la represa. Estas variaciones pueden llevar la cota del embalse entre 29 y 36 m en períodos breves (Figura 2).
1.4 MATERIALES Y METODOS
Las capturas de peces se realizaron mediante el uso de redes enmalladoras flotantes, según las características y metodología descritas en Chediak et al., 1985). A base de estudios previos de pesca exploratoria y de las diferencias limnológicas señaladas entre los distintos brazos y el cauce principal, se establecieron seis estaciones de muestreo fijas (Figura 1). La frecuencia de muestreo fue bimensual durante el primer año, y luego trimestral en 1982 y 1984. En 1983, los muestreos de otoño, invierno y primavera fueron interrumpidos, mientras que durante 1981 en la estación D no se practicaron muestreos.
1.5 RESULTADOS
No se dispone a la fecha de estudios pesqueros o ecológicos previos al llenado, que permitan inferir los cambios producidos respecto de la comunidad lótica original. Como referencia puede citarse el inventario realizado por Ringuelet (1975) que registra 124 especies, los trabajos de Cordini (1977) y López et al. (1984) que elevan ligeramente esa cifra. Las especies registradas en este trabajo ascendieron a 60 (Tabla 1).
Producido el llenado del embalse, Quirós (1980) estimó el rendimiento pesquero potencial entre 9 y 30 kg/ha/año, mientras que la aplicación del modelo generalizado de Gulland (1970) ubica el rendimiento máximo sostenible en 29 kg/ha/año para 1981, según los datos de Poddubnyi et al. (1981).
Para el análisis de las variaciones de la composición de especies se han tratado los resultados de cada estación de muestreo separadamente. Los valores de las medias de las capturas por estación revelan una clara, aunque moderada, tendencia a la disminución de las capturas en el tiempo (Figura 3).
Un análisis similar fue realizado considerando los CPUE de las principales especies de interés comercial y de aquéllas que demostraron patrones de variación definidos. Así, algunas especies, como Prochilodus platensis, Acestrorhynchus altus, Oligosarcus hepsetus, Cynopotamus argenteus, Curimata gilberti, Curimata nitens, Curimatorbis platanus, Loricaria sp., Hypostomus sp. y Rhinelepis aspera, evidenciaron una abundancia mayor en las primeras etapas posteriores al llenado, para luego decrecer (Figura 4), mientras que otro grupo, conformado por Luciopimelodus pati, Parapimelodus valenciennesi y Pachyrus bonariensis, con abundancia relativa casi nulas hasta los primeros 17 meses inmediatos a la formación del nuevo ambiente, aumentaron sus capturas de manera notoria (Figura 5).
Por otra parte, otras especies, como Salminus maxillosus, Leporinus obtusidens y Hoplias malabaricus, exhibieron variaciones irregulares, mientras que Raphiodon vulpinus manifestó una llamativa sucesión de cifras de máxima abundancia durante los meses de febrero, ligadas probablemente a un comportamiento migratorio anual (Figura 6).
Una interpretación ecológica de estas variaciones puede ensayarse si se analizan los cambios relativos de las abundancias según sus características tróficas. Para ello, se han delimitado cuatro grandes grupos, basados en las referencias bibliográficas y observaciones personales de los autores (De Vincensi y Teague, 1942; Angelescu y Gneri, 1949; Gneri y Angelescu, 1951; Bonetto et al., 1963; Cabrera et al. 1973; Ringuelet et al., 1967; Vidal, 1967; Menezes, 1969 a y b; Bonetto et al., 1963, 1969, 1981; Oliveros 1978; Mota Soares, 1979; Roa y Guillem, 1979; Cordiviola de Yuan y Pignalberi, 1981; Mendes do Santos, 1981; Bowen, 1983; Escalante, 1983; Angermeier y Karr, 1984; Ferreira, 1984; Haro y Gutiérrez, 1985). Todas ellas son en parte coincidentes con aquellas observaciones resumidas por Welcomme (1975).
I. Detritívoro-iliófago: Constituido por especies que se alimentan del detrito y sus microorganismos asociados, incluyó a P. platensis, C. gilberti, C. nitens, C. platanus, Hypostomus sp., R. aspera, Loricaria sp. y M. multispinnis.
II. Omnívoros: Integraron esta categoría un amplio número de especies que ingieren larvas de insectos, restos vegetales, algas, frutos, huevos y larvas de peces, etc. Comprendió entre otros a: Schizodon platae, Schizodon nasutus, Ageneiosus valenciennesi, Parauchenipterus galeatus, Megalodoras laevigatulus, Oxidoras kneri, Rhynodoras d'orbignyi, Parapimelodus valenciennesi, Pachyrus bonariensis, etc.
III. Depredadores de tamaño pequeño: Comprendió a especies que ingieren activamente larvas de insectos, insectos terrestres, crustáceos y peces Lycengraulis olidus, Holoshestes pequira, Astyanax abramis, A. fasciatus, Acestrorhynchus altus, Oligosarcus hepsetus, Cynopotamus argenteus y Auchenipterus nuchalis fueron incluidos en este grupo.
IV. Ictiófagos: Se trató de especies generalmente de gran tamaño, grandes depredadores, a saber: S. maxillosus, R. vulpinus, Hoplias malabaricus, Serrasalmus spp., Luciopimeladus pati y Pseudoplatystoma coruscans.
Dentro de las especies del primer grupo, sobresalió por su importancia P. platensis. Esta posee una amplia distribución en la cuenca del Plata (Gneri y Angelescu, 1951) y su presencia se verifica fundamentalmente en ambientes leníticos, donde la iliofagia aparece como un detalle característico (Bonetto et al. 1969; Cordiviola de Yuan 1977 y Cordiviola de Yuan y Pignalberi, 1981)
Así, la abundancia de esta especie en Salto Grande, en el primer año de postembalsado, es coincidente con lo observado por Bonetto et al. (1969), que la señalan como la especie de mayor biomasa dentro del sistema de la cuenca del Plata, lo que en definitiva corrobora la gran importancia que poseen los detritívoros en las comunidades de peces neotropicales (Bowen, 1983).
Sin embargo, la abundancia tanto de esta especie como del resto de los detritívoros, distó de ser homogénea en el embalse. Más allá de lo señalado por Welcomme (1975) sobre la importancia de los brazos secundarios como habitats, donde la densidad íctica resulta mayor que en el cauce principal, parece cierto que la distribución y abundancia de esta especie en Salto Grande está gobernada por factores ecológicos determinados.
Quirós et al (1984) y Quirós y Delfino (1985) señalan que la abundancia de los detritívoros en este embalse se halla fuertemente condicionada por los niveles de materia orgánica y nitrógeno orgánico total en los distintos brazos del embalse, relación que sería a la vez extensible a otros ambientes de la cuenca del Plata (Quirós y Baigún, 1985). Estas observaciones coinciden con lo registrado en otros embalses, donde los detritívoros se incrementaron inmediatamente después del llenado (Bazigos, 1972; Lelek y El Zarka, 1973; Petr, 1975; Hanson et al. 1977; Ita, 1984; Kenmuir, 1984; Marshall, 1984).
Las causas de este aumento han sido atribuidas generalmente a la enorme cantidad de alimento que queda disponible en forma de materia orgánica de distinto origen, susceptible de ser degradada (Carpenter, 1980, 1981), para este tipo de especies en particular (Bakare, 1970). Este incremento, más conspicuo en las zonas litorales por efecto de la vegetación inundada (Moss, 1980), constituye en estas primeras etapas de formación del embalse un importante factor regulador de la producción íctica (Mc Lachlan, 1974).
No obstante, los detritívoros tienden a disminuir entre el segundo y tercer año de postembalsado, para alcanzar niveles de abundancia similares en el tercer y quinto año (Figura 7). Ello se verificó con mayor claridad al analizar las distribuciones de tallas de P. platensis, así como sus capturas por tamaños de malla. En el primer caso se observó un fuerte reclutamiento en el mes de enero de 1981, apenas cuatro meses después de completado el llenado, y que finalizó a partir de febrero de 1982 (Figura 8).
El aporte de esta clase anual estaría directamente relacionado con la precedencia inmediata del aumento del nivel por efectos del llenado en el período reproductivo. Poddubny (en Bhukaskwan, 1986) ha señalado que en embalses templados las clases juveniles se ven beneficiadas, si ambos fenómenos se manifiestan simultáneamente; mientras que Shirley y Andrews, (1977) y Miranda et al. (1984) han observado que un aumento del nivel del agua en la estación de desove y crecimiento incrementa la abundancia de las clases juveniles. No obstante, a partir de 1981 se verifica una declinación tanto de individuos juveniles como de ejemplares adultos en las capturas (Figura 9).
Respecto de los predadores de pequeño tamaño, constituye un fenómeno de interés la abundante presencia de A. altus y particularmente de O. hepsetus, durante el primer año de postembalsado. Menezes (1969 b) señala la afinidad de nichos entre ambas especies y Junk et al. (1981) y Vieira (1982) identifican a Acestrorhynchus falcirostris y a A. microlepis como las especies dominantes tras el primer año de llenado de la represa de Currua Una.
Por su parte, O. jenynsi, especie afín a O. hepsetus (Menezes, 1969 a) ha evidenciado un comportamiento similar al de Salto Grande en la pequeña represa de Saltito I donde, al cabo del llenado, su abundancia se incrementó notablemente (Roa com. pers.). Análogamente, puede analizarse la presencia de A. abramis, A. fasciatus y H. pequira. Estas especies han sido bien estudiadas por Oliveros (1980), que las describe como de régimen omnívoro y oportunista, ya que toman alimento del bafón, pleustón, plancton e ictioplancton.
En Salto Grande, sus abundancias se hallaron subestimadas debido a la selectividad del arte utilizado, pero Quirós y Luchini (com. pers.) señalan que al finalizar el llenado y a partir de septiembre de 1979, se produjo una proliferación extraordinaria de larvas de estas especies. Ello concordó perfectamente con el esperado y súbito aumento de nutrientes que suele producirse en estos casos (Ryder, 1978), con el consiguiente incremento de las comunidades intermedias (Poddubnyi, 1976; Baxter y Glaude, 1980; Eminson y Moss, 1980).
En términos generales, la abundancia de todas las especies de este grupo corresponde al patrón de comportamiento observado en otros ambientes según, el cual tras el llenado existe una manifiesta predominancia de especies carnívoras de pequeño tamaño (Lelek y El Zarka, 1973; Sidthimunka y Potaros, 1968; Junk et al., 1981). Posteriormente se apreció una declinación, que fue más acentuada en las estaciones A, B y E, alcanzándose similares niveles de todas ellas en 1984 (Figura 7).
El grupo IV, conformado por los grandes depredadores, mostró también un perfil decreciente e irregular (Figura 7). Por ejemplo, S. maxillosus evidenció un reclutamiento constante de individuos de talla media (Figura 10), lo que estaría indicando que la reproducción de esta especie ocurre en áreas alejadas del embalse (Delfino y Baigún 1985). Esta declinación en las existencias alcanzó todo el espectro de tallas (Figura 11). Por su parte L. pati manifestó un sostenido aumento de juveniles, así como de ejemplares adultos (Figura 12).
Finalmente, las especies del grupo II evidenciaron una tendencia creciente, si bien en la estación C, el comportamiento fue algo más irregular (Figura 7).
1.6 CONCLUSIONES
Como consecuencia del proceso de embalsamiento se debe diferenciar la composición de la ictiofauna en dos etapas. Una, dada por un período de hasta 24 meses inmediato al llenado, en la cual predominaron unas pocas especies y otra posterior, cuya comunidad resultó más diversa, con una tendencia a la estabilización de la abundancia de peces a partir de 1982. Este fenómeno de sucesión, resulta por cierto característico de los procesos de embalsamiento de ríos y ha sido bien documentado por otros autores (Walburg, 1966; Gasaway, 1970; Hanson et al. 1977; Mahon y Ferguson, 1981).
Ecológicamente ello puede ser explicado admitiendo que las variaciones y modificaciones ocasionadas por el embalsamiento genera nichos anteriormente inexistentes (Moss, 1980) en ambientes con resistencia ambiental reducida. Los factores de mayor importancia serían el abrupto aporte de alimento bajo diversas formas y el aumento del habitat disponible (Weatherley, 1972; Haman, 1980; Shelton y Davies, 1980). Ello conjuga además, a todas aquellas especies reófilas que invaden el nuevo ambiente, atraídas por mejores áreas de reproducción y alimentación (Petr, 1975).
En este contexto, son las especies oportunistas (estrategas r), las más aptas para colonizar el nuevo ambiente, papel que en Salto Grande estaría reservado a las especies del grupo II. Estas especies, fundamentalmente el taxon de las denominadas “mojarras”, cumplirían un papel preponderante dentro del esquema energético de la comunidad de peces, ya que actuarían como nexo entre las restantes comunidades, incrementadas por el efecto de embalsado y los niveles tróficos superiores de otros peces.
Se observa además, que el máximo de abundancia registrado con posterioridad al llenado fue breve (16 meses), lo que puede relacionarse con la alta tasa de lavado que exhibe el embalse. La estabilización posterior en la comunidad de peces se traduce en un predominio gradual de especies omnívoras, lo cual es concordante con lo observado en otros ríos de la cuenca, donde los hábitos alimenticios de los peces son poco especializados (Welcomme, 1975).
A pesar de que usualmente en la formación de un embalse se produce una declinación de las especies del río preexistentes, debido a condiciones ambientales desfavorables (Bhukaskwan, 1980), la comunidad de peces de Salto Grande no puede diferir sustancialmente de la del río original, dado sus características cuasi lóticas ya apuntadas. Por otra parte, la alta capacidad de variación del nivel del embalse, sujeta a un régimen hidrológico irregular y muy dependiente de la cuenca superior, puede resultar un factor negativo para el buen desarrollo de las poblaciones de peces. Un descenso muy brusco tendría consecuencias negativas sobre la supervivencia de huevos, larvas y juveniles, si estos buscan refugios en la vegetación inundada (Bowmaker, 1975; Ploskey, 1985). Nelson y Wallburg (1977) y Martin et al. (1981) han señalado, por el contrario, cuán importante resulta el efecto del aumento del nivel en los período inmediatos subsiguientes al desove para las clases anuales; mientras que Prenski y Baigún (1984) han mostrado la directa influencia del nivel sobre las capturas en Salto Grande. Esta elevada velocidad de variación no permite, por otro lado, generar incrementos extras de magnitud en la producción. La importancia de este efecto para el manejo de la pesquería ha sido bien señalada por Bernacskek (1984) en los embalses africanos.
Finalmente, el conocimiento de los cambios que se producen en las distintas poblaciones de una comunidad de peces resulta fundamental para poder llevar a cabo un manejo de la pesquería. La similitud faunística de Salto Grande respecto a otros embalses a construirse sobre el río Uruguay, aguas arriba, o bien sobre el río Paraná (Fores, 1973), pone de manifiesto, por lo tanto, la importancia de realizar este tipo de trabajos dado que evidentemente el impacto ecológico de estas obras sobre la comunidad de peces no puede ser minimizado.
1.7 REFERENCIAS BIBLIOGRAFICAS
ANGELESCU, V. y GNERI, F. 1949. Adaptaciones del aparato digestivo al régimen alimenticio en algunos peces del río Uruguay y del río de La Plata; I. Tipo omnívoro e iliófago en representantes de las familias “Loricaridae” y “Anostomatidae”. EN: Revista Ciencias Zoológicas. I(6):162–214.
ANGERMAIER, P.L. y KARR, J.R. 1984. Fish communities along environmental gradientes in a system of tropical streams. IN: Editor Zaret, T.M. Evolutionary ecology of neotropical freshwater fishes. The Hague. pp. 39–57.
BAKARE, O. 1970. Bottom deposits as food for inland freshwater fish. IN: Editor Visser S.SA. Kainji, a Nigerian man made-lake. Ibadan, Nigeria. pp. 65–68.
BAXTER, R.M. y GLAUDE P. 1980. Environmental effects of dams and impoundments in Canada; experience and prospects. IN: Cananda Bull. Fish. and Aquatic Sciences. No 205. 34 p.
BAZIGOS, G.P. 1972. The yield pattern at Kainji lake (Nigeria). IN: FAO Statistical Studies, UNDP/SP/NIR. № 24. 24 p.
BERNACSCEK, G.M. 1984. Guidelines for dam design and operation to optimize fish production in impounded river basins (based on a review of the ecological effects of large dams in Africa). IN: CIFA Tech. Pap. (11): 98 p.
BHUKASKWAN, T. 1980. Management of Asian reservoir fisheries. IN: FAO Fish. Tech. Pap. (207): 69 p.
BONETTO, A.A., PIGNALBERI, O. y CORDIVIOIS DE YUAN, E. 1963. Ecología alimentaria del “amarillo” y “mocholo”, Pimelodius Clariass (Bloch), Pimelodius albicaus (Valenciennes) (Pisces Pimelodidae). Physis. 24(67):87–94.
BONETTO, A.A., CORDIVIOLA DE YUAN, E., PIGNALBERI, C. y OLIVEROS, O. 1969. Ciclos hidrológicos del río Paraná y las poblaciones de peces contenidas en cuencas temporarias de su valle de inundación. Physis. 29:213–224.
BOWEN, S.H. 1983. Detritivory in neotropical fish comunities. IN: Env. Biol. Fishes. 9(2):137–144.
BOWMAKER, A. 1975. Fisheries productivity of lake Kariba. Tobacco Forum of Rhodesia. 2:17–25.
CABRERA, S.E., DE LOURDES BAIZ, M., CANDIA, C.R. y CHRISTIANSEN, H.E. 1973 Algunos aspectos biológicos de las especies de la ictiofauna de la zona de Punta Lara (Río de la Plata). 2da. parte. Alimentación natural del bagre porteño (Parapimelodus valenciennesi). Serv. Hidrogr. Naval. H. 1029:7–47.
CARPENTER, S. 1980. Enrichment of lake Wingra, Winsconsin, by submersed macrophyte decay. IN: Ecology. 61(5):1145–1155.
CARPENTER, S. 1981. Submersed vegetation; an internal factor in lake ecosystem sucession. IN: Am. Nat. 118:372–383.
CHEDIAK, G. et al. 1985. Metodología de muestreo y estimación de abundancia relativa de peces en el embalse de Salto Grande. EN: Editoras Vila, I. y Fagetti, E. Taller Int. sobre ecología y manejo de peces en lagos y embalses. FAO COPESCAL. Doc. Tec. (4):33–52.
COMISION TECNICA MIXTA DE SALTO GRANDE. 1980. Implicaciones ambientales del proyecto de desarrollo hidraúlico de Salto Grande para propósitos múltiples. Proyecto PNUMA FP/1000-78-02 (1326). Informe No 5. 447 p.
CORDINI, J.M. 1977. Temas relativos a la ictiofauna. EN: Sem. Medio Amb. y Represas. Montevideo, Uruguay, Univ. República, Fac. Hum. y Cien. 1:264–280.
CORDIVIOLA DE YUAN, E. 1977. Poblaciones de peces del río Paraná. IV. Fluctuaciones de la composición íctica de la laguna “Los Matadores” (Isla Clucellas), Santa Fe. EN: Neotropica. 23:17–26.
CORDIVIOLA DE YUAN, E. y PIGNALBERI, C. 1981. Fish populations in the Parana river. 2. Santa Fe and Corrientes area. IN: Hydrobiología. 77:261–272.
DE VICENZI, G.D. y TEAGUE, G.W. 1942. Ictiofauna del río Uruguay medio. Montevideo, Uruguay, Mus. Hist. Nat. 2da serie. 5(4):1–100.
DELFINO, R. y BAIGUN, C. 1985. Marcaciones de peces en el embalse de Salto Grande, río Uruguay (Argentina-Uruguay). EN: Rev. Asoc. Cs. Nat. Litoral. 16(1):85–93.
EMINSON, D. y MOSS, B. 1980. The composition and ecology of periphyton communities in freshwaters. 1. The influence of host type and external environment on community composition. IN: Br. Phycol. J. (15):429–446.
ESCALANTE, A.H. 1983. Contribución al conocimiento de las relaciones tróficas de peces de agua dulce del área platense. II. Otros Tetragnopteridea. Limnobios. 2(6):379–402.
FAO. 1980. Comparative studies on freshwater fisheries; Report of a workshop held at the Instituto Italianao di Idrobiologia. Pallanza, Italy, 4–8 September 1978. FAO Fish. Tech. Pap. (198): 46 p.
FERREIRA, E.J.G. 1984. A ictiofauna da represa Hidroeléctrica de Curruá-Una, Santarém, Pará. II. Alimentacao e hábitos alimentares das principais espécies. EN: Amazoniana. 9(1):1–16.
FORES, F. 1973. Energía hidroeléctrica en la cuenca del Plata. Com. Nac. de la Cuenca del Plata, Minist. Obras y Serv. Publ. Publicación No 9.
GASAWAY C.R. 1970. Changes in the fish population in lake Francis case in South Dakota in the first 16 years of impoundment. U.S. Bur. Sport Fish. Wildl. Tech. Paper 56. 30 p.
GNERI, F.S. y ANGELESCU, V. 1951. La nutrición de los peces iliófagos en relación con el metabolismo general del ambiente acuático. EN: Rev. Invest. Cs. Nat., Mus. Cs. Nat. "B. Rivadavia: Ciencias Zoológicas II (1) 44 p.
GULLAND, J.A. 1970. The fish resources of the oceans. EN: FAO Fish. Tech. Pap. 97. 425 p.
HAMMAN, K.C. 1980. Post-impoundment trends in the fish populations of the Dam, South Africa. J. Limnol. Soc. Sth. Afr. 6(2):101–108.
HANSON, S.H., MAN, H. and HODKISS, I.J. 1977. Studies on the icthyo-fauna in Plove Cove reservoir, Hong Kong. I. Sequence of fish population changes. IN: J. Fish. Biol. (10):493–503.
HARO, G.H. y GUTIERREZ, M. 1985 Alimentación de Oligosarcus jenynsi (Gunther) (Pisces, Characidae) en el lago San Roque (Córdoba, Argentina). EN: Rev. Asoc. Cs. Nat. Litoral. 16(2):227–235.
ITA, E.O. 1984. Hainji (Nigeria). EN: Editors Kapetsky, J.M. y Petr, T. Status of Arican reservoir fisheries. CIFA Tech. Pap. 10:43-1-3. pp. 43–103.
JUNK, W.J., ROBERTSON, B., DARWICH, A.J. y VIEIRA, I. 1981. Investigacoes limnologicas e ictiologicas em Currua-Una, a primeira represa hidroelectrica na Amazonia Central. EN: Acta Amazonica. 11(4):689–716.
KENNUIR, D.H. 1984. Fish population changes in the Sanyati basin lake Kariba, Zimbabwe. IN: S. Afr. J. Zool. 19(3):194–209.
LELEK, A. y EL-ZARKAS, S. 1973. Ecological comparison of the preimpoundment fish faunas of river Niger and Kainji lake, Nigeria. IN: Editors Ackermann, W.C., White, G.F. and Wortington, E.B. Man made lakes; their problems and environmental effects. Geophysical Monograph. Series. 17:655–660.
LOPEZ, H.L., CASCIOTTA, J., MIQUELARENA, A.M y MENNI, R. 1984. Nuevas localidades para peces de agua dulce de la Argentina. IV. Adiciones a la ictiofauna del río Uruguay y algunos afluentes. EN: Studies in Neotropical Fauna and Env. 19(2):73–87.
LOPEZ, H.L., MENNI, R. y MIQUELARENA, A.M. 1987. Lista de peces de agua dulce de la Argentina. EN: Biología Acuática. No 12. 50 p.
MC LACHLAN, A.J. 1974. Development of some lake ecosystems in tropical Africa with special reference to the invertebrates. Biol. Rev. Cam. Philos. Soc. (49):365–397.
MAHON, R. y FERGUSON, M. 1981. Invasion of a new reservoir by fishes: species composition, growth and condition. Canadian Field Naturalist. 95(3):272–275.
MARSHALL, B.E. 1984. Kariba (Zimbabwe, Zambia). IN: Editors Kapetsky, J.M y T. Petr. Status of African reservoir fisheries. CIFA Tech. Pap. 10:105–154.
MARTIN, D.B., MENGUEL, L.J., NOVOTNY, J.F. y WALBURG, Ch. 1981. Spring and summer water levels in a Missouri river reservoir; effects on age 0 fish and zooplancton. Trans. Am. Fish. Soc. 110:370–381.
MENDES DOS SANTOS, G. 1981. Estudos de alimentacao e habitos alimentarios de Schizodon fasciatus Agassiz, 1829; Rhytiodus microlepis Kner, 1859 e Rhytiodus argenteofuscus Kner 1859, do lago Janauaca, A.M. (Osteichtyes, Characoidei, Anostomidae). EN: Acta Amazonica. 11(2):267–283.
MENEZES, N. 1969a. Systematics and evolution of the tribe Acestrorhynchini (Pisces, Characidae). Arq. Zool. S. Paulo. 18(1–2):1–150.
MENEZES, N. 1969b. The food of Brycon and the three closely related genera of the tribe Acestrorhynchini. EN: Papeis Avulsos de Zoología. 22(20):217–223.
MIRANDA, E.L., SHELTON, W.L. y BRYCE, T.D. 1984. Effects of water level manipulation on abundance, mortality and growth of young of the year largemouth Bass in West Point reservoir, Alabama-Georgia. IN: North Am. Journal of Fish. Manag. 4:314–320.
MOSS, B. 1980. Ecology of freshwaters. Oxford, England, Blackwell Sc. Publ. 332 p.
MOTA SOARES, M.G. 1979. Aspectos ecológicos (alimentaçao e reproduçao) dos peixes do igarape do Porto, Aripuana, MT. EN: Acta Amazonica 9(2):325–352.
NELSON, W.R. y WALBURG, Ch. 1977. Population dynamics of yellow perch (Perca flavescens), sauger (Stizostedion canadense) and walleye (Sizostedion vitreum vitreum) in four main stream Missouri river reservoirs. IN: Journal Fish. Research Board of Canada. 34:1748–1763.
OLIVEROS, O.B. 1980. Campaña limnológica “Keratella I” en el río Paraná; aspectos tróficos de los peces en ambientes lénticos. EN: Ecología, 4:115–126.
PETR, T. 1975. On some factors associated with the initial high fish catches in new African man made lakes. IN: Arch. Hydrobiol. 75(1):32–49.
PLOSKEY, G. 1985. Impacts of terrestrial vegetation and preimpoundment clearing on reservoir ecology and fisheries in the United States and Canada. IN: FAO Fish. Tech. Pap. (258):15.
PODDUBNY, A.G. 1976. Ecological topography of fish populations in reservoirs. U.S.A., Bureau for Sport Fisheries and Wildlife. 352 p.
PODDUBNY, A.G. et al. 1981. Evaluación acústica de la abundancia de peces en el embalse de Salto Grande. Dep. Ecología Salud y Des. Amb., Agua y Energía. 10 p. Mimeografiado.
PRENSKI, B. y BAIGUN, C. 1984. Resultados de la prospección pesquera en el embalse de Salto Grande (febrero 1980–febrero 1982). Mar del Plata, Argentina, INIDEP. 48 p. (Serie Contribuciones No 440).
QUIROS, R. 1980. Evaluación del rendimiento pesquero potencial del embalse de Salto Grande. Mar del Plata, Argentina, INIDEP. 18 p. (Serie Contribuciones No 395).
QUIROS, R. y CUCH, S. 1982. Características limnológicas del embalse de Salto Grande. I. Cambios estacionales de ciertos parámetros físico-químicos. EN: Ecología. 7:195–224.
QUIROS, R., PRENSKI, B. y BAIGUN, C. 1984. Relación entre ensayos de captura y factores ambientales en el embalse de Salto Grande (Argentina-Uruguay). Mar del Plata, Argentina, INIDEP. 23 p. (Serie Contribuciones No 425).
QUIROS, R. y BAIGUN, C. 1985. Fish abundance related to organic matter in the Plata river basin, South America. Trans. Amer. Fish. Soc. 114:377–387.
QUIROS, R. y DELFINO, R. 1985. Estimación empírica de la abundancia de peces en subambientes del embalse de Salto Grande (31 S, 5 W), río Uruguay. EN: Rev. Asoc. Cs. Nat. Litoral. 16(2):210– 216.
RINGUELET, R.A. 1975. Zoogeografía y ecología de los peces continentales de la Argentina y consideraciones sobre las áreas ictiológicas de América del Sur. Ecosur. 2(3):1–22.
RINGUELET, R.A., ARAMBURU, R. y ALONSO DE ARAMBURU, A. 1967. Los peces argentinos de agua dulce. Cons. Invest. Cient. Pcia.de Bs. As. 602 p.
ROA, B.H. y GUILLEM, R.C. 1979. Algunos aspectos de la biología del dientudo (Oligosarcus jenynsi) de la represa Saltito I, Provincia de Misones. Programa de Investigación Pesquera Regional. UNAM-SECYT. 14 p.
ROLDAN, D. y CANON VERON, M. 1981. Algunos aspectos del Iberá (Corrientes, Argentina). EN: Ecosur. 8(15):79–89.
RYDER, R.A. 1978. Fish yield assesment in large lakes and reservoirs; a prelude to management. IN: Editor S.D. Gerking. Ecology of freshwater fish production. London, England. pp. 403–423.
SHELDON, W.L. y W.D. DAVIES. 1980. West Point reservoir, a recreational demonstration proyect. IN: Symposium on Surface Water Impoundment. ASCE, June 2–5, 1980. Minneapolis, Minnesota, U.S.A. Paper No 7–22:1419–1431.
SHIRLEY, K.E. and ANDREWS, A.K. 1977. Growth, reproduction and mortality of largemouth bass during the first year of life in Lake Carl Blockwell, Oklahoma. Trans. Am. Fish. Soc. 106:590–595.
SIDTHIMUNKA, A. and FOTAROS, M. 1968. Observation on the hydrology and fisheries of Ubolratana reservoir (1965–1966). Indo Pac. Fish. Counc. Publ. C 68/Tech.:1–18.
VIDAL, J.C. 1967. Peces de interés comercial del rio Paraná medio e inferior. Secretaría de Estado de Agr. y Gan., Dpto Invest. Pesq. 26 p.
VIEIRA, I. 1982. Aspectos sinecológicos da ictiofauna de Curruá-Una, represa hidroeléctrica da Amazonia Brasileira. Univ. Fed. Juiz de Fora, Brasil. 107 p. Tese de Livre Docencia.
WALBURG, Ch. 1966. Fish populations studies, Lewis and Clark lake, Missouri river, 1956 to 1962. U.S. Fish Wildl. Serv., U.S.A. IN: Spec. Sci. Report Fish. No 482. 27 p.
WEATHERLY, A.H. 1972. Growth and ecology of fish population. Academic Press, London. 293 p.
WELCOME, R.L. 1975. Fisheries ecology of floodplain rivers. Longman Inc., New York. 317 p.
| Nombre vμ pgar | Familia y especia | ||
| Fam. POTAMOTRYGONIDAE | |||
| Raya | Potamotrygon bruml | ||
| Fam. ENGRAULIDAE | |||
| 1- | Anchoa | Lycengraulls olidus | |
| Fam. CLUPEIDAE | |||
| Mandufia | Ramnogaster melanostoma | ||
| Fam. CYPRINIDAE | |||
| Carpa | Cyprinus carpio | ||
| Fam. CHARACIDAE | |||
| 2- | Dorado | Salminus maxillosus | |
| 3a- | Mojarra | Holoshestes pequira | |
| b- | " | Astyanax (p.) abramis | |
| c- | " | A. (a.) f. fasciatus | |
| d- | " | Chelrodontinae spp | |
| 4- | Dientudo paraguayo | Aoestrorhynchus altus | |
| 5- | Dientudo | Oligosarous hepsetus | |
| 6- | Dientudo | Cynopotamus argenteus | |
| 7- | Dientudo transparente | Aslphonichthys stenopterus | |
| 8- | Chafalote | Raphiodon vulpinus | |
| Pirapita | Brycon orbygnianus | ||
| Fam. CHARACIDIIDAE | |||
| Tritolo | Characidium fasciatum | ||
| Fam. HEMIODIDAE | |||
| Apareiodon affinis | |||
| Fam. CURIMATIDAE | |||
| 9- | Sabalo | Prochilodus platensis | |
| 10- | Sabalito | Curimata gilberti | |
| 11- | Sabalito | Curimata nitens | |
| 12- | Sabalito | Curimatorbis platanus | |
| Sabalito | Curimatinae sp | ||
| Fam. ANOSTOMIDAE | |||
| 13- | Boga | Leporinus obtusidens | |
| 14- | Boga lisa | Schizodon platae | |
| 15- | Boga | Schizodon nasutus | |
| Trompa roja | Leporinus striatus | ||
| Fam. ERYTHRINIDAE | |||
| 16- | Tararira | Hoplias malabaricus | |
| Fam. SERRASALMIDAE | |||
| 17a- | Pirana | Serrasalmus spilopleura | |
| 17b- | " | Serrasalmus nattereri | |
| Fam. AGENEIOSIDAE | |||
| 18- | Manduvi | Agenelosus valenciennesl | |
| Fam. AUCHENIPTERIDAE | |||
| 19- | Buzo | Auchenipterus nucahalis | |
| 20- | Torito | Parauchenipterus galeatus | |
| Fam. DORADIDAE | |||
| 21- | Armado | Megalodoras laevigatulus | |
| 22- | Armado chancho | Oxydoras Kneri | |
| Marieta | Rhinodoras d'orbignyl | ||
| Fam. PIMELODIDAE | |||
| 23- | Bagre amarillo | Pimelodus clarias | |
| 24- | Patl | Lucioplmelodus pati | |
| Surubl | Pseudoplatystoma coruscans | ||
| 25- | Bagre porieno | Parapimelodus valenciennesi | |
| manguruyú | Pseudopimelodus zungaro zungaro | ||
| 26- | Cucharon | Sorubim lima | |
| 27- | Bagre trompudo | Iheringichthys westermanni | |
| 28- | Bagre sapo o negro | Rhamdia sapo | |
| Bagre cantor | Pimelodella gracilis | ||
| Bagre cabezon | Steindachneridion inscripta | ||
| Fam. CALLICHTYDAE | |||
| Tachuela | Corydoras paleatus | ||
| Cascarudo | Hopiosternum littorale | ||
| Fam. LORICARIIDAE | |||
| 29a- | Vieja de agua | Hypostomus spp | |
| b- | " | Rhinelepis aspera | |
| c- | " | Loricaria anus | |
| d- | " | Loricaria sp | |
| e- | " | Meqalancistrus multispinnis | |
| Fam. SCIAENIDAE | |||
| 30- | Corvina | Pachyrus bonariensis | |
| Fam. CICHLIDAE | |||
| Chanchita | Gymnogeophagus spp | ||
| Clchlidae spp | |||
| Cabeza amarga | Crenicichla sp | ||
| Fam. ACHIRIDAE | |||
| Lenguade | Achirus Jenypsi | ||
| Fam. GYMNOTIDAE | |||
| 31- | Banderlta | Eigenmannia viresoens | |
| Murena pintada | Gymnotus carapo | ||
| Fam. ATHERINIDAE | |||
| Pejerrey | Odontesthes perugial | ||
| Fam SYNBRANCHIDAE | |||
| Angulla criolla | Synbranchus marmoratus | ||
TABLA 1. ESPECIES CAPTURADAS HASTA 1985 EN EL EMBALSE DE SALTO GRANDE (SEGUN LA CLASIFICACION DE LOPEZ ET AL. 1987)
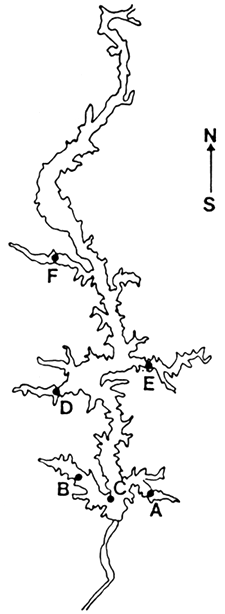 |  |
FIGURA 1. EMBALSE DE SALTO GRANDE
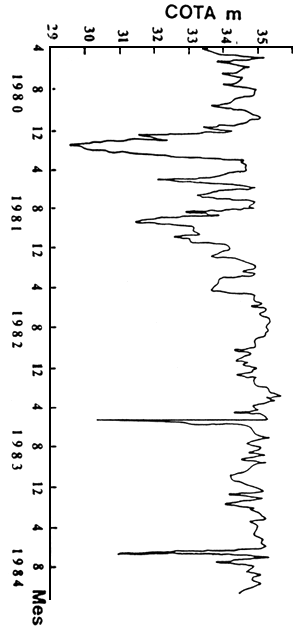
FIGURA 2. COTA DEL EMBALSE ENTRE ABRIL DE 1980 Y ENERO DE 1985
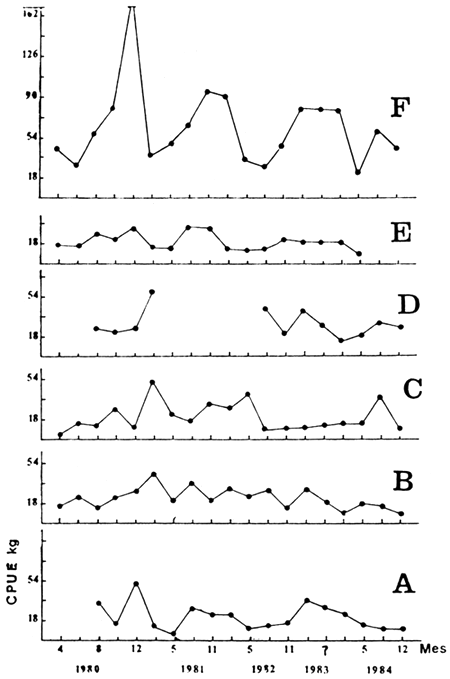
FIGURA 3. VARIACION DE LA CPUE (KG) TOTAL POR ESTACION ENTRE 1980 Y 1984
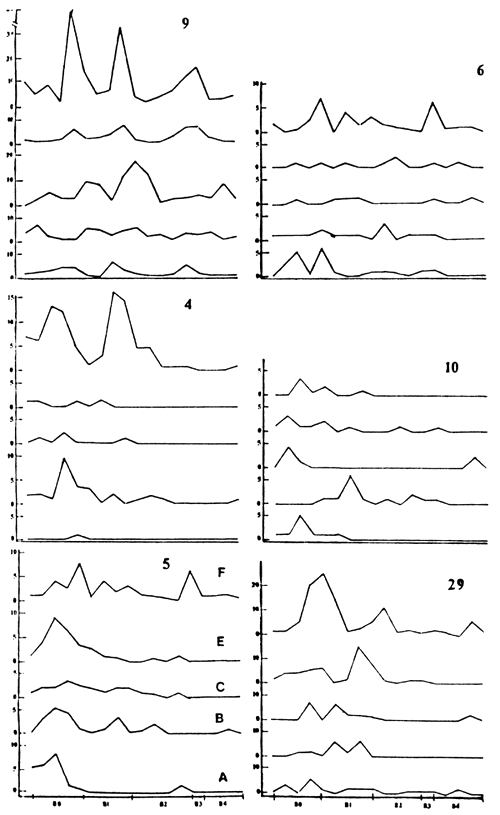
Figura 4. Variación de la CPUE para (4) A. altus (5) O. hepsetus, (6) C. argentus, (9) P. platensis. A-F:Estaciones de muestreo
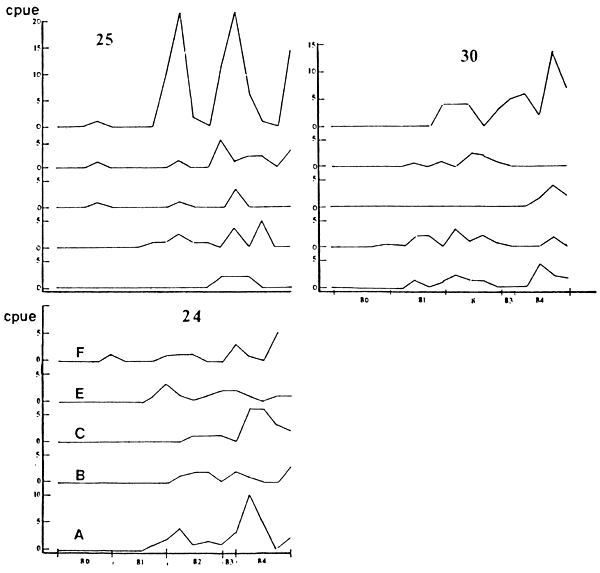
FIGURA 5: Variación de la CPU (Kg) para (24) L. Pati, (25) P. valenciennesi y (30) P. bonariensis. A-F: estaciones de muestreo
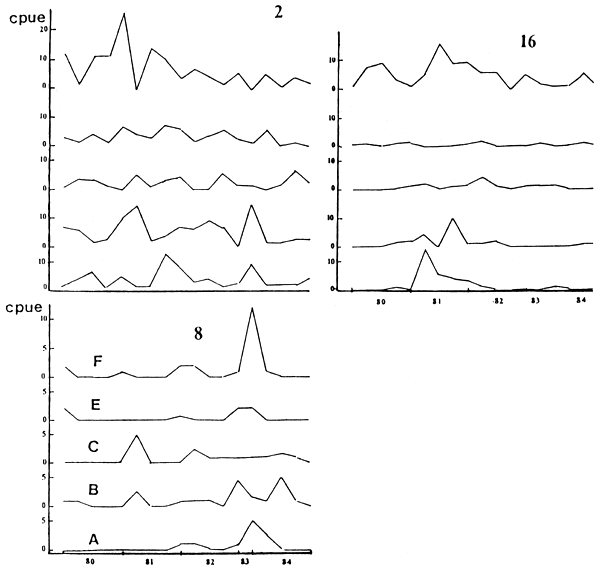
FIGURA 6: VARIACION DE CPUE (KG) PARA (2) S. MAXILLOSUS, (8) R. VULIPNUS Y (16) H. MALABARICUS. A-F: ESTACIONES DE MUESTREO
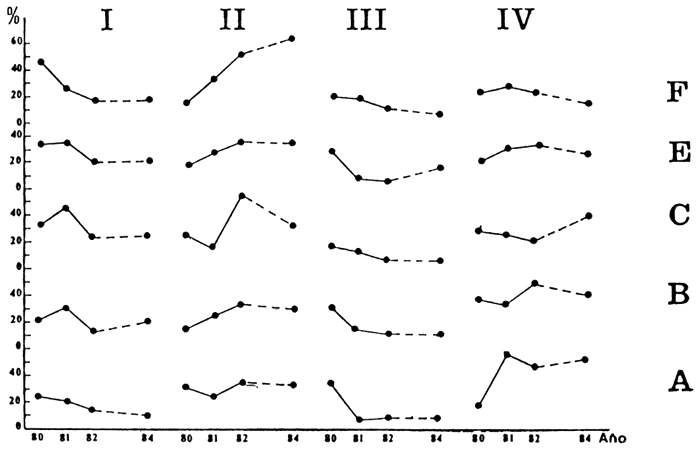
FIGURA 7: Variación (%) de los distintos grupos tróficos: (I) detritívoro-iliófaqo, (II) Omnívoros, (III) Predatores de pequeño porte, (IV) Ictiófaqos. A-F: estaciones de muestreo
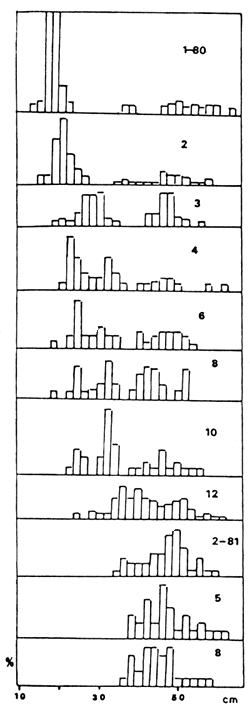 | 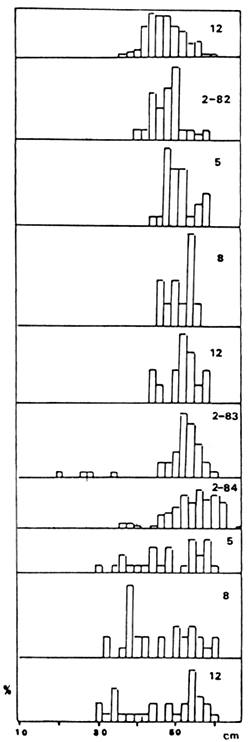 |
FIGURA 8. ESTRUCTURA DE TALLAS DE P. PLATENSIS, PERIODO 1980–1984
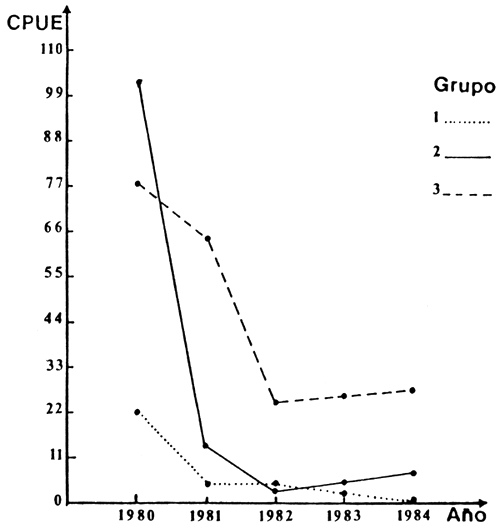
Fig. 9. Variación de la CPU (Kg) de P. platensis por grupo de redes: (1) mallas de 20, 25 y 30 mm; (2) mallas de 35, 40 y 52 mm; (3) mallas de 60, 70 y 85 mm
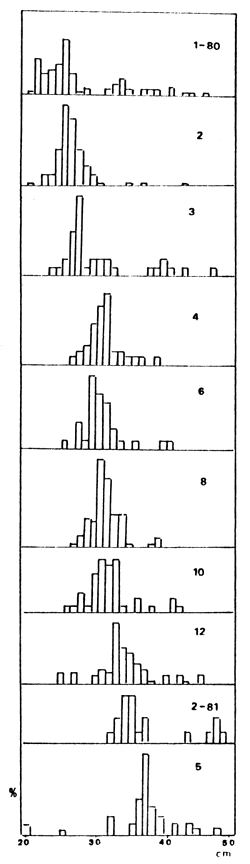 | 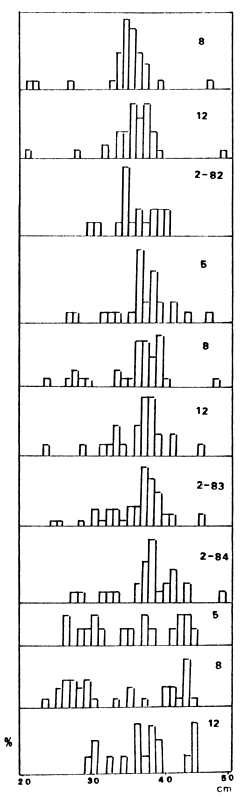 |
FIGURA 10. ESTRUCTURA DE TALLAS DE S. MAXILLOSUS, PERIODO 1980–1984.
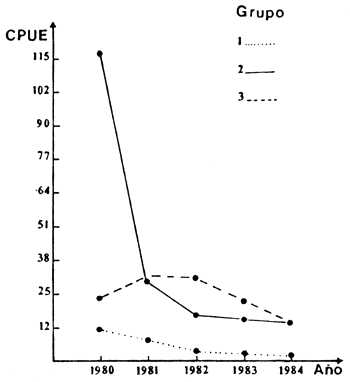
Fig. 11. Variación de CPUE (kg) de S. Maxillosus por grupo de redes: (1) mallas de 20, 25 y 30 mm; (2, mallas de 35, 40 y 52 mm; (3) mallas de 60, 70 y 80 mm.
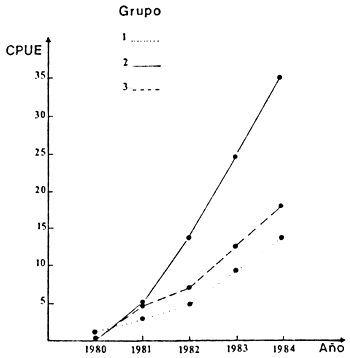
Fig. 12. Variación de la CPUE 9kg) de L. pati por grupo de de redes: (1) mallas de 20, 25, y 30 mm; (2) mallas de 35, 40 y 52 mm; (3) mallas de 60, 70 y 85 mm