| 23 |
| Protozoaires divers, à l'exception d'Ichthyophthirius | |
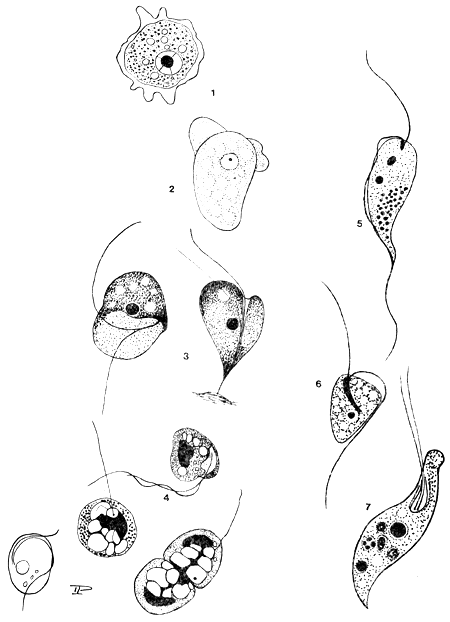
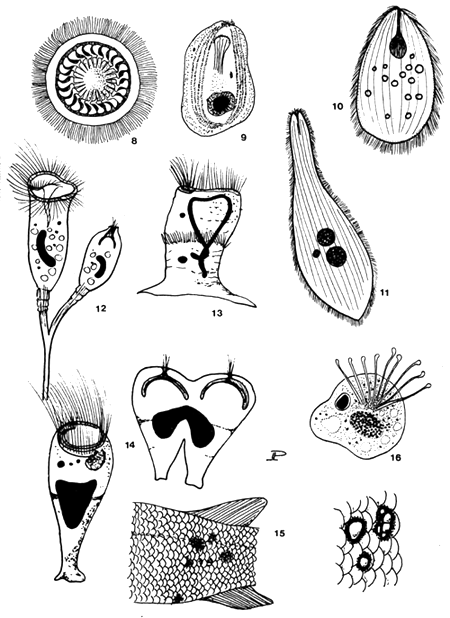
| ILLUSTRATIONS: | Planche 5 | |
| ESPECES TOUCHEES: | Ubiquistes, les infections touchent particulièrement les alevins | |
| SIGNES APPARENTS: | Changements sur la peau, apparents lors des infections généralisées avec coloration anormale: chez les poissons à écailles la couleur devient blanc-grisâtre, souvent accompagnée d'hémorragies dispersées sur la peau, de plaies rouges, d'écailles érodées et d'une surproduction de mucus. Chez les poissons chats la peau est recouverte d'un film de mucus blanc-grisâtre. On n'observe aucun signe particulier sur les branchies même en hyper-infection. Le poisson infecté réagit souvent en s'écorchant (par frottement). | |
| CAUSE: | Flagellés ectoparasites des genres Costia, Colponema et Bodomonas, Ciliés des genres Trichodina, Epistilis, Glossatella, Scyphidia, Childonella, Ichthyophthirius (voir chapitre 6) et Suctoria du genre Trichophyra. | |
| DIAGNOSE: | Le poisson doit être examiné frais, alors que les parasites sont encore vivants. Les Ciliés et les Suctoria peuvent être détectés sur des fragments de branchies et de peau conservés immédiatement après la collecte du poisson frais dans une solution à 4 % de formol alors que les flagellés, au delà, changent souvent d'aspect. Certains, toutefois, peuvent être reconnus à partir de matériel fixé sur une lame, séché, refixé dans de l'alcool méthylique absolu et coloré rapidement avec du bleu de méthylène de Loeffler. Cette méthode n'est cependant pas applicable aux Ciliés ni aux Suctoria. Ces derniers peuvent être préparés pour l'examen microscopique en procédant à des inclusions de fragments du matériel dermique et branchial conservé, dans un glycéro-gel. | 24 |
| La clef du diagnostic différentiel des protozoaires intradermiques est la suivante: elle comprend des genres non encore décrits en Afrique*: |
| (a) | Sarcodina - *Amoebida - ni flagellés, ni cils, forme du corps “amoeboïde”, mouvement par pseudopodes (genres: Acanthamoeba, Thecamoeba et Entamoeba) |
| (b) | Flagellata (Mastigophora) - possédant un flagelle ou plus: |
| | - | genre Costia - Quatre flagelles, deux longs et deux courts, les formes nageuses, libres, sont arrondies, les formes sessiles sont ovales |
| | - | genre Colponema - deux flagelles, le blépharoblaste en forme de filament |
| | - | genre *Bodomonas - deux flagelles, le blépharoblaste est arrondi |
| (c) | Ciliata - cils présents, couvrant une partie ou la totalité du corps de l'organisme: |
| | - | genre Ichthyophthirius - le corps entier est recouvert par des cils; le cytostome est à l'extrémité antérieure, non visible chez les grands individus, un gros macronucleus en forme de fer à cheval (voir planche 6) |
| | - | genre Childonella - cytostome distinct, ciliation incomplète, cils distribués en nombreuses lignes parallèles sur la surface ventrale concave; le macronucleus est rond |
| | - | genre *Amphileptus et Tetrahymena - cytostome distinct, ciliation complète et marcronucleus arrondi |
| | - | genre Trichodina - en forme de coupe, avec un anneau ventral de denticules servant d'organe de fixation (d'autres genres de trichodinidés comprennent:* Tripartiella et *Trichodinella, qui sont différenciés des suivants par des détails de structure des denticules et par la disposition de ces derniers) |
| | - | genre Epistilis - organismes en forme de cône ou de gobelet, ciliation limitée à la zone bucco-dorsale la plus large (zone orale); de nombreux individus se ramifient à partir d'un pédoncule dichotome commun; macronucleus allongé ou rubanné |
| | - | genre Glossatella - forme similaire à celle d'Epistilis, mais les individus sont solitaires, sans pédoncule. Un anneau supplémentaire de cils, médian, est présent chez quelques espèces; macronucleus arrondi |
| | - | genre Scyphidia - organismes solitaires de forme cylindrique plutôt que conique avec un point d'attache élargi à l'extrémité adorale, des cils localisés autour de la zone buccale et, chez quelques espèces, formant un anneau médian supplémentaire |
| (d) | *Suctoria cils absents (présents au stade larvaire), groupe de tentacules s'élevant du corps: genre Trichophyra et autres. | |
| DIAGNOSTIC DIFFERENTIEL: | Les infections dermiques à protozoaires doivent être différenciées par examen microscopique des lésions provoquées par les bactéries, les champignons et Gyrodactylus. | |
| CYCLE BIOLOGIQUE ET EPIZOOTOLOGIE: | La reproduction des organismes détaillés ci-avant est effectuée par division binaire. Les flagellés s'attachent eux-mêmes par leurs flagelles aux cellules intradermiques, Trichodina par ses denticules oraux. L'attache de Childonella est facilitée par ses cils ventraux. Chez Scyphidia et Glossatella, l'extrémité adorale se transforme en organicule de fixation, constitué chez Epistilis par le pédoncule. | |
| Quelques espèces d'Epistilis ne sont pas des parasites intégraux. Epistilis aussi bien que Glossatella, Scyphidia et les Suctoria n'utilisent l'hôte que comme support. Les membres des trois premiers genres sont des filtreurs tandis que les Suctoria sont prédateurs de microorganismes. Trichodina, Childonella et les flagellés parasites sont des parasites plus spécialisés qui se nourrissent à partir des exudats et des tissus de l'hôte: ce sont de vrais parasites. |
| Le site de prédation varie avec les différentes espèces de protozoaires. Scyphidia, Bodomonas et Colponema apparaissent de préférence sur les branchies. Les mêmes espèces peuvent changer leur impact suivant les hôtes et, plus communément, suivant l'âge de l'hôte (la peau des larves, des post-larves ou des alevins, les branchies sur les poissons plus âgés). Les données concernant les poissons africains sont très limitées. Des infections à Trichodina ont été observées dans l'ouest, l'est et le sud de l'Afrique; ces infections à Trichodina sont également communes chez les fingerlings de mugilidés dans les eaux saumâtres de la zone méditerranéenne. Dans les plans d'eau les plus grands (lac Volta, lac Victoria, Kazinga Channel, près du lac George) les infections apparaissent sur les poissons de différentes familles et sont ordinairement faibles et sporadiques quoique de fortes infections soient occasionnellement rencontrées sur quelques individus. Dans le lac Victoria, elles sont communes sur Tilapia juvénile, y compris sur des alevins encore en incubation dans la bouche de leurs parents. De fortes attaques furent observées chez de petites espèces de Barbus, Alestes et de Cyprinodontidés, ainsi que sur des fingerlings de Tilapia et de Clarias sp. stockés dans des étangs trop petits et dans des mares résiduelles de rivières pendant la saison sèche. |
| Un Tilapia mossambica provenant d'un barrage réservoir à Port Elizabeth, en Afrique du Sud, examiné au cours des mois de saison froide (quand la température descend en dessous de 17°C) a été trouvé sévèrement infecté par des protozoaires intradermiques, Costia necatrix, Trichodina sp. et Childonella cyprini. Childonella a été trouvé en grand nombre sur les branchies et la peau de poissons atteints de saprolégniose; chez les poissons non atteints, Childonella était rare tandis que Trichodina était commun, alors que l'infection par Costia, était équivalente chez les poissons atteints et non atteints de saprolégniose. Des poissons furent infectés par Glossatella sp. et par Scyphidia sp. Des carpes, dans le même réservoir, ont été gravement infectées par Trichodina et Costia, mais seulement modérément par Childonella. Ni Glossatella, ni Scyphidia ne purent être décelés sur les carpes examinées. | 25 |
| Une mortalité sur Tilapia mossambica, associée à une hyperinfection par Childonella sp. a été signalée sur des poissons élevés au Transvaal pendant la saison froide, lorsque les températures tombent en dessous de 18°C. Une hyperinfection par Childonella cyprini a également été trouvée sur des T. zillii moribonds, à la suite de mortalités massives durant l'hiver (à des températures inférieures à 19°C) dans le lac Kineret, en Israël). Ailleurs, Scyphidia a été signalé sur Haplochromis sp. du lac Victoria et Epistilis (solitaire sur un rameau non dichotome), sur Synodontis membranaceus du lac Volta. Une forte infection par Glossatella a également été observée sur une population autochtone de T. nilotica confinée dans des sources d'eau douce du littoral de la mer Morte, en Israël. Des représentants du genre Costia ont aussi été vus sur Aplocheilichthys gambianus (Cyprinodontidés) d'une mare au Ghana. Colponema est commun sur les fingerlings de Mugilidés entrant dans les eaux saumâtres intérieures de la zone méditerranéenne. | 30 |
| Les protozoaires parasites intradermiques Trichodina, Costia, Childonella, Epistilis, Glossatella et Scyphidia, sont communs dans les élevages piscicoles d'eau chaude du sud des Etats-Unis (sur les poissons chats élevés en canaux), en Inde (sur les carpes “indiennes”) et en Israël (sur les carpes “européennes”). Des épizooties sont particulièrement mortelles sur les alevins. Trichodina a causé de sérieuses pertes sur des alevins de poissons chats nouvellement nés dans les écloseries et sur les alevins de carpes d'Europe et d'Inde dans les nourriceries. Des mortalités de poissons chats (Clarias batrachus) ont été signalées en Thaïlande. Des mortalités dues à la Trichodiniase ont également été rapportées sur des alevins et des fingerlings de poissons marins élevés en eau chaude, y compris sur les Mugilidés. Des épizooties à Epistilis donnant la maladie “des points rouges”, apparaissent souvent sur les fingerlings de poissons chats élevés en canaux. Des mortalités dues à des infections à Glossatella ont été signalées sur des alevins de carpes en Europe. Costia necatrix et Childonella cyprini, qui sont de sérieux agents pathogènes des poissons élevés en eaux froides (truite et carpe), ont été introduits dans les fermes et réservoirs des régions chaudes, Israël, le sud des Etats-Unis ainsi qu'en Afrique du Sud; toutefois, dans les milieux d'eau chaude, ces espèces ne causent des épizooties que durant les mois les plus froids de l'année. Dans des étangs, en Israël, pendant l'hiver, ces protozoaires ont gravement infecté les carpes introduites ainsi que les poissons autochtones Tilapia spp.; dans les piscicultures du sud des Etats-Unis, l'intervention d'Epistilis, Scyphidia, Glossatella et Trichophyria (Suctoria) paraît en relation avec la haute teneur de l'eau en matières organiques. Récemment, un rapport croissant sur l'infection amibienne des branchies a été mis étroitement en relation avec trois formes aquatiques libres, non parasites, ce qui laisse suggérer que de telles amibes parasites ne sont pas des parasites obligatoires. On a rapporté des mortalités de poissons dans les élevages de Tilapia aurea du sud des Etats-Unis, que l'on suspecte être associées à la présence d'amibes ectoparasites. L'installation des protozoaires intradermiques est facilitée et accélérée par des dommages dermiques déjà existants: changements structurels dans la cuticule recouvrant l'épiderme et même davantage par une hyperplasie épithéliale induite par des infections fongiques (Saprolegnia), par des ectoparasites (Ichthyophthirius, Gyrodactylus ou Argulus) et des néplasies dermiques - papiloma. C'est la raison pour laquelle ces protozoaires se manifestent souvent comme une infection secondaire surimposée et, fréquemment, on trouve de nombreuses espèces établies sur le même hôte simultanément ou successivement. Le dommage tégumentaire provoqué par une seule espèce de ces protozoaires provoque l'installation des autres. Toutefois, une de ces espèces, en particulier Trichodina, Childonella, Epistilis et Costia, peut apparaître seule comme premier parasite d'un poisson non infecté. |
| PATHOLOGIE: | Les données pathologiques sur l'évolution des tissus, suite à l'infection par des protozoaires intradermiques (à l'exclusion de l'ichthyophthiriase), sont surtout limitées à des signes importants, peu de choses étant connues sur les changements histopathologiques en résultant. La costiase des branchies, chez les Salmonidés et les Cyprinidés, entraîne une hyperplasie aiguë de l'épithélium branchial. Ces changements cellulaires causent une fusion des lamelles branchiales et la prolifération d'un mucus cellulaire. L'affection de la peau du poisson chat entraîne une hyper-production de mucus, la dégénérescence et la nécrose des cellules épithéliales et une hyperémie du derme. Les infections par Trichodina et Childonella sont plus douces mais très semblables à celles causées par Costia: irritation des téguments et de l'épithélium branchial avec hyperplasie entraînant dégénérescence et nécrose de l'épithélium avec une production abondante de mucus par prolifération des cellules muqueuses. Dans quelques infections branchiales par Trichodina, la desquamation et l'érosion de l'épithélium sont plus significatives que la prolifération de l'épithélium signalée ci-avant. Les changements pathologiques induits par une infection causée par Scyphidia, Glossatella et les Suctoria sont variables. L'hyperplasie épithéliale des nageoires a été observée dans les hyper-infections causées par Scyphidia et par les Suctoria. Dans d'autres exemples aucun changement pathologique distinct ne peut être déterminé même lors des hyper-infections mortelles causées par ces derniers parasites. On suggère alors comme cause de mortalité, une interférence mécanique avec l'activité des échanges gazeux. Dans l'infection à Epistilis, l'irritation causée par les parasites fixés par leur pédoncule entraîne d'importantes lésions hémorragiques avec érosion des écailles et mise à nu des arêtes superficielles et des rayons durs des nageoires. Les lésions commencent par une petite protrusion hyperplasique de l'épithélium qui s'érode ensuite et devient hémorragique. Quand des protozoaires intradermiques apparaissent dans une infection mixte, accompagnés souvent par des gyrodactylidés et même par des argules, il est difficile de faire la différence entre un dommage causé par les espèces, qu'elles soient parasites premiers ou seconds. L'évolution pathologique résulte souvent de l'action combinée des différents parasites de ce complexe. En outre, des changements complémentaires peuvent se superposer aux lésions primaires par l'action d'infections secondaires bactériennes (myxobactéries) et fongiques aboutissant à de graves ulcères cutanés et à d'éventuelles septicémies bactériennes. | |
| CONTROLE: | Les infections causées par Trichodina, Costia, Epistilis, Glossatella, Scyphidia et Trichophyra sont combattues dans les étangs de pisciculture et dans les écloseries, ordinairement par l'application de formol à 15–25 ppm. Usuellement, une seule application suffit à entraîner une éradication efficace. Dans les réservoirs de stockage en eau marine ou saumâtre infectés par Trichodina, il faut employer 100 à 150 ppm de formol pendant 3 à 6 heures. La lutte contre Childonella requiert de plus fortes concentrations de formol, 40 à 50 ppm pendant au moins 20 heures. Childonella a été effectivement éliminée en plaçant des poissons dans un bain de salinité de 0,5 ppt (250 ppm de chlore) pendant 4 à 5 jours. | |
| DISTRIBUTION GEOGRAPHIQUE CONNUE: | Les membres des genres de protozoaires ectoparasites dont il a été question ont une distribution mondiale. Jusqu'alors, aucune étude taxonomique n'a été entreprise pour déterminer les espèces apparaissant sur les poissons en Afrique. Les données sur l'apparition de ces protozoaires en Afrique sont trop sporadiques pour entraîner des remarques concluantes. | 31 |
| REFERENCES: | 6, 39, 48, 58, 79, 164, 167, 168, 197, 211, 216, 223, 240, 241, 242, 243, 249, 251, 273, 286. | |
| Ichthyophthiriase, la maladie des points blancs | |
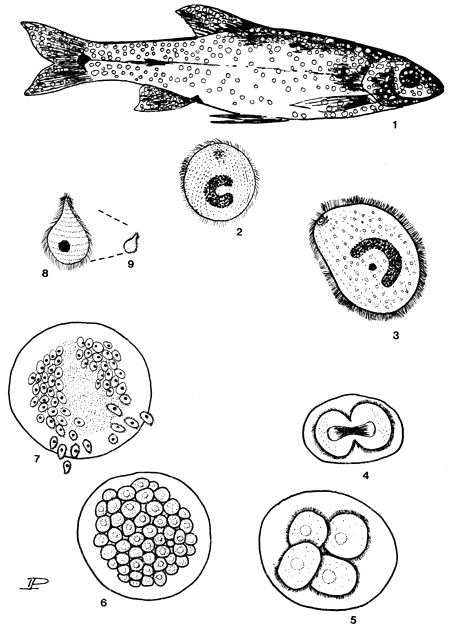
| ILLUSTRATIONS: | Planche 6 | |
| ESPECES TOUCHEES: | Tilapia leucostica, T. nilotica, T. zillii, T. mossambica, Clarias carsoni, Ctenopoma murieri, Cyprinus carpio (carpe), Barbus amphigramma, B. aeneus, Anguilla mossambica et Salmo gairdneri (truite arc-en-ciel). Potentiellement chez tous les Cyprinidés, Cichlidés et poissons d'autres familles. | |
| SIGNES APPARENTS: | Points blancs (pustules) sur la peau, les nageoires et les branchies. Chez certains poissons, ces pustules peuvent être localisées sur les branchies seulement et être absentes des nageoires et de la peau. Le poisson fortement infecté refuse toute nourriture et se rassemble à l'entrée ou à la sortie des étangs. | |
| CAUSE: | Infection par Ichthyophthirius multifilis, Eucilié, Protozoaire. | |
| DIAGNOSE: | L'examen microscopique (x 100) de fragments de peau, de nageoires ou de branchies révèle des organismes ciliés ronds ou ovales, de 0,6 à 0,7 mm de diamètre (quelques spécimens peuvent même atteindre 1 mm de diamètre). Un grand macronucleus en forme de croissant est distinct, même chez les spécimens vivants, particulièrement chez les plus grands et le micronucleus est petit et indistinct chez les spécimens vivants. Le cytostome est également petit et indistinct. Les cils couvrent le corps uniformément en rangées serrées. | |
| DIAGNOSTIC DIFFERENTIEL: | Les pustules blanches doivent être différenciées de structures similaires constituées par des organismes enkystés (myxosporidies, microsporidies, épithéliocystis, métacercaires, oodinium et lymphocystis). Par examen microscopique, les Ichthyophthirius, particulièrement les formes juvéniles, doivent être différenciées des ciliés parasites et commensaux (Tetrahymena, Hemiophrys, Childonella et autres, qui ont tous une ciliation plus éparse, un cytostome grand et distinct, ainsi qu'un macronucleus rond). | |
| BIOCYCLE ET BIOLOGIE: | Les stades adultes (trophozoïtes) se développent à l'intérieur de l'épithélium de la peau ou des branchies. A maturité, atteinte à la température optimale de 21 à 24°C en 3 à 4 jours, à 25–28°C en 2 jours, le parasite quitte son hôte et, en 2 à 6 heures, s'installe sur un substrat dans l'habitat et forme un kyste en s'entourant d'une fine membrane. A l'intérieur du kyste, le protozoaire est l'objet d'une série de divisions binaires qui aboutissent à la production de 250 à 2 000 “tomites”. Le nombre ainsi formé est directement en relation avec la taille de l'adulte enkysté. Les trophontes peuvent produire des kystes et des tomites s'ils sont délogés de l'hôte avant d'avoir atteint leur taille définitive. Ce développement est complet à température optimale dans les 15 à 20 heures. Le kyste éclate et les tomites libérés, d'une taille de 30 à 40 μm, nagent aux alentours, à la recherche d'un poisson-hôte. S'il ne trouve pas d'hôte, le tomite meurt dans les 24 heures. Aux basses températures, le développement du trophozoïte sur l'hôte, comme le développement du tomite dans le kyste, sont prolongés. Le cycle complet à 20°C, est toujours achevé dans les 3 à 5 jours, tandis qu'à 15°C, il est prolongé jusqu'à 7–14 jours et à 10°C à 21–35 jours. Aux basses températures, les trophozoïtes atteignent des tailles plus grandes, 0,8 à 1,0 mm à 5–10°C, comparées à 0,5–0, 7 mm à 20–24°C. Ainsi, aux températures plus basses, le rythme de développement plus lent est compensé par une fécondité accrue, puisque les trophozoïtes plus grands produisent davantage de tomites. La diversité des données obtenues sur la réponse des parasites aux températures par différents chercheurs, laisse suggérer l'existence de nombreuses pressions d'ordre géographique avec différentes tolérances environnementales. Les données sur l'effet d'autres paramètres environnmentaux sont moins concluantes. Un taux d'oxygène plus bas (inférieur à 1 mg /litre) pourrait être néfaste au parasite, ce qui pourrait expliquer sa disparition des étangs piscicoles en Israël et dans le sud des Etats-Unis pendant les mois d'été. On a rapporté des limites de tolérance du pH situées entre 5,5 et 10,1; d'autres données ont placé la limite supérieure à 8,5. | 32 |
| EPIZOOTOLOGIE: | Les espèces de poissons ont une sensibilité variable à la maladie; quelques espèces n'hébergeront l'infection que sur leurs branchies. Il est suggéré plus loin que les populations parasites, dans les différentes régions géographiques, peuvent varier dans leur préférence à l'égard des hôtes. En Ouganda, la carpe et le tilapia ne succombent pas à l'infection, Lebistes reticulatus (Guppy), peu, tandis que Barbus sp., Clarias carsoni et Ctenopoma murieri meurent quelques jours après leur exposition, en raison d'une très forte infestation. En Afrique du Sud, on a noté des infestations suivies de mortalités dans les trutticultures au Cap et au Transvaal, ainsi que dans les élevages d'anguilles à Grahamstown. Les infections ont provoqué des mortalités de 75 à 93 % dans les élevages de truites arc-en-ciel de quelques écloseries. A Grahamstown, 70 % des civelles et 47 % des anguillons ont été infestés. L'infestation y fut apparemment introduite avec les civelles capturées dans la nature: 6,4 % des civelles capturées dans la rivière Keiskamma étaient infectées. Dans des fermes du Transvaal, une espèce locale de Barbus (B. aeneus) a également été trouvée infectée. Des infections sporadiques y sont aussi décelées sur Tilapia mossambica et la carpe, dans les élevages. | |
| Dans les fermes piscicoles de l'Inde et d'Israël, les carpes et les cyprinidés en général sont très sensibles et succombent fréquemment à l'infection, de même que le poisson chat (Ictalurus punctatus) élevé dans le sud des Etats-Unis et les truites partout où elles sont élevées. Tilapia spp. élevés en Israël s'infectent également mais les mortalités sont rares. Tilapia mossambica introduit à Hawaï et à Singapour, succombent à l'infection. Ces variations dans la sensibilité sont d'une grande importance épizootologique. Les espèces les moins sensibles peuvent ne porter qu'une faible, voire qu'une infection résiduelle pendant un très long temps et servir ainsi de réservoir d'hôtes pour le parasite (en Ouganda, une faible infection chez la carpe subsista pendant plus de 55 jours). Une guérison spontanée apparemment due à une immunité acquise, se manifeste même chez les espèces de poissons les plus sensibles (carpe et truite). Les carpes survivant à l'infestation deviennent résistantes à une réinfestation pendant plus de huit mois. Des conditions optimales de croissance et une haute température accélèrent l'acquisition de la résistance. Aux températures inférieures à 15°C quand la croissance du poisson est ralentie, le processus immunitaire est différé. A des températures plus basses, inférieures à 17°C, l'infection peut persister sur les poissons, à un bas niveau. La période la plus critique, pour les spizoïtes d'Ichthyophthirius est la période transitoire entre la saison froide et la saison chaude, quand les eaux se réchauffent et favorisent la reproduction des parasites alors que le poisson s'alimente et croît plus lentement en regard de l'accroissement des températures. Cette condition peut être particulièrement critique pour le poisson (spécialement pour les cichlidés élevés en zone méditerranéenne ainsi que dans les zones sud de l'Afrique. |
| PATHOLOGIE: | L'infection de la peau conduit à l'hyperplasie des cellules épithéliales de Malpighi et à la prolifération du mucus ainsi qu'à des degrés variables de la réponse inflammatoire: oedèmes, congestion et infiltrations cellulaires dans le derme et même dans les muscles sous-jacents. En évolution avancée, la couche épidermique se désintègre et le derme est à découvert. L'infection des branchies se caractérise par une prolifération de l'épithélium interlamellaire avec, éventuellement, l'enlisement des lamelles. L'évolution épithéliale est accompagnée par un accroissement du nombre des cellules muqueuses. L'épithélium hyperplasique subit une dégénérescence et est infiltré par des lymphocytes et par des neutrophiles (macrophages). | 33 |
| TRAITEMENT ET CONTROLE: | Le traitement de l'Ichthyophthiriase est difficile. Aucun des produits chimiques d'un usage courant n'assure un contrôle radical de l'infection dans l'étang en une ou même en plusieurs applications. Les produits chimiques recommandés en concentrations tolérées par le poisson sont: | |
| - | le formol - 200 ppm pendant une heure ou 40 ppm appliqués aux étangs | |
| - | le vert malachite - 0,1 à 0,15 ppm ou un mélange de vert malachite à 0,05 ppm et de formol à 50 ppm, appliqué aux étangs, délogeront efficacement les trophozoïtes du poisson. L'action ne tuera toutefois qu'une partie, ou aucun des trophozoïtes délogés et des kystes existant dans la vase du fond des étangs. | |
| Ces produits chimiques élimineront cependant efficacement les tomites libres. Ainsi, une stratégie de traitements répétés devrait être appliquée dans un laps de temps capable de détruire les tomites émergeants, à condition de prendre en compte la durée du biocycle du parasite à la température prévalant dans l'étang. On doit toutefois garder en mémoire qu'une seule application ou un programme incomplet d'applications, peut entraîner une vague accélérée d'infestation, attendu que le délogement des trophozoïtes, sans tenir compte de leur âge, induit leur reproduction en tomites. Cependant, même si un contrôle radical ne peut être accompli, des traitements répétés préviendront une hyperinfection et une mortalité et mettront le poisson à même de développer éventuellement une immunité contre les parasites. Pour promouvoir une telle immunité, il est également recommandé de réduire les densités de mises en charge dans l'étang, dans le but de favoriser le taux de croissance du poisson. | |
| DISTRIBUTION GEOGRAPHIQUE CONNUE: | I. multifilis a été signalé dans tous les continents sur des poissons sauvages ou d'élevage ainsi que sur des poissons d'aquarium. Cette distribution cosmopolite a été considérée comme le résultat d'introductions actives de poissons d'élevage et d'aquarium, notamment la truite, le poisson rouge et la carpe. Toutefois, il peut tout aussi bien exister des populations autochtones sur les poissons sauvages dans de nombreuses régions d'Eurasie, d'Afrique et d'Amérique. Les infections signalées en Afrique - Ouganda et Afrique du Sud - ont été apparemment la résultante d'introductions de poissons infestés. | |
| REFERENCES: | 5, 21, 39, 73, 79, 89, 91, 92, 93, 95, 114, 166, 195, 202, 249, 252. | |