por
Makie Kodaira
Instituto de Ciencias y Tecnología de Alimentos
Facultad de Ciencias
Universidad Central de Venezuela
Caracas, Venezuela
| RESUMEN |
| En el presente trabajo se examinan algunos aspectos a tomar en cuenta en la manipulación y transporte de pescado fresco de origen continental. Se señala la importancia del conocimiento de las características de los cambios post-mortem que suceden en las especies de aguas cálidas y se presentan los resultados de las experiencias obtenidas en relación con los cambios químicos, microbiológicos y sensoriales que ocurren en la cachama durante el almacenamiento refrigerado. |
INTRODUCCION
El crecimiento de la pesca en aguas continentales es lento a nivel internacional en comparación con el constante crecimiento de la pesca marítima. No obstante, no deja de ser una actividad muy importante, tanto económica como nutricionalmente, para las poblaciones alejadas de las costas marítimas, especialmente de países tropicales.
Una característica común de la pesca continental lo constituye su tipo de extracción que es artesanal, local y estacional. Esto, unido a la gran distancia que separa los lugares de pesca de las zonas urbanas, determinan el lento desarrollo de este tipo de pesca. Su contribución al volumen total de la pesca mundial es muy pequeña. Sin embargo, existe una gran expectativa en el crecimiento de la pesca de especies de origen continental mediante las prácticas de la acuicultura. Por otra parte, la acuicultura es relativamente reciente en los países tropicales, y los primeros avances se han realizado en los sistemas de cultivo a través de estudios sobre los aspectos biológicos, fisiológicos, nutricionales e ictiopatológicos de las especies continentales que ofrecen mayor potencialidad para el cultivo en cada país.
Los conocimientos relacionados con la manipulación y estabilidad en almacenamiento de especies continentales y de cultivos tropicales son muy escasos; a pesar de la importante contribución de estos conocimientos para la utilización eficiente en términos de calidad y disminución de pérdidas post captura.
CAMBIOS POST-MORTEM DE PESCADO DE ORIGEN CONTINENTAL
Nuestros conocimientos sobre los cambios post-mortem del pescado de origen continental son muy pobres en comparación con los de origen marítimo. Los pocos conocimientos disponibles en este aspecto son los de trabajos realizados en especies continentales de aguas frías o templadas. Según estos trabajos, los cambios post-mortem parecen suceder, más o menos, bajo el mismo patrón que el de las especies marinas.
Uno de los atributos de la calidad del pescado, que pudiera considerarse de mayor importancia, es la frescura. El pescado es más susceptible que cualquier alimento a la pérdida de frescura y al consiguiente deterioro de la calidad y este proceso de alteración de la frescura es muy complejo, debido a que no existe un sólo factor que sea responsable del mismo.
Tan pronto como el pez muere, comienzan una serie de cambios debido a reacciones químicas, tales como la autólisis, la oxidación de los lípidos y reacciones debidas a las actividades metabólicas de los microorganismos.
Desarrollo de rigor mortis
Uno de los factores importantes que afecta la frescura del pescado es el rigor mortis o endurecimiento muscular. Este fenómeno, caracterizado por la pérdida de extensibilidad y flexibilidad, es inducido por la disminución en los niveles del ATP y sus precursores en el músculo. La relación del rigor mortis y los cambios en las concentraciones de fosfatos de creatina, ácido láctico, ATP y compuestos relacionados han sido estudiados exhaustivamente durante muchos años, tanto en carne como en pescado (Bate-Smith and Bendall, 1947; Bate-Smith and Bendall, 1949; Bendall, 1951; Cassens and Newbold, 1967; Iwamoto, et. al., 1988; Watabe, et. al., 1989; Watabe, et. al., 1990). Un hecho muy conocido es la importancia de retardar el desarrollo del rigor para alargar el tiempo de la frescura del pescado, así como disminuir la pérdida de rendimiento. La velocidad de la instauración del rigor, la duración y el cese, dependen de diversos factores complejos relacionados entre sí, tales como la especie, la época, las condiciones fisiológicas antes del sacrificio, la forma de sacrificio, la manipulación y la temperatura de almacenamiento. Se han publicado numerosos estudios en relación con el efecto de cada uno de los factores sobre la velocidad de la marcha de rigor de las especies de importancia comercial en los países industrializados (Johnston and Moon, 1980; Botta et. al., 1987; Iwamoto, et. al., 1987; Watabe, et. al., 1989), sin embargo, no existen estudios detallados y consecutivos sobre el tema en especies tropicales, menos aún para especies continentales.
Como resultado de las investigaciones realizadas sobre los cambios post-mortem, se ha comprobado plenamente que las condiciones fisiológicas de inanición y cansancio previo a la muerte, y del sacrificio con estrés, son perjudiciales en el retardo del rigor. En cuanto al efecto de la temperatura de almacenamiento post-mortem, igualmente se ha generalizado la idea de que a medida que desciende la temperatura, se retarda la marcha del rigor mortis. Sin embargo, los resultados experimentales recopilados por Iwamoto (1991) muestran que muchas especies retardan el rigor a medida que desciende la temperatura de almacenamiento, pero en otras son más rápidas a 0°C en comparación con las mismas almacenadas a 10°C. En la comercialización de pescados sacrificados en forma especial, enseguida después de la captura, muy cotizados en Japón; al igual que los peces transportados vivos, se evita el excesivo uso de hielo. Esta práctica fue adquirida por experiencias en diferencias de precios entre pescado bien enhielado y otro moderadamente enhielado. Este fenómeno fue comprobado experimentalmente en lenguado (Fig.1), observándose que el rigor mortis se desarrolla más rápido a 0°C y 20°C, y se retarda a un rango de temperatura entre 5°C y 15°C. De modo que en la comercialización de estas especies se recomienda mantener una temperatura entre 5 y 10°C., no obstante una vez alcanzado el rigor máximo, es recomendable descender la temperatura cercana a 0°C para retardar el posterior deterioro (Fig.2).
Así mismo, los estudios realizados por Tanaka (1991) sobre el efecto de las temperaturas de 0°C y 8,5–10°C sobre velocidad de la marcha de rigor mortis durante el transporte y venta (Fig. 3 y Tabla 1) de lenguado, Paralichtys olivaceus, sacrificado y sangrado inmediatamente después de la captura, mostraron el sorprendente resultado de que los ejemplares almacenados a 10°C al cabo de 17 horas estaban en estado de pre-rigor o comienzo del mismo, mientras que los almacenados a 0°C, estaban en estado de pleno rigor y fueron ofertados a mucho menor precio que los ejemplares almacenados a 10°C. Igualmente los valores de ATP y fosfato de creatina fueron mayores en los ejemplares transportados a 10°C que en los transportados a 0°C (Tabla 2). Resultados similares fueron observados por Iwamoto, et. al., (1985) e Iwamoto (1991) en pargos, Pargus major, los cuales mostraron un retraso de 4 a 9 horas en el inicio del rigor mortis al ser almacenados a 10°C, en comparación con los almacenados a 0°C.
Igualmente, en especies tropicales, Curran, et. al. (1986) y Parry, et. al., (1987) observaron el fenómeno del acortamiento por frío “cold shock”. Curran, et. al., (1986) compararon la velocidad de desarrollo del endurecimiento muscular de tilapia, Oreochromis auresi niloticus (híbrido), y de la carpa, Cyprinus carpio, almacenados inmediatamente después de muertos a temperaturas de 0°C y 22°C. Las tilapias colocadas en hielo desarrollaron inmediatamente el proceso de endurecimiento, en cambio las almacenadas a 22°C desarrollaron el mismo fenómeno sólo después de 7 horas. Por el contrario, en carpas almacenadas a 0°C y 22°C no se observó esta diferencia de tiempo, ocurriendo el endurecimiento a las 16 y 17 horas respectivamente (Fig.4); Resultados similares fueron observados por Parry, et. al., (1987) en “bighead”, Aristychthys nobilis, de Filipinas y trucha, Salmo gairdnerii, (Figs. 5 y 6).
Estas observaciones reflejan la necesidad de conocer la temperatura óptima de almacenamiento para nuestras especies continentales de importancia comercial. Esto es aún más importante para los países tropicales donde la temperatura ambiental y del agua es más elevada que la de los países de la zona templada o fría. Además la gran distancia que existe entre las zonas de pesca y los centros urbanos de mayor concentración de consumidores potenciales, hace necesario el control de la temperatura durante el transporte. El conocimiento cabal de los cambios post-mortem y la aplicación de la temperatura y tiempo óptimo de almacenamiento durante el transporte y venta, conjuntamente con los conocimientos de los otros factores que afectan la marcha de rigor mortis de nuestras especies, contri-buirán de manera significativa a mejorar la calidad del pescado de origen continental, lo cual repercutirá sobre los aspectos económicos disminuyendo las pérdidas post captura.
Es importante realizar investigaciones consistentes y detalladas de los cambio post-mortem de nuestras especies de interés comercial; sin las cuales sería difícil mejorar la calidad de estas especies durante el almacenamiento en hielo, así como desarrollar la tecnología que pueda transformarlas en productos alternos.
Se ha observado que las especies cultivadas muestran generalmente baja calidad de textura y sabor, lo cual puede estar relacionado con la mayor velocidad del proceso de rigor mortis en estas especies, traduciendo esto en la rápida pérdida de frescura (Iwamoto y Yamanaka, 1986; Iwamoto et. al., 1990). Al respecto se han publicado muy pocos estudios comparativos entre las especies cultivadas y silvestres en relación con los cambios post-mortem. En especies cultivadas es igualmente importante considerar un nuevo factor que pudiera afectar el proceso de rigor mortis, que es la temperatura del agua. Claro está que existen otros factores, tales como la densidad, la alimentación, las enfermedades, etc., que lo pueden afectar. Los primeros estudios en relación con los efectos de los factores pre-mortem fueron relacionados con los efectos de la temperatura del agua. En este sentido Abe en 1991, y Abe y Okuma en 1991, observaron la influencia de las diferencias en las temperaturas del agua y la marcha de rigor mortis en carpas almacenadas a 0°C y a 20°C. Las carpas aclimatadas a 10°C, 20°C y 30°C, y almacenadas a 0°C mostraron mayor velocidad de la marcha de rigor que las almacenadas a 10°C, en cambio las aclimatadas a 5°C no mostraron diferencia significativa entre las dos temperaturas de almacenamiento post-mortem. Por supuesto que en los ejemplares aclimatados a 30°C, el proceso de rigor fue mucho más rápido en cualquiera de las dos temperaturas de almacenamiento. Estos resultados reflejan la importancia de las diferencias entre la temperatura corporal pre-mortem y la temperatura de almacenamiento. Este gradiente de temperatura será mucho mayor en nuestras especies tropicales, de manera que es beneficioso desde el punto de vista económico conocer la temperatura óptima de refrigeración.
Por otra parte, la temperatura en que se desarrolla y cesa el rigor mortis pudiera causar el fenómeno de resquebrajamiento originado por la posible desnaturalización de las proteínas de tejido conectivo y el colágeno, produciendo a su vez dificultad de procesamiento y pérdidas de rendimiento durante el fileteado. Esta temperatura parece dependiente de la especie (Lavety et. al., 1998, Yamaguichi et. al., 1976) y de la época de pesca.
Aunque son pocos los estudios realizados en relación con la evidencia del acelerado endurecimiento o rigor causado por el rápido enfriamiento, sería importante considerar estos efectos en nuestras especies de aguas cálidas en términos de rendimiento y pérdida post-captura. Igualmente se debe considerar qué efecto podría causar la temperatura de almacenamiento óptimo para retardar el desarrollo de rigor sobre la actividad microbiana.
Acción enzimática y microbiológica
El pescado se deteriora definitivamente por los cambios subsiguientes al rigor mortis; cambios debido a la acción enzimática y fundamentalmente por la acción microbiana. La velocidad de estos cambios deterioradores está directamente relacionada con la temperatura de almacenamiento y con la manipulación.
Muchos autores han afirmado que las especies tropicales, de aguas cálidas, son generalmente más resistentes a los cambios deterioradores, enzimáticos y microbiológicos, y por consiguiente, el tiempo de guarda en hielo es mayor que en las especies de aguas templadas y frías. Sin embargo, esto merece una revisión con nuestras especies bajo las condiciones usuales de comercialización en nuestros países.
Por otra parte, la flora bacteriana, tanto cualitativa como cuantitativamente, es función del medio ambiente (Shewan, 1977), siendo ésta mayor en las zonas tropicales que en las templadas. En las aguas frías la carga microbiana es bastante psicrófila y Gran negativa, siendo los principales géneros Pseudomonas, Altermonas, Moraxella, Acinetobacter y Vibrios. Por el contrario, reportes de algunos trabajos en la zona tropical indican un alto predominio de flora Gran positiva como son Micrococcus, Corineyformes y Bacillus, Novoa (1980) realizó un recuento de la flora microbiana de curvinata venezolana y encontró que el 97 % de la flora bacteriana aislada era Gran positiva, siendo principalmente los géneros Micrococcus, Bacillus, Corineyformes, Artherobacter, Lactobacillus, Streptococcus y Stafilococcos. Por el contrario, Ramírez (1985) encontró en la lamparosa venezolana Vomer setapinnis el predominio de flora bacteriana Gran negativa (Fig.7). De lo antes señalado se desprende que la flora bacteriana en pescado marino depende de la especie, del alimento, zona y época de captura.
Diversos autores han señalado que el pescado proveniente de aguas continentales lleva bacterias de los mismos géneros hallados en aguas marinas, aunque la incidencia de estas bacterias depende, en parte, de la influencia de las plantas terrestres, animales y suelos de las zonas de extracción.
Liston (1979) señala que durante el almacenamiento en refrigeración, se producen cambios de la flora bacteriana, las Pseudomonas rápidamente asumen una posición dominante en la microflora, mientras que Lavobacterium y Achromobacter persisten pero van disminuyendo. De León y Marth (1979), en un estudio sobre la flora microbiana de peces marinos de aguas tropicales encontraron que el crecimiento de las Pseudomonas ocurría a expensas de otras especies, y disminuyeron las Moraxellas y Alcaligenas.
La práctica común en nuestras especies marinas de tamaño mediano o grande, es la evisceración abordo antes de refrigerar o congelar. Esta práctica se realiza con la finalidad de evitar el deterioro de las cavidades abdominales por la acción de las enzimas digestivas, así como eliminar la carga microbiana presente en los intestinos. En tal sentido Novoa (1982) estudió el efecto de eviscerado y lavado sobre el desarrollo de micro-organismos en piel y músculo de curvinata, Macrodon ancylodon, no encontrando diferencias sustanciales en la carga microbiana debido al eviscerado y lavado (Fig. 8). Sin embargo, para la trucha de agua fría el eviscerado parece ser de primordial importancia para alargar el tiempo de guarda en hielo (Hansen, 1979). No obstante, el mismo autor (Hansen, 1963) señala la susceptibilidad de las truchas evisceradas a la oxidación de los lípidos.
La ventaja o no de las prácticas de manipulación previa al almacenamiento, tales como el eviscerado o la eliminación de las branquías, parece depender de la especie. Así los estudios realizados por Abedona (1982) sobre la influencia de presencia o no de las branquías de las especies: tilapia, bagre y Chrysichthys, sobre la acumulación de bases volátiles totales (BVT) mostraron claramente las ventajas de la eliminación de las branquías con el objeto de alargar el tiempo de guarda en hielo de las tres especies.
Aunque se considera que la carga bacteriana del pescado provenientes de aguas continentales es menor que la de especies marinas, se hace necesario revisar la influencia de la manipulación, tales como el descabezado, eviscerado, fileteado, sobre la estabilidad de nuestras especies continentales y de la acuicultura en refrigeración. Especialmente en Venezuela, donde muchas de estas especies se transportan enteras, sin eviscerar, hasta el momento de la venta al consumidor.
MANIPULACION DE ESPECIES CONTINENTALES EN VENEZUELA
La pesca continental en Venezuela es netamente artesanal, estacional y local, aportando solo aproximadamente 8–10 % de la pesca total nacional. Sin embargo es una actividad importante que provee proteína animal a las poblaciones, generalmente de bajos ingresos, dispersas en las regiones centro y sur del país.
La actividad de pesca dura medio día, con pequeñas embarcaciones, y una vez desembarcados los pescados; constituidos en su gran mayoría por varias especies de bagres sin ningún tipo de refrigeración son comprados por los intermediarios, que son los dueños de transporte refrigerado con hielo picado, conocidos como caveros. Muchos de estos caveros permanecen varios días en las orillas de los grandes ríos hasta reunir suficiente carga para transportarlas a los centros de mayor población, y finalmente se realiza la venta en los mercados o a las pescaderías y restaurantes.
Se pudo constatar que los caveros usan suficiente hielo. Sin embargo, la permanencia del pescado durante varios días apilado (no usan cajas) dentro del transporte, causa daños físicos y microbiológicos considerables. Esto se puede evaluar sensorialmente en el pescado que, esporádicamente, llega a la capital en forma fresca, el cual está deshidratado y golpeado, originando que los compradores (pescaderías, ventas ambulantes y supermercados) no lo traten con el mismo cuidado como lo hacen con las especies marinas. Como resultado, este pescado es vendido a menor precio que las especies marinas.
Por otra parte, hay venta de pescado directamente al consumidor local en las orillas de los grandes ríos. La venta de pescado en estos sitios, sin paredes pero con techo para evitar la incidencia de los rayos solares, se realiza colocando el pescado en mesas de madera o colgando del techo aquellas especies de gran tamaño (generalmente más de 1 metro). El uso de hielo en estas ventas es muy poco o ninguno y en muchas especies el descabezado y eviscerado se realiza en el momento de la venta. La venta es al día y el pescado que sobra al final de la jornada es salado y secado al sol en forma rudimentaria.
Por el contrario, las especies cultivadas por las empresas privadas son de mejor calidad de frescura ya que algunas de las granjas de cultivo, especialmente las que cultivan tilapia, poseen pequeñas plantas de fabricación de hielo, donde el pescado es eviscerado, descabezado, empacado en bolsas plásticas y colocado en cajas con hielo. Existen igualmente caveros que recorren varias granjas comprando especies cultivadas, por ejemplo la cachama, Colossoma macropomum, pero las distancias que cubren son generalmente cortas, pudiendo comercializar los productos el mismo día de la captura.
Hasta ahora no se han observado problemas relacionados con la frescura de las especies cultivadas debido al pequeño volumen de producción. No obstante, el auge y la expansión del cultivo de especies continentales de aguas cálidas, prevista por el sector oficial, permite estimar una considerable producción de cachama a corto plazo. Esto hace necesario conocer el patrón de cambios post-mortem de esta especie en refrigeración, no sólo para su utilización en forma fresca, sino también para el desarrollo de productos a partir de las especies cultivadas, ya que la calidad del producto final dependerá de la frescura y la calidad de la materia prima.
EXPERIENCIAS OBTENIDAS EN EL INSTITUTO DE CIENCIA Y TECNOLOGIA DE ALIMENTOS DE LA UNIVERSIDAD CENTRAL DE VENEZUELA EN LA CONGELACION DE CACHAMA CULTIVADA
Con el objetivo de conocer el comportamiento en refrigeración de la cachama cultivada cosechada en diferentes épocas del año (Mayo, Junio, Septiembre) se determinaron cambios químicos, microbiológicos y sensoriales de ejemplares eviscerados y almacenados a 0°C y 6°C. Según los resultados, hubo un ligero incremento de BVT al final del período de almacenamiento (a 0°C, desde 13,33 mg-N/100 g en el día 0 a 15,82 mg-N/100 g a los 30 días de almacenamiento) independientemente de la época de captura (Tabla 3). Las cachamas almacenadas a 6°C, alcanzaron valores de 16,43 mg-N/100 g a los 9 días de almacenamiento. Los primeros 6 días de almacenamiento no se observaron diferencias entre ambas temperaturas de almacenamiento. Estos valores relativamente bajos de BVT pudieran ser dependientes de la especie, ya que en otras especies de aguas continentales cálidas se encontraron valores superiores a los observados en nuestros estudios (Balakrishnan Nair et. al., 1974).
En lo relativo a las pruebas microbiólogicas, el contaje inicial de aeróbios mesófilos, al inicio de la experiencia fue de 1,4 × 103 UFC/g a 1,5 × 103. En los ejemplares almacenados a 0°C estos valores aumentaron paulatinamente hasta alcanzar 107 y 108 UFC/g entre los 27 a 30 días de almacenamiento (Figs. 9 y 10). Por el contrario, a 6°C la multiplicación de aeróbios mesófilos fue más acelerada, alcanzando valores de 107 entre los 12 a 15 días de almacenamiento. En relación con los psicrófilos totales, estos mostraron la misma tendencia que los aeróbios mesófilos, pero con menor diferencia entre las dos temperaturas de almacenamiento (Figs. 11 y 12).
En la evaluación sensorial, las cachamas recién capturadas presentaban la piel brillante, una textura firme y elástica, la coloración rosada en las paredes abdominales y los ojos brillantes (Tabla 4). Entre los primeros cambios que se manifestaron al ser almacenadas a 0°C fue una ligera opacidad de los ojos a partir de 6 a 9 días y una ligera decoloración de la piel y de la carne de las paredes abdominales entre los 15 a 18 días. A los 21–24 días comenzaron signos de deterioro: los valores de BVT alcanzaron de 14,25 a 15,0 mg-N/100 g, los aeróbios mesófilos subieron entre 2,5 × 107 y 4,8 × 107 UFC/g y los psicrófilos de 1,1 × 108 a 6.0 × 108 UFC/g. En el caso de las cachamas almacenadas a 6°C, el deterio se detectó más rápidamente. Fueron considerados aptos para el consumo hasta los 15 días de almacenamiento (Tabla 5). A esta temperatura los signos de deterioro comenzaron entre los 12 y los 15 días de almacenamiento; en que los valores de NBVT alcanzaron entre 13,80 y 16,57 mg-N/100 g, y la carga bacteriana de 1,5 × 107 a 1,7 × 108 UFC/g para aeróbios mesófilos y de 3,9 × 107 a 2,8 × 108 UFC/g para psicrófilos respectivamente.
Según estos resultados, la cachama cultivada se deteriora aproximadamente 1,6 veces más rápido almacenada a 6°C que 0°C. Sin embargo, el prolongado periódo de almacenamiento que presentó esta especie en las dos temperaturas de refrigeración es de suma importancia al considerar que los centros de cultivo se encuentran muy distantes de las zonas metropolitanas, lo que permitirá una amplia distribución del pescado en condiciones aceptables en estas últimas zonas.
REFERENCIAS BIBLIOGRAFICAS
Abe, H. 1991. “Temperatura de aclimatación”. En Rigor mortis in Fish. Ed. Yamanaka, H., Serie Suisangaku, Kosei-sha
Abe, H. and Okuma, E. 1991. Rigor-mortis progress of carp acclimated to different water temperature. Nippon Suisan Gakkaishi, en prensa (1991)
Adebona, M. 1982. Studies on the preservation of fish by ice. FAO Fish.Rep. No. 268
Balakrishnan-Nair, R., Tharamani, P. and Lahiry, N. 1974. Studies in chilled storage of fresh water fish II. Factors affecting quality. J. Food Sci. Technol. 8:53
Bate-Smith, E.C. and Bendall, J.R., 1947. Rigor mortis and adenosintriphosphate. J. Physiol., 106:177
Bate-Smith, E.C. and Bendall, J.R., 1949. Factors determining the time course of rigor mortis. J. Physiol., 110:47
Bendall, J.R., 1951. The shortening of rabbit muscle during rigor mortis: Its relation to the breakdown of adenosintriphosphate and creatine phosphate and to muscular contraction. J. Physiol., 11471
Botta, J.R., Bonnell, G. and Squires, B.E. 1987. Effect of method of catching and time of season on sensory quality of freshraw atlantic cod. J. Food Scie., 52:928
Cassens, R.G. and Newbold, R.P. 1967. Effect of temperature on the time course of rigor mortis in ox muscle. J. Food Sci., 32:269
Curran, C.A., Poulten, R.G., Brueton, A. and Jones, N.S.D. 1986. Cold shock reactions in iced tropical fish. J. of Food Technol., 21:289
De Leon, F. and Marth, E.H. 1979. Bacterial flora of fish from tropical sea water J. of Food Prot., 42:724
Prémoli, A. 1986. Estabilidad de la cachama (Colossoma macropomum) almacenada en refrigeración. Trabajo Especial de Grado. Instituto de ciencia y Tecnología de Alimentos, Fac. de Ciencias, U.C.V., Caracas.
Ramírez, L.G., 1985. Participación de los microorganismos en la alteración de lamparosa almacenada a temperatura de refrigeración. Tésis de Maestría, Instituto de Ciencia y Tecnología de Alimentos, U.C.V., Caracas.
Shewan, J.M. 1977. The biochemistry and microbiology of low temperature spoilage. Food Technol. in Australia, 28:409
Tanaka, T. 1991. “Condición de transporte y precio de mercado”. en Rigor mortis in Fish, Ed. Yamanaka, H., Serie Suisan Gaku, Kosei-sha.
Watabe, S., et. al., 1989. Rigor mortis progress of sardine and mackerel in association with ATP degradation and lactate accumulation. Nippon Suisan Gakkaishi, 55:1833
Watabe, S., et. al., 1990. Changes in rigor mortis progress of carp induced by temperature acclimatation. Agric.Biol.Chem., 54:219
Yamaguchi, K., Lavéty, J. and Love, R.M., 1976. The connective tissues of fish VIII. Comparative studies on hake, cod and catfish collagens. J. of Food Technol. 11:389.
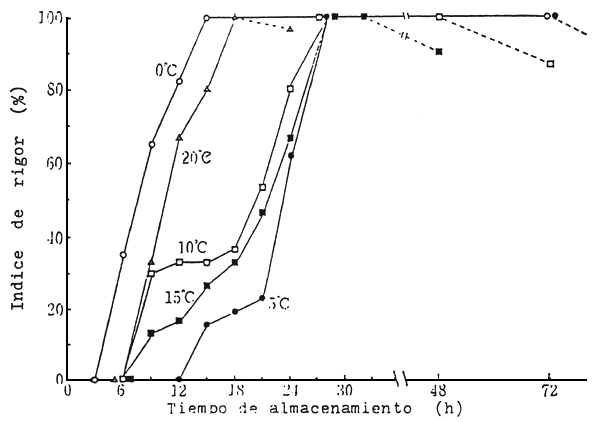
Figura 1 Cambios en el indice de rigor mortis en lenguado almacenado a diferentes temperaturas
Fuente: Iwamoto, 1991
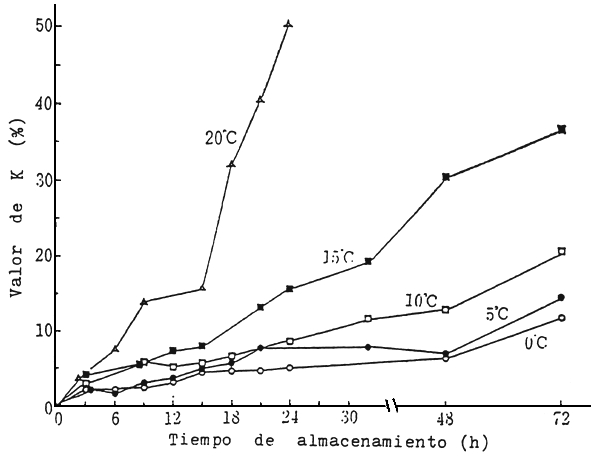
Figura 2 Variaciones en los valores de K en lenguado almacenado a diferentes temperaturas
Fuente: Iwamoto, 1991
| 12:00 | 14:00 | 20:30 | 5:00 |
| | ��������������� | ��������������� | ��������������� | | |||
| Sacrificio | Partida | Llegada | Venta |
| 0 h.| ��������������� | ������������� 450 Km.�������������� |17 h. | |||
Figura 3 Tiempo transcurrido desde el sacrificio hasta la venta de lenguado
Fuente: Tanaka, 1991
Tabla 1
Indice de rigor mortis de lenguado en el momento de la venta
| CONDICION DE TRANSPORTE | NDE MUESTRA | TAMANO (cm) | INDICE DE RIGOR % |
| 1 | 45 | 23 | |
| 10 C × 17 h | 2 | 39 | 23 |
| 3 | 41 | 21 | |
| 6 | 45 | 82 | |
| 0 C × 17 h | 7 | 39 | 72 |
| 8 | 45 | 82 |
Fuente: Tanaka, 1991
Tabla 2
Contenido de nucleótidos, fosfato de creatina y ácido láctico en lenguado transportado a diferentes temperaturas
| CONDICION TRANSPORTE | MUESTRA N | TAMANO (CM) | PESO (Kg) | ATP | IMP | FOSFATO CREATINA | ACIDO LACTICO | |
| SILVESTRE | 10 C × 17h | 1 | 41 | 1,30 | 3,70 | 2,53 | 1,98 | 21,3 |
| 2 | 42 | 1,31 | 4,02 | 1,75 | 2,24 | 16,0 | ||
| 0 C× 17h | 13 | 38 | 1,01 | 2,74 | 6,60 | + | 25,9 | |
| 14 | 47 | 2,18 | 1,99 | 4,21 | + | 21,7 | ||
| CULTIVADO | 10 C × 17h | 21 | 45 | 2,01 | 3,10 | 3,62 | + | 21,7 |
| 22 | 38 | 1,04 | 3,25 | 3,34 | 0,26 | 24,3 |
Fuente: Tanaka, 1991
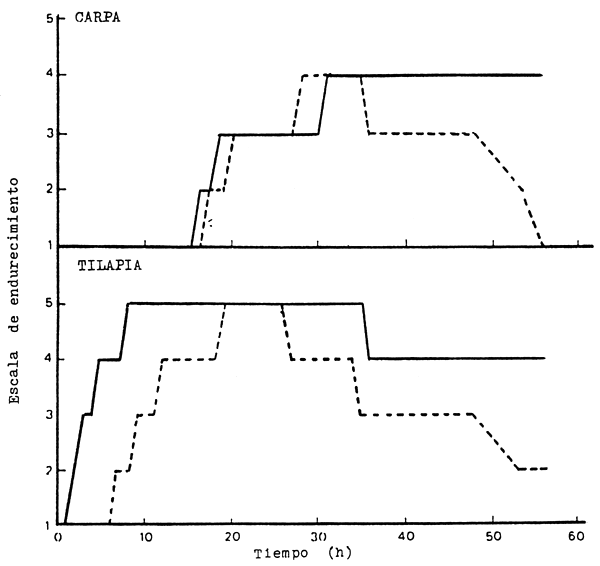
Figura 4 Desarrollo de endurecimiento post-morten en carpa y tilapia almacenada a 0 (-) y 22°C (---)
Fuente: Curran et. al., 1986
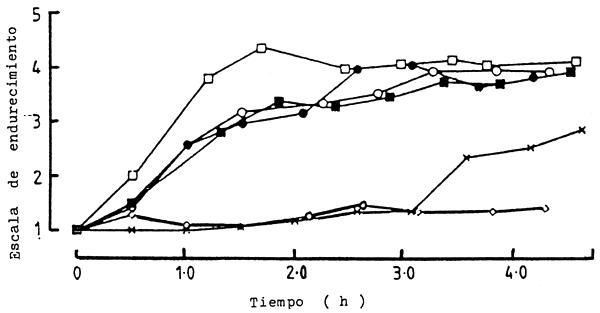
Figura 5 Cambios en la escala de endurecimiento con el tiempo para “bighead” (Aristychthys nobilis) mantenido a temperatura de 0°C a 30°C (○) 0°C, (•) 2°C, (□) 5°C (■) 11°C, (◊) 15°C, (×) 30°C
Fuente: Parry y col., 1987
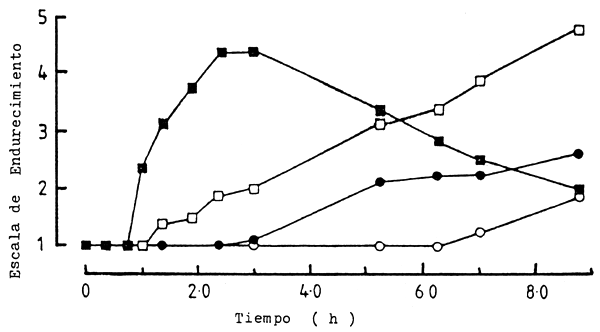
Figura 6 Cambios en la escala de endurecimiento con el tiempo para (Salmo gairdnerii) mantenido a temperatura de 0°C a 25°C (○) 0°C, (•) 7°C, (□) 15°C (■) 25°C
Fuente: Parry y col., 1987
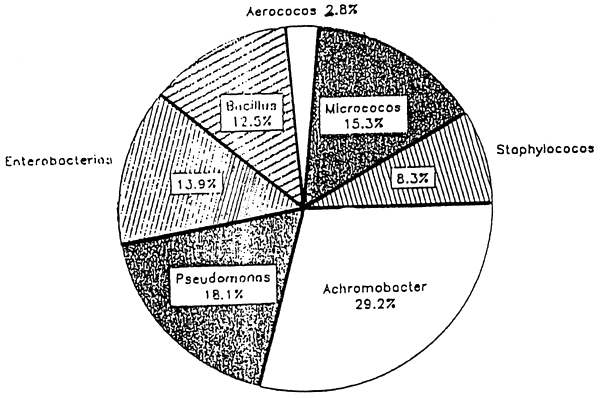
Figura 7 Porcentaje de microorganismos aislados de Lamparosa (Vomer setapinnis) durante el almacenamiento a 0+2°C
Fuente: Ramírez, 1985
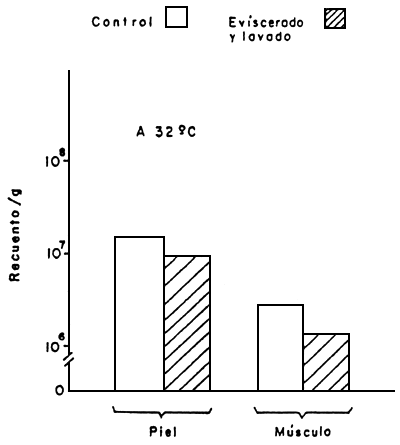 | 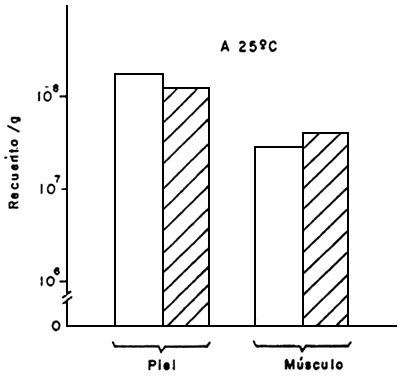 |
Figura 8 Efectos de las operaciones de eviscerado y lavado sobre el crecimiento de aerobios mesófilos (32°C y 25°C), en piel y músculo de pescado fresco
Fuente: Novoa, 1982
Tabla 3
Valores de nitrógeno básico volátil total (NBVT) en cachama durante el almacenamiento a 0°C y 6°C, en tres lotes diferentes
| Tiempo en dias | (mg N/ 100 g) NBVT | |||||||
| Temperatura 0 C | Temperatura 6 C | |||||||
| LOTE I | LOTE II | LOTE III | - X | LOTE I | LOTE II | LOTE III | - X | |
| 0 | 13,36 | 13,65 | 12,97 | 13,33 | 13,36 | 13,65 | 12,97 | 13,33 |
| 3 | 12,17 | 14,83 | 13,50 | 13,50 | 14,55 | 14,17 | 12,97 | 13,90 |
| 6 | 12,71 | 12,23 | 15,67 | 13,54 | 14,39 | 15,42 | 11,13 | 13,65 |
| 9 | 13,66 | 13,09 | 16,80 | 14,52 | 16,79 | 16,17 | 16,38 | 16,45 |
| 12 | 13,09 | 14,22 | 12,87 | 13,39 | 14,56 | 13,70 | 13,14 | 13,80 |
| 15 | - | 13,72 | 13,85 | 13,79 | 16,97 | 15,47 | 17,28 | 16,57 |
| 18 | 13,03 | 16,16 | 13,95 | 14,38 | 16,80 | 17,50 | 16,00 | 16,77 |
| 21 | 12,65 | 13,16 | 16,94 | 14,25 | ||||
| 24 | 15,50 | 13,02 | 16,06 | 14,86 | ||||
| 27 | 15,89 | 14,35 | 16,23 | 15,49 | ||||
| 30 | 17,85 | 15,47 | 14,14 | 15,82 | ||||
Fuente: Premoli, 1986
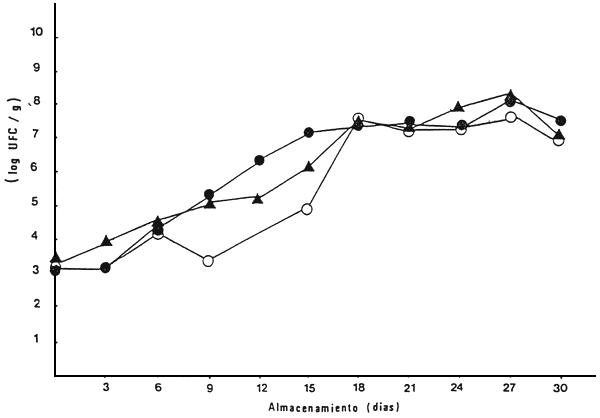
Figura 9 Contaje de aerobios mesófilos en cachama durante el almacenamiento a 0°C, en tres lotes diferentes
| Lote I: | • |
| Lote II: | ▲ |
| Lote III: | ○ |
Fuente: Premoli, 1986
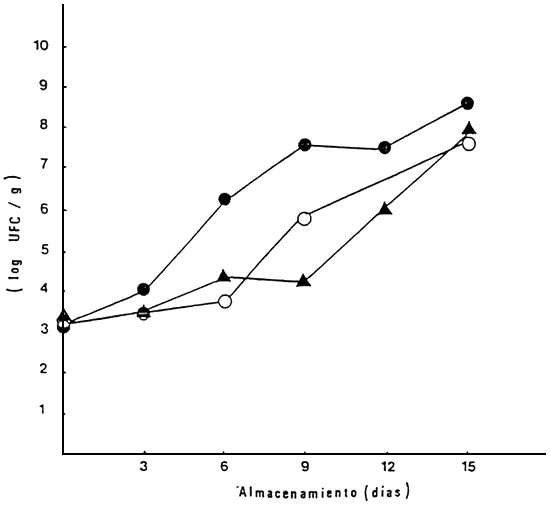
Figura 10 Contaje de aerobios mesófilos en cachama durante el almacenamiento a 6°C, en tres lotes diferentes
| Lote I: | • |
| Lote II: | ▲ |
| Lote III: | ○ |
Fuente: Premoli, 1986
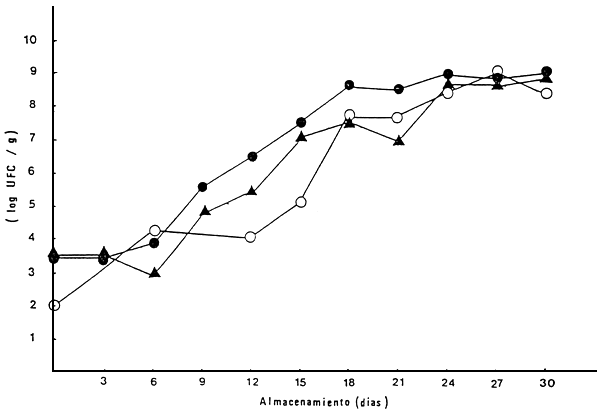
Figura 11 Contaje de psicrófilos totales en cachama durante el almacenamiento a 0°C, en tres lotes diferentes
| Lote I: | • |
| Lote II: | ▲ |
| Lote III: | ○ |
Fuente: Premoli, 1986
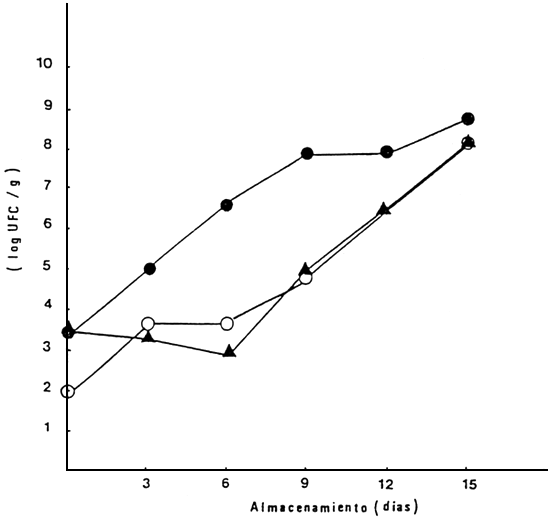
Figura 12 Contaje de psicrófilos totales en cachama durante el almacenamiento a 6°C, en tres lotes diferentes
| Lote I: | • |
| Lote II: | ▲ |
| Lote III: | ○ |
Fuente: Premoli, 1986
Tabla 4
Estimación sensorial en cachama durante el almacenamiento a 0°C
| TIEMPO EN DIAS | OJOS | TEXTURA | OLOR | PIEL | PAREDES DE LA CAVIDAD ABDOMINAL |
| 0–3 | Córnea transparente | Firme y elástica | Típico a pescado fresco | Brillante no decolorada | Rosadas |
| 3–6 | Córnea transparente | Firme y elástica | Típico a pescado fresco | Brillante, no decolorada | Rosadas |
| 6–9 | Córnea ligeramente opaca | Firme y elástica | Típico a pescado fresco | Brillante, no decolorada | Rosadas |
| 9–12 | Córnea ligeramente opaca | Firme y elástica | Típico a pescado fresco | Brillante, no decolorada | Rosadas |
| 12–15 | Córnea ligeramente opaca | Firme y elástica | Típico a pescado fresco | Brillante, no decolorada | Ligeramente decoloradas |
| 15–18 | Córnea ligeramente opaca | Firme y elástica | Típico a pescado fresco | Brillante, ligeramente decolorada | Ligeramente decoloradas |
| 18–21 | Córnea opaca | Firme y elástica | Neutro | Opaca, ligeramente decolorada | Ligeramente decoloradas |
| 21–24 | Córnea opaca, ligeramente sanguinolentos | Firme y elástica | Neutro | Opaca, decolorada | Ligeramente decoloradas |
| 24–27 | Córnea opaca, sanguinolentos | Poco firme | No característico a pescado fresco | Opaca, decolorada | Decoloradas |
| 27–30 | Córnea opaca muy sanguinolentos | Poco firme | No característico a pescado fresco | Opaca y muy decolorada | Decoloradas, limo de color amarillo presente |
Fuente: Premoli, 1986
Tabla 5
Estimación sensorial en cachama durante el almacenamiento a 6°C
| TIEMPO EN DIAS | OJOS | TEXTURA | OLOR | PIEL | PAREDES DE LA CAVIDAD ABDOMINAL |
| 0–3 | Normales, córnea trans- | Firme y elástica | Típico a pescado fresco | Brillante y húmeda | Rosadas |
| 3–6 | Ligeramente hundidos, córnea transparente | Firme y elástica | Típico a pescado fresco | Brillante y semi-húmeda | Rosadas |
| 6–9 | Hundidos, córnea transparente | Firme y elástica | Típico a pescado fresco | Opaca y seca | Rosadas |
| 9–12 | Hundidos | Firme y elástica | Típico a pescado fresco | Opaca y seca | Rosadas |
| 12–15 | Hundidos, ligeramente sanguinolientos | Firme y elástica | Neutro | Opaca y seca | Ligeramente decoloradas |
| 15–18 | Hundidos, sanguinolientos | Poco firme | No característico a pescado fresco. | Opaca y muy seca | Decoloradas, limo amarillento presente. |
Fuente: Premoli, 1986