Dada la importancia que reviste, para la cría del pejerrey, la comprensión de la dinámica del proceso de producción en un estanque abonado orgánicamente, analizaremos dichos procesos especialmente en los aspectos de relevancia en la aplicación práctica. Asímismo en razón de la universal aceptación de microalgas como aditivos alimenticios, describiremos someramente los métodos de producción de microalgas ejemplificados con Spirulina.
Como ha sido expuesto anteriormente el pejerrey se alimenta principalmente de zooplancton prácticamente desde alevino hasta que alcanza las tallas comerciales más usuales. Tal característica ubica al pejerrey entre el reducido grupo de peces de cultivo que se alimentan de organismos situados en los niveles inferiores de la pirámide trófica. Este hecho hace económica su producción en estanques. En efecto basta con una adecuada práctica de abonado con guanos animales para que se produzca una mejora tanto cualitativa como cuantitativa en el alimento vivo que se genera en el estanque, especialmente zooplancton y organismos bentónicos.
En sistemas intensivos de cultivos de organismos acuáticos, en los cuales no se emplean ni abonos orgánicos ni fertilizantes inorgánicos, es usual la utilización de microalgas como aditivos alimentarios en razón de su elevado contenido en ácidos grasos poliinsaturados de cadena larga (PUFA: siglas inglesas de poly unsaturated fatty acids).
Muchos de estos PUFA son esenciales para larvas y alevinos de peces. Asímismo las microalgas constituyen invalorables fuentes naturales de vitaminas y pigmentos. Todas estas razones inciden en el incremento del empleo de microalgas en acuicultura.
Una de las microalgas mas fáciles de cultivar y de las mas empleadas en acuicultura es la cianofícea Spirulina platensis. Las ventajas de mantener un cultivo propio de microalgas residen en la facilidad de acceso a un producto fresco de bajo costo de producción. Los alevinos de pejerrey al igual que lo documentado para otras especies marinas y de aguas salobres, responden muy favorablemente a la inclusión de entre un 1 y un 3% de Spirulina en su dieta.
Si bien es cierto que las microalgas forman asociaciones simbióticas con bacterias a escala de comunidad (por ejemplo estanques de peces), en un cultivo uniespecífico de microalgas es conveniente crear condiciones que desalienten el desarrollo incontrolado de bacterias las cuales de otra manera acabarían con el mismo.
Es posible mantener en producción cultivos de algas en escala suficiente para responder a las demandas de una piscicultura de pejerrey si pueden emplearse los siguientes requisitos:
Asegurar un aporte continuo de los nutrientes requeridos por el alga en cultivo. En general en la bibliografía especializada se describen medios de cultivo y de mantenimiento especialmente formulados para las principales especies de microalgas explotables por el hombre. (Borowitza and Borowitzka 1988).
La temperatura diurna se mantendrá lo más cercana posible al óptimo demandado por la especie en cultivo. Es deseable que, como sucede en regiones semiáridas, el enfriamiento nocturno permita un descenso considerable en la temperatura del cultivo a fin de bajar la tasa respiratoria y minimizar las pérdidas de producción (que pueden llegar hasta un 35%).
En el sistema se debe asegurar el tiempo necesario de exposición a la luz de cada una de las células en cultivo. Este objetivo puede cumplirse en parte mediante la agitación mecánica del medio.
La turbulencia generadas durante la agitación del medio favorecen también la difusión hacia la atmósfera del oxígeno en exceso producido durante las horas de luz. Las concentraciones muy elevadas de oxígeno producen efectos inhibitorios (fotoxidación) sobre la fotosíntesis y el crecimiento de las algas (Vonshak y Richmond, 1988).
Es necesaria la existencia de un razonable aislamiento del cultivo del medio externo con el fin de minimizar los riesgos de contaminación con bacterias, polvo, insectos, etc.
Mantener el cultivo dentro de los rangos de parámetros físicos y químicos particulares para la especie en cultivo. De estos además del nivel de nutrientes (se agregan en exceso) la temperatura mencionada anteriormente y el pH son los que revisten mayor importancia. Se debe prever la posibilidad de contar con un rápido burbujeo de gas carbónico (innecesario en el caso de Spirulina).
En lo que respecta a los parámetros biológicos, el cultivo debe mantenerse dentro de lo posible en el rango de condiciones que definen un estado estacionario (Vonshack, A y A. Richmond, 1988) y estar atento a la proliferación de bacterias, protozoarios y rotíferos. Ciertos constituyentes bioquímicos de las microalgas pueden ser empleados como estimadores de biomasa, entre ellos la determinación de la clorofila a y proteínas, los cuales se agregan a la determinación de peso seco.
Existen laboratorios especializados que se encargan de proveer cultivos puros de microalgas destinados a iniciar cultivos en mayor escala. Vonshack, A y A. Richmond 1988, brinda una lista bastante completa de tales laboratorios.
Para el caso de producciones experimentales de alevinos de pejerrey (a escala menor que la comercial) nos basta con una batería de mangas de polietileno (38 cm de diámetro) con unos 15 l de cultivo de Spirulina cada una, de manera de totalizar unos 90 l de cultivo para cada una de las cuatro semanas del mes.
Semanalmente se cosecha el 50% del volumen (unos 45 l); contenido que es filtrado sobre tamiz de 20 micrones; el 50% restante es empleado para iniciar un nuevo cultivo. Las algas cosechadas se acidifican ligeramente (ácido sulfúrico al 3%) y se disponen en capas de 1 a 3 mm. de espesor para ser deshidratadas. El proceso de deshidratación (hasta un contenido húmedo menor al 5%) se puede cumplir ya sea al sol o en un horno regulado a 40°C. Las escamas deshidratadas así obtenidas son molidas hasta fino polvo en un molinillo doméstico. El producto resultante (listo para ser empleado como aditivo en la dieta de peces) se almacena en frascos de vidrio oscuro en un lugar fresco y seco.
Dado que la agitación del medio se produce mediante la acción del aire y que éste es provisto por aireadores de acuario de bajo consumo (9 watts), en este caso el mayor costo de producción en el sistema (US$ 13/kg en peso seco de Spirulina producida) está representado por el consumo de sales que integran el medio de cultivo.
Los grupos integrantes del zooplancton cuyo cultivo es conveniente para ser destinados a la cría de alevinos y juveniles de pejerrey son: el rotífero Brachionus plicatilis y cladóceros pertenecientes al género Daphnia o Ceriodaphnia. Seguidamente se analizan los fundamentos de sus respectivos métodos de cultivo y la manera en que se integran a la producción masiva del pejerrey.
Los cladóceros son microcrustáceos filtradores de pequeño tamaño que en el caso del género Daphnia varía para los ejemplares adultos entre 1 y 3 mm de longitud. Las características de los cladóceros que los hacen aptos para su empleo en acuicultura derivan de sus múltiples ventajas: pequeño tamaño y ciclo de vida relativamente corto dado que maduran y se reproducen en pocos días, de manera que se cuenta en un tiempo reducido con un número importante de individuos. Debido a que su reproducción puede ser limitada a la producción de hembras por partenogénesis, es posible mantener cultivos con constancia génica. A las anteriores características debemos agregar su valor nutritivo: alrededor de 60% de contenido protéico constituido por proteínas de elevada calidad biológica.
Algunos datos sobre la biología de Daphnia (Anderson y Jenkins, 1942; Hebert, 1978) se resumen a continuación:
Longevidad: entre 910 y 1 030 horas (aproximadamente entre 38 y 43 días)
Alimentación: Daphnia se alimenta de bacterias, hongos, protozoarios y desechos orgánicos. El alimento es filtrado y concentrado mediante la acción de conjuntos de sedas situados en los apéndices toráxicos. Aunque el tamaño promedio de las partículas ingeridas se sitúa entre 1 y 60 u se debe hacer la salvedad que el mismo aumenta con el incremento en la talla del cladócero.
Varios autores han encontrado que los detritos (encapsulados por bacterias) se constituyen en el principal componente de la dieta de Daphnia (Nadin Hurley & Duncan, 1976; Tappa, 1965) siendo las microalgas importantes sólo durante el período de floraciones (“blooms”) (Nadin Hurley & Duncan, 1976).
Aquí cabe recordar el concepto de detrito el cual engloba a todo tipo de material biogénico en varias etapas de descomposición microbiana (Darnell, 1964). Algunos de los métodos más exitosos y antiguos en acuicultura emplean guanos animales los cuales por la acción de los microorganismos del agua se convierten en detritos, incrementándose sustancialmente la productividad natural del ambiente.
Los guanos animales (vacunos y de aves de corral) constituyen alimentos de muy pobre calidad en el momento en que ingresan al estanque de cultivo. Allí se transforma en un alimento de excelente calidad. Como explicación (Schroeder 1987) se deben tener en cuenta algunos elementos total o parcialmente dilucidados del proceso mediante el cual se produce una sustancial mejora en la calidad nutritiva de los detritos.
En efecto el proceso microbiano tiene lugar en su mayor parte bajo las condiciones anaeróbicas existentes a nivel del sedimento; en este ambiente anóxico la fermentación de la materia orgánica que integra los detritos da como resultado que gran parte del carbón original sea convertido en compuestos orgánicos de bajo peso molecular, existiendo la posibilidad cierta de que los mismos representen un alimento de muy buena calidad para los animales que los ingieran usualmente.
Ejemplos paralelos de procesos en condiciones comparables se dan en el ensilado y en el rumen; en ambos casos también hay producción de materia orgánica en forma de compuestos carbonosos de bajo peso molecular.
Se puede agregar que, al comparar el efecto de la aireación del medio en cultivos de Daphnia, realizados en estanques de 3 000 l empleando guano vacuno, se registran diferencias menores a favor de la aireación en la biomasa diaria a lo largo de un período de tres meses. No obstante en ciertos aspectos la aireación parece ejercer efectos negativos dado que la fecundidad media de Daphnia es significativamente mayor en los estanques que no reciben aireación (Reartes y Donatti, aun no publicado, Tabla 6). Esta contradicción entre una mayor fecundidad en un ambiente más desfavorable (más pobre en oxígeno disuelto) sólo puede ser explicada por la producción en el caso del estanque no aireado, de alimento de mejor calidad.
Tabla 6: Fecundidad promedio en Daphnia longispina en estanques con y sin aireación continua. (Para cada estanque: promedio de contajes sobre 450 hembras, repatido en 9 muestreos semanales) (Donatti, O. y J. Reartes, aún no publicado)
| Tratamiento | Tanque | Fecundidad promedio | DS |
| aire | V1 P2 | 3.36 3.46 | 1.2 1.9 |
| s/aire | V2 P3 | 4.52 6.45 | 1.8 2.8 |
De todas maneras, dados los efectos contrapuestos que la predominancia de clorofíceas ejercen sobre los cultivos de cladóceros, la mejor alternativa parece ser el desalentar la proliferación de este grupo de algas en los cultivos de cladóceros. En experiencias del autor, abonos ricos en taninos como el estiércol vacuno, empleados a las tasas habituales (10–12 g/l día expresado como peso seco) raramente permiten la predominancia de clorofítas. Las clorófitas aparecen solamente en los cultivos envejecidos a los cuales no se les ha agregado guano de vacuno durante un tiempo prolongado (algunos meses). Al respecto ha sido establecido (Margalef 1983) que las materias húmicas generan condiciones desfavorables para ciertas microalgas: existe una relación inversa entre producción primaria y cantidad de materia húmica disuelta.
En cuanto a la acción específica de los taninos es probable que la misma sea debida a su condición de modificadores ambientales, es decir compuestos que influencian la tasa o la sincronía de la actividad microbiana sobre otros recursos. (Anderson, J. 1987), pp: 123–147).
El rol de los microrganismos en la alimentación de Daphnia fue investigado por Tezuka (1974) en un cuidadoso experimento durante el cual se brindó a los cladóceros dietas constituidas por el protozoario Paramecium caudatum (tamaño promedio 70 × 220 u) o de una combinación de éste con bacterias. Se encontró que el ritmo de alimentación de Daphnias adultas era independiente de la concentración del alimento (Paramecium). sugiriendo que D.pulex preda activamente sobre los protozoarios. Pero si bien los adultos pueden alimentarse solamente de protozoarios, el tamaño considerable de éstos impide que los estadíos juveniles del cladócero puedan ingerirlos. Anteriormente había sido demostrada la incapacidad de Daphnia pulex para reproducirse cuando es criada sobre cultivos bacterianos puros (Tezuka, 1971 citado en Tezuka 1974) En consecuencia el autor probó una dieta mixta consistente en P. caudatum y bacterias. Se concluye que D. pulex puede crecer y reproducirse durante varias generaciones cuando es alimentada con una dieta consistente en una mezcla de P. caudatum y bacterias. La capacidad de Daphnia para ingerir presas del tamaño de P. caudatum podría explicarse debido a que estos protozoarios son muy plásticos y por ende susceptibles de sufrir deformaciones las cuales facilitarían su ingesta.
Reproducción: Las especies del género Daphnia se reproducen ya sea mediante partenogénesis cíclica u obligada y las poblaciones ordinariamente están constituidas íntegramente de hembras. A partir del quinto estadío producen una nueva camada después de cada muda. Los huevos se depositan y desarrollan dentro de la cámara de cría; de aquí las crías se liberan como versiones en miniatura de los adultos. El número de crías por camada varía entre 1 y 300 y depende del tamaño del individuo y de la alimentación del mismo. El número máximo de crías por camada observado para Daphnia cephalata (long del caparazón: 5.5 mm) llega hasta 295 individuos, mientras que para D. magna (long. 4.1 mm) es de 110 individuos por camada.
El número de huevos producido por hembra adulta depende de la ingesta alimenticia. Si esta ingesta sólo es suficiente para balancear los requerimientos energéticos, no habrá producción de huevos. Individuos que no se reproducen o que lo hacen a tasas muy reducidas son frecuentes en cultivos de laboratorios en los cuales la cantidad de alimento disponible está limitada por alguna cirscunstancia.
En dos especies del género Daphnia (D. cephalata y D. middendorffiana) hay una partenogénesis obligatoria. Dichas especies producen efipias que no necesitan ser fertilizadas para su desarrollo y hay una ausencia de machos durante la formación de efipias.
En todas las especies de Daphnia las efipias juegan un importante rol tanto en la colonización de nuevos habitats como en el repoblamiento del mismo habitat luego que las condiciones desfavorables que les dieron origen han desaparecido.
De manera similar a lo que sucede con otros organismos existen numerosos sistemas de cultivo para cladóceros especialmente de especies pertenecientes a los géneros Daphnia y Moina que parecen ser los más aptos al respecto.
En un principio y en pequeña escala se empleaban concentrados de algas, levaduras y/o protozoarios para la alimentación de los cladóceros en cultivo (Ivleva, 1969). Los inconvenientes y restricciones de algunos de estos productos han sido analizados anteriormente. Sin embargo poco a poco se fueron introduciendo otros materiales, especialmente desechos agrícolas (Masters, 1970; Reartes, 1983).
Los desechos agrícolas tales como salvados de cereales y guanos de animales de granja han evidenciado una potencialidad aún no suficientemente desarrollada en la producción masiva de zooplancton. Así en experiencias piloto diseñadas con la finalidad de cotejar la influencia de salvado de arroz y agua de lavado de porquerizas en la producción masiva de Daphnia magna (Reartes, 1983) se alcanzó una densidad máxima de 11 950 indiv/l en algo más de dos meses (Figura 2), para lo cual se emplearon 3.5 grs de salvado de arroz por día y por litro de cultivo (Figura 3).
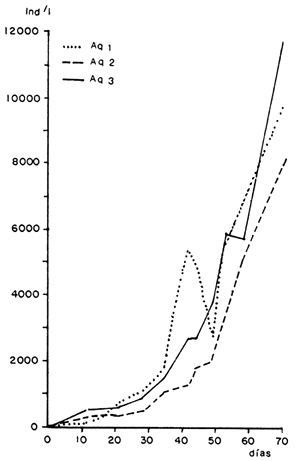
Figura 2. Evolución de la intensidad de D. magna. Extraído de Reartes, 1983.
El método que empleamos para cultivar y cosechar Cladóceros (Daphnia) destinados a la alimentación del pejerrey se basa en los siguientes requisitos:
Reciclaje de un desecho, especialmente estiércol vacuno, mediante su incorporación al medio de cultivo. Normalmente no se utilizan los alimentos experimentados en condiciones de laboratorio debido a que el volumen de los cultivos de cladóceros alcanza cierta envergadura, el empleo de alguno de los alimentos ad-hoc ensayados bajo dichas condiciones, puede tornarse económicamente prohibitivo.
Una vez que la calidad del medio ha evolucionado y el mismo puede calificarse como biológicamente activo, se procede al repicaje con cladóceros provenientes de otros cultivos. Los indicadores de calidad son tanto de naturaleza química (niveles de amonio, nitritos, nitratos, sulfídrico, oxígeno y taninos entre otros) como físico-química (pH, potencial redox) y biológica (DBO, recuentos de colonias bacterianas, etc). Con el tiempo, al adquirir progresivamente experiencia, la práctica del acuicultor reemplazará a la necesidad de realizar muchas de las determinaciones anteriores de manera sistemática.
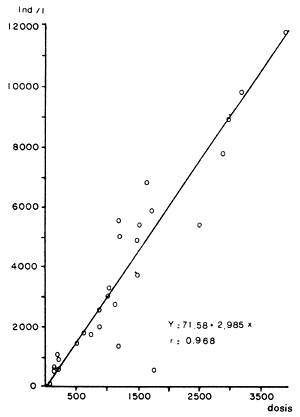
Figura 3. Relación dosis diaria de salvado/densidad D. magna. Extraído de Reartes, 1983.
Dado que, tal como hemos analizado previamente, las clorófitas cuando se las considera como grupo producen resultados aleatorios sobre los cultivos de cladóceros, es esencial desalentar vía manejo del medio de cultivo la predominancia de este grupo de algas, lo cual, de acuerdo con nuestra experiencia, es perfectamente factible aun trabajando a escala considerable (tanques de 45 metro cubicos por ej.)
Dada la relevancia que adquieren los detritos y las bacterias en la alimentación de daphnidos es muy importante mantener una adecuada concentración de detritos mediante su incorporación frecuente, lo ideal es hacerlo diariamente, dado que con aplicaciones frecuentes se estabiliza la población de microrganismos evitándose los picos de consumo de oxígeno por parte de bacterias y protozoarios.
Mediante el empleo de estiércol vacuno, para tanques de 3 000 lts cuya agua se mantiene a una temperatura promedio de entre 17.5 y 19.5°C, se cosechan cotidianamente una media de entre 12 y 16 g (peso húmedo, con 92% de agua) de cladóceros sin que la población se vea afectada. La cantidad anterior corresponde a la cosecha diaria proveniente del filtrado de 1 m3 del agua del tanque de cultivo. (Tabla 7). Los cladóceros recogidos pueden ser filtrados por tamices de distintas aberturas de malla para obtener alimento adecuado para las diversas tallas de alevinos de pejerrey. Si bien los estanques anteriormente mencionados se encuentran bajo invernadero, dado que la demanda de alimento vivo se produce en primavera, las tasas anteriores no son afectadas sensiblemente cuando se aplican a cultivos externos en tanques de 45 metros cúbicos en los cuales se obtienen valores similares en peso fresco de zooplancton (Reartes, 1987).
Tabla 7: Parámetros ambientales y biomasa de zooplancton en tanques con (P2 y V1) y sin (P3 y V2) aireación permanente Las cifras representan promedios de 18 determinaciones y abarcan el período 18/8/89 al 18/9/89. (Donatti y Reartes, aún no publicado)
| Estanq. No | Temperatura °C | Oxig mg/l | NV | pH | Ac.Tan *mg/l | Biom. gr/m3 (peso húmed.) | ||
| S | F | S | F | S | * | * | ||
| 18.1 | 18.1 | 4.3 | 4.1 | -96.8 | 8.40 | 7.2 | 15.32 | |
| P2 | 9.06 | 7.5 | ||||||
| 18.1 | 18.1 | 5.3 | 5.2 | -98.1 | 8.44 | --- | 15.90 | |
| V1 | 8.75 | |||||||
| 19.5 | 17.9 | 2.5 | 2.2 | -123 | 8.35 | 7.0 | 12.90 | |
| P3 | 9.56 | 8.4 | ||||||
| 18.1 | 17.5 | 1.04 | 0.4 | -117 | 8.94 | --- | 16.67 | |
| V2 | 9.17 | |||||||
Los rotíferos pertenecen al Phylum Aschelminthes, Clase Rotatoria, Orden Monogonta y Familia Brachionoidea. B. plicatilis es un organismo de distribución cosmopolita.
Taxónomos rusos reconocen 6 subespecies. Los acuicultores japoneses en cambio reconocen 2 variedades de relevancia para la acuicultura: tipo pequeño S, 160 micrones de talla media) y tipo grande, L, 239 micrones de talla media. En Europa se agrega una tercera variedad tipo superpequeño, SS, de 140 micrones de talla media).
Normalmente la reproducción de B. plicatilis es partenogenética, pero también existe la reproducción sexual la cual se da bajo particulares condiciones. Las hembras producen huevos no fecundados envueltos por un delgado corion. De dichos huevos nacen hembras amícticas. Este es un mecanismo de multiplicación sumamente rápido: la eclosión de los huevos (incubados internamente) puede demandar no más de 6 horas a 30°C (de 0.5 a 1 día a 25 grados). El tiempo que toma a una larva convertirse en adulta varía entre 0.5 y 1.5 días a 25° de temperatura. Las hembras adultas pueden poner huevos con intervalos que también son dependientes de la temperatura ambiente: intervalos de 24 h a 15 grados y de 6 horas a 30 grados. A 25° la vida promedio de B. plicatilis se sitúa entre 3.4 y 4.4 días lapso durante el cual llega a poner unos 10 huevos.
Los cistos son acarreados y dispersados fácilmente por el viento, agua o adheridos al plumaje de las aves. B. plicatilis es un organismo cosmopolita encontrándoselo tanto en estuarios y ambientes marinos costeros como en lagos y lagunas saladas. Se desenvuelve bien en una amplia gama de condiciones ambientales:
Los métodos de cultivo pueden estar comprendidos en diversas modalidades: extensivos en tanques de más de 50m3, intensivos en tanques pequeños. Otra categoría puede ser el tipo batch según el cual una vez alcanzada la densidad esperada se realiza la cosecha total. También pueden realizarse cosechas cotidianas con agregado de medio fresco, teniendo como objetivo el mantener una concentración determinada de rotíferos.
El tipo más avanzado responde al modelo del quemostato. El alimento es adicionado en forma continua a medida que se va realizando la cosecha. Es también el método más eficiente. El mejor alimento son las microalgas vivas, no obstante lo cual también se utilizan las levadura enriquecidas en ácidos grasos poliinsaturados de cadena larga.
En China se emplean grandes estanques de entre 1 000 y 2 000 m2 los cuales son llenados con agua al 18 por mil de salinidad, abonados e inoculados. El llenado y abonado se realiza en la época de reproducción de peces y camarones
Las ventajas que reporta el empleo de rotíferos como alimento inicial de larvas de pejerrey (y de otros peces) derivan del hecho de ser un alimento vivo de pequeño tamaño, fácil de producir y cosechar masivamente. Además de poseer el tamaño adecuado y constituir un alimento de excelente calidad biológica, los rotíferos proveen de enzimas proteolíticas de las cuales el aún rudimentario sistema digestivo de las larvas de peces puede carecer en esta temprana etapa, con lo cual ayudan a la propia digestión del rotífero y de otros alimentos. Debido a que es un filtrador no selectivo se emplea para bioencapsular desde antibióticos hasta aditivos alimenticios. Su producción en grandes cantidades es más barata y menos engorrosa que la incubación masiva de cantidades importantes de cistos de artemia.