En millieu artificiel, fermé (l'étang de pisciculture) le C.lazera ne se reproduit, à quelques exception prés, pas spontanément. Le cycle de maturation se développe normalement jusqu'au stade dormant, mais la maturation finale, l'ovulation et la ponte ne se produisent pas.
C'est dans des cas identiques que depuis des siecles l'homme est intervenu dans le processus de reproduction. Ces interventions vont depuis le ramassage des oeufs sauvages fécondés, et plus tard avec des traitements hormonaux en étangs, jusqu'a la ponte, elle même réalisée artificiellement, suivie de la fécondation, l'éclosion, et l'alevinage contrôlés.
Les reproductions semi-naturelles en étangs, où l'on simule les conditions d'un environnement naturel ainsi que les reproductions induites en étangs, où les femelles sont traitées avec des hormones du cycle de la reproduction naturelle ou des analogues synthétiques ont donné lieu a des pontes entiéres, mais souvent partielles (Nugent, 1975; pham et Raugel, 1975; Micha, 1976; Hogen - doorn, 1979; Christensen, 1982). L'élevage des larves en étangs, avec ou sans reproducteurs, n'a pas abouti à des productions de masse.
La reproduction induite en bac en béton, comme appliquée en République Centrafricaine et en Côte d'Ivoire (Micha, 1973, 1976; Jocque, 1975; Pham, 1975) s'est révélée délicate à réaliser (difficulté du choix du mâle). Toutefois dans des conditions d'alevinage à l'abri des repro ducteurs, la mortalité enregistrée pendant les premiérs 4 à 5 jours est trés élevée. De ces travaux il ressort que, quelle que soit la technique utilisée les résultats sont trés inégaux. Les meilleures récoltes enregistrées, pourtant intéressantes, furent de l'ordre de 400 à 1000 ind/are.
Ce document présente une méthode de propagation artificielle contrôlée a partir de l'obtention des oeufs juqu'à l'élevage des alevins. Les avantages de cette methode sont les suivants:
obtention de meilleurs taux de fécondation et d'éclosion,
protection optimale contre les ennemis des oeufs et des poissons et contre les conditions défavorables de l'environnement,
création des conditions optimales de survie et de croissance.
A quel stade du cycle de reproduction, l'homme peut-il intervenir pour la réaliser? La figure 14 indique les stades de mâturation des femelles sur lesquelles, il a été possible d'intervenir en stimulant la mâturation finale et l'ovulation chez C.lazera.
Les manipulations des paramétres environnementaux (stade 1 du schéma), en particulier la simulation des facteurs naturels et chimiques du milieu ont déclenché chez les C.lazera eux-mêmes la secretion des hormones quicommandent la mâturation finale des ovaires.
En milieu artificiel, à l'abris des stimuli d'environnementaux, les gonadotrophines, et les corticostéroides (les stades 2 et 3), par ordre d'importance, ont été utilisées avec succés. L'administration des extraits de glandes pituitaires (ou hypophysation) de poissons donneurs (carpe ou C.lazera) est la technique la plus répandue, à l'heure actuelle. Une gonadotrophine de mammifère, la gonadotropine chorionique humaine (HCG), extraite de l'urine des femmes enceintes est également utilisés. Tous ces produits sont utilisés avec succès pour déclencher la mâturation finale et l'ovulation.
Le desoxycorticosterone acétate (Doca), un corticostéroide de synthése, est la substance employée par des chercheurs pour des premiers essais de reproduction induite chez le C.lazera. Le Doca provoque uniquement la mâturation finale; la rupture folliculaire est obtenue par pression manuelle des flancs.
Il a été possible d'intervenir dans la chaîne de reproduction à un stade précédant celui de l'application de la gonadotrophine (stade 4), grace à un composé synthétique, l'hormone libérant l'hormone luteinisante (LH-RH) et plus recemment les analogues de celle-ci (LRH-a). En Chine, où les travaux sur ces analogues ont été poussé tres loin, le LRH-a est actuellement utilisé pour la provocation de la reproduction. Ce groupe de produits n'est pas encore utilisé chez les C.lazera.
Les stéroides sexuels (stadè 5 du schéma) qui ont réussi l'induction d'ovulation chez d'autres espéces sont très rares, et ce groupe de produits ne semble pas avoir une grande importance pour l'éleveur.
La propagation artificielle de C.lazera se présente comme un enchaînement d'activités qui sont similaires à celles de la reproduction naturelle. Ces activités sont énumerées comme suit:
sélection de géniteurs à partir d'une population sauvage (pendant la descente des eaux) ou d'un peuplement élevé en étangs de pisciculture.
maitient des géniteurs en écloserie.
propagation de la mâturation finale et/ou ovulation.
expulsion manuelle des oeufs.
dissection d'un mâle pour obtenir la laitance.
fécondation artificielle.
incubation et éclosion des oeufs.
élevage des larves et alevins.
A) L'importance du stock de reproducteurs femelles d'une écloserie est déterminée par les facteurs suivants:
- Poids corporel des reproducteurs. Le poids corporel moyen recommandé pour les reproducteurs afin d'obtenir une quantité suffisante d'ovules et afin de faciliter la manutention, ent de 500 à 1000 g.
- Age des reproducteurs. Il est recommandé de maintenir à l'intérieur de l'écloserie, uniquement le stock minimum de géniteurs nécessaires et les jeunes poissons. Il est donc préferable de constituer le stock de géniteurs avec des poissons élevés en étangs, ou de capturer des géniteurs sauvages. L'àge de màturation est atteint dans des conditions tropicales à 10–12 mois (Micha 1973). Cet âge de mâturation, varie suivant la température et la ration alimentaire de ces poissons (Richter e.a., 1982)
- Capacité d'incubation de l'écloserie. A l'heure actuelle on dispose de 4 incubateurs (ou bac d'éclosion) de type californien. La capacité de l'ensemble de ces bacs est de 800 à 1000 g d'oeufs. Cette quantité d'oeufs peut être produite par 12 à 36 reproducteurs de 500 g (voir section 4).
- Durée d'alevinage. Bien que la durée d'alevinage varie en fonctior de la température, il faut en moyenne 5-7 semaines (mars-septembre) et juqu'a 12 semaines (octobre-fevrier) pour obtenir des alevins d'une taille d'environ 1 g. Une production intensive (un cycle de reproduction à la fois) nécessite 10 cycles de reproduction artificielle par an, ou 20 à 25 par an pour une reproduction surintensive (2 à 3 groupes d'âge différents à la fois)
- Reproduction artificielle répetée. Le même géniteur tenu en écloserie depuis plus d'une année, peut être hypophysé chaque 6 à 8 semaines tout au long de l'année. La quantité d'ovules optenues représente 10 à 15 pour cent du poids corporel des femelles (mars-octobre). Du mois de novembre jusqu'au mois de février on obtient une fécondité relative de 5 à 10 pour cent. (voir section 5).
- Pertes des reproducteurs et/ou des larves/ alevins. Les facteurs essentiels de l'élevage de géniteurs et leur manutention, sont décrits en détail dans la section 4.3.5. D'importantes pertes d'alevins peuvent être provoquées par de mauvaises conditions d'élevage, des maladies, et/ou une gestion inadéquate (voir document technique No 21).
B) Bimportance du stock de géniteurs mâles dépend des facteurs suivants:
- Provenance du stock. Il est recommandé afin d'éliminer toute possibilité de consanguinite, de constituer les stocks de mâles, avec uniquement des poissons sauvages.
- Nombre de mâles requis par propagation. Chaque reproduction artificielle necessite le sacrifice de un, ou au maximum deux mâles, indépendamment de la saison (experience personelle).
Etant donné tous ces facteurs, et en respectant une marge de sécurité importante, on recommande de tenir à l'écloserie un stock de géniteurs composé de:
± 150 femelles, utilisées pour la propagation artificielle (bac 22).
± 150 mâles, utilisés pour la propagation artificielle (bac 21).
± 150 femelles, stock de géniteurs en acclimatation (bac 20).
± 150 mâles, stock de géniteurs en acclimatation (bac 19).
Contrairement à la situation en étang, la présence des sezes opposés n'a apparemment pas un effet positif sur le dévelopment des gonades en milieu contrôlé d'une écloserie. Ainsi, il est préférable pour des raisons pratiques de ne pas mélanger les deux sexes opposés.
Il est indispensable de maintenir un stock d'appui d'environ 200 mâles et 200 femelles en étang, (L 11).
a) Géniteurs sauvages.
En Centrafrique la capture des C.lazera dans leur habitat naturel est aisée dans le bassin du Chari (préfecture Bamingui-Bangoran et Vakaga) en particulier pendant la descente des eaux. La présence de Clarias lazera dans le bassin de l'Oubangui est beaucoup moins fréquente. On y trouve plutôt des éspèces de plus petite taille comme Clarias bythupogon et Clarias submarginatus (Micha 1973).
Les poissons capturés doivent être manipulés avec soin, et s'ils sont trop agités, les tranquiliser avec du phenoxyethanol (0,3 ml/l).
Environ 100 kg de poisson peuvent être transportés avec un pick-up (landrover ou toyota) équipé de deux transporteurs fabriqués à partir d'un fût de plastique de 200 1. Ces transporteurs sont décrits en détail dans la note technique No 17 (Mievis, 1981). De cette façon on peut transporter les Clarias pendant plusieurs jours, grâce à leur organe respiratoire accessoire (fig. 10).
b) Géniteurs élevés en étangs.
Il est plus facile et moins onéreux, d'élever des géniteurs en étangs. C'est ainsi que l'on obtient en général nos reproducteurs femelles. Les poissons sont éleves à une densité de 2 à 5/m2, après quoi on peut sélectionner les géniteurs d'environ 500 g apres 8 à 12 mois. Il est necessaire de choisir les géniteurs d'une taille proche à la moyenne. Les plus gros sujets ont en général des organes sexuels peu développés. Un deuxiéme critére, valable uniquement pendant la saison de reproduction naturelle, est le ballonnement de l'abdomen chez la femelle (présence des ovaires bien développées et donc le rapport gono-somatique élevé).
Chaque géniteur sauvage capturé dans le milieu naturel ou en étang doit être desinfecté des son entrée à l'écloserie, pendant deux jours consécutifs, avec 25 ppm de formuldéhyde, et 0,15 mg/1 de vet de malachite pendant 6 heures. Un traitement antibactérien (préventif), deux heuren par jour de 10 ppm de furaltadone (= 10 mg/l) est conseillé pendant une durée de 4 à 6 jours.
La qualité et la quantité des gametes sexuels sont des facteurs essentiels pour la réussite de toute propagation artificielle. Il est donc évident que cette méthode de reproduction requiert des conditions d'élevage de géniteurs optimales afin d'assurer la bonne santé des reproducteurs et de diminuer les risques de maladies. Une production suffisante d'ovules et de sperme, tous les deux en parfait tat de sante, est garantie quand ces conditions préalables sont assurées.
Les géniteurs sont maintenus dans des bacs à
reproducteurs (fig. 3). Le trop plein est placé de façon
à ce que l'on obtienne une large lame d'eau (environ 40 cm)
ce qui correspond à un contenu en eau de 800 à 1000 litres
Peuplement: Chaque bac peut être peuplé avec 150 à 200
géniteurs (charge biotique maximale 150 kg) à condition
que le débit d'eau soit adapté à la charge. La teneur
en oxygéne de l'eau à la sortie du bac doit être au dessus
de 3–4 mg/1. (Condition préalable à une bonne croissance
et un developpement optimal des gonades).
Débit/d'oxygene: La consommation d'oxygéne et par conséquent
le débit en eau depend de la quantité d'alimentation
et de nouveau la température. La meilleure façon de
déterminer ou contrôler le débit en eau est de mesurer
le taux d'oxygène de l'effluent. Le débit de chaque
bac doit être ajusté apres chaque changement de la charge
biotique et du niveau d'alimentation.
Une indication du débit en eau optimal peut être calculée avec la formule utilisée pour le calcul de la charge biotique des truites (Willoughby, 1968):
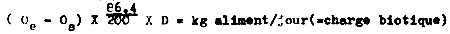
Oe= taux d'oxygène a l'entrée du bac
Os= taux d'oxygène à la sortie du bac
86.4= m3 d'eau par jour avec un débit de 1 1/sec
200= grammes d'oxygéne nécessaire pour digérer
1 kg d'aliment
D= débit en 1/sec
L'utilisation de cette formule nécessite les hypotheses suivantes, avant de pouvoir mener à terme ce calcul théorique:
50 pour cent de l'oxygène consommée provient de l'air (adultes).
Un niveau d'alimentation de 1 pour cent du poids corporel est optimal. Le niveau d'aliment qui assure une conversion la plus efficace. Ne pas confondre avec la croissance optimale qui demande un niveau d'aliment bien plus élevé.
La teneur en oxygène de l'affluent est de 8 mg/l.
La teneur en oxygène de l'effluent est de 3 mg/l.
Dans le tableau 1 se trouvent les debits en eau requis pour des differentes charges biotiques de géniteurs. Ce tableau ne peut être utilisé, que comme une indication pratique qui doit toujours être completée par des vérifications du taux d'oxygène de l'eau à la sortie des bacs.
| kg poisson/bac | débit (1/min) |
| 50–70 | 10* |
| 90 | 13 |
| 110 | 15 |
| 130 | 18 |
| 150 | 21 |
* Un minimum de 10 1/m esr calculé afin d'obtenir au moinsun renouvellement d'eau chaque 90 minutes.
Température: La température mensuelle minimum et maximum de l'eau à l'écloserie est de 24,I et 26,3 °C réspectivement (moyenne sur 3 ans). Cette température est trés proche de la température optimale pour le développement gonadal de C.lazera de 25 °C signalée par Richter (1982). Les fluctuations mensuelles entre les températures extrêmes n'excèdent pas 3 à 4 °C. Pour conclure on peut dire que, à l'exception d'une baisse importante de température durant le mois de janvier (max.± 24,0 °C, min.± 20,0 °C), la température de l'eau est assez stable et favorable à un bon développement des organes sexuels.
Lumière: Les bacs sont pouvus de deux cadres, un fixe et l'autre amovible. Ces cadres sont revêtus d'un grillage à poule pour éviter la fuite des géniteurs, et ensuite ils sont recouverts d'une feuille de plastique noire, impénétrable à la lumiere, afin de créer une obscurité comparable à celle de l'habitat naturel de C.lazera. Un tube néon placé à environ 40 cm au-dessus du bac, et à environ 1 mètre du trop-plein, a pour fonctions:
de faire fuir les poissons en bonne santé.
d'identifier les poissons malades.
de vérifier la propreté du lac (restes d'aliment, excréments, végétation sur les bords du bac).
de vérifier l'alimentation.
Tranquillité: Des pertubations et des actions brutales fréquentes, influencent la croissance et le développement des gonades. En outre on sait que le stress affaiblit les poissons il les rend également plus sensible aux facteurs environnementaux qui peuvent provoquer des maladies (bactéries, parasites, malnutrition, température extrême etc.) Il est donc d'une grande importance que les géniteurs soient maintenus dans un milieu calme à l'abri de toutes les pertubations.
Qualité d'eau: La qualité de l'eau à la sortie du bac de décantation, sa température et sa teneur en oxygéne sont déjà décrites ci-avant. La qualité chimique de l'eau durant l'élevage, est un autre facteur important. Elle est essentiellement causée par la dégradation des résidus de la nourriture non ingerée, et des résidus métaboliques du poisson (matières fécales et urine). Les matières solides sont éliminées grâce à un système d'autonettoyage des bacs, facilité par la forme sphérique du fond et par la pente légère orientée vers la crépineécran (une plaque perforée en inox, diamètres des trous 5 mm) placée postérieurement dans le fond du bac (fig. 3). Les teneurs élevées en matières chimiques dont l'amoniac (NH3) ou l'amonium (NH4) et le nitrite (NO2) sont les plus importants, sont évitées avec le renouvellement élevé de l'eau (voir tableau 1) l'amonium, forme dominante pour un PH 6–7, n'est pas toxique.
Les procedures suivantes sont recommandées pour garantir une bonne qualité d'eau.
assurer le bon fonctionnement du bac de décantation (3.5.2.)
ne jamais suralimenter (4.3.4.), il est à la limite préférable de sous-alimenter que de suralimenter.
chaque matin enlever le trop-plein, le nettoyer avec la brosse et échanger 25 à 30 pour cent d'eau (une lame d'eau d'environ 10 à 15 cm). De cette façon on élimine les résidus de nourriture et les matières fécales du fond du bac et celles accumulées en dessous de la crépine-écran.
Une fois par mois, vider 50–60 pour cent d'eau, jamais plus et nettoyer avec une brosse l'intérieur du bac et la crépine. Ensuite remplir le bac et échanger de nouveau 50 pour cent d'eau afin de bien rinçer le bac.
Hygiéne: Chaque couple de bac a son propre matériel tel que brosse, filets, épuisettes, seaux, tuyau etc… Tout ce matériel est désinfecté après chaque usage avec la Benzalconium chloride (1%)1) qui se trouve dans le récipient (50 1) devant chaque bacs jumeaux (voir 3.2.). Il est également recommandé que l'opérateur nettoie ses mains et poignets avec le désinfectant (ne pas essuyer!)
Chaque deux jours la rigole de vidange est nettoyée avec un racleur. Les déchets accumulés dans la rigole sont des nids à micro-organismes (champignons, bactéries, protozoaires, virus etc,…..) dont certains sont pathogènes. Le sol est nettoyé et désinfecté chaque samedi. Juste avant de partir on arrose bien tout le sol avec une solution désinfectante et on laisse sécher à l'air.
Il est fortement conseillé de maintenir les géniteurs sauvages en quarantaine avant de les transférer à l'écloserie. Pendant plusieurs jours on applique des traitements désinfectants et préventifs. En même temps leur santé est contrôlée.
Ces mesures sont complémentaires aux opérations décrites pour garantir une qualité d'eau optimale.
Une alimentation suffisante, appropriée et équilibrée en éléments nutritifs essentiels, particuliérement en acides aminés, en vitamines, en oligoéléments et en minéraux, est de la plus grande importance pour les géniteurs. Si l'alimentation n'est pas correcte, le développement des gonades est contrarié, de même que la bonne santé des poissons.
On a préparé une formule alimentaire composée de produits agro-industriels locaux, riche en protéines et en énergie (tableau 2 et document technique N° 23) à l'intention des reproducteurs. Les frais de nourriture sont relativement minimes grace à la faible quantité requise et en aucun cas ne mettent en cause l'économie, et la gestion de l'écloserie.
Il est vivement recommandé de completer ce régime artificiel avec une nourriture naturelle abondante au moins un jour par semaine. Des poissons non valorisé (fretins et alevins morts) issus de vidanges de la station conviennent parfaitement. Le surplus peut être congelé, et distribué aux reproducteurs en attendant la prochaine vidange.
Pour retarder la prolifération des végétations sur les résidus non-ingérés on mélange 5 g par 100 kg (50 ppm) de violet de gentiane.
Les géniteurs sont nourris avec l'alimentation sous forme de granulés, l'aliment distribué correspond à une ration alimentaire journaliére de 1.2 pour cent de de leur poids corporel (poisson de 300 g, granulés No 5, diamètre 4.8 mm) à 1.0 pour cent (poisson de 1 kg, granulés No 6, diamétre 6.4 mm). Chaque mois, le poids moyen est déterminé d'un échantillon afin de permettre d'ajuster la quantité d'aliment maximale à distribuer par jour.
| Formule | 1 | 21) | 3 | 4 | 5 |
| Ingredients, % | |||||
| son de riz | 8 | - | 8 | 8 | 8 |
| maïs | 4 | 12 | 14 | 4 | 4 |
| tourteaux de coton | 25 | 25 | 25 | 25 | 30 |
| tourteaux d'arachide | 25 | 25 | 25 | 25 | 30 |
| tourteaux de sésame | 10 | 10 | 20 | 15 | - |
| farine de sang | 20 | 20 | - | 20 | 20 |
| cmv | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 |
| os calciné | 2,0 | 2,0 | 2,0 | 2,0 | 2,0 |
| sel | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 |
| huile de palme | 5,0 | 5,0 | 5,0 | - | 5,0 |
| 100% | 100% | 100% | 100% | 100% |
1) les formules 2 à 5 peuvent être utilisées en cas decarences de certains ingredients.
Il est vivement recommandé de distribuer une partie de l'aliment à la main afin d'éviter toute sur-alimentation et afin de permettre d'observer l'appetit et le comportement des géniteurs, (chose très importante, mais malheureusement rarement exécutée). Un huitième de la ration journalière est donné la matin à 7 h 00, premier travail de l'opérateur, et la même quantité à 12 h 00. Uniquement, si les poissons ont terminé ces deux portions sans difficulté, on peut distribuer le reste de la ration journalière (trois quart) à l'aide d'un distributeur automatique (mise en marche vers 16 heures). Si les poissons n'ont pas montré un appetit normal, et donc pas terminé la quantité matinale, on diminue la quantité du soir, en fonction de l'appetit des géniteurs. Il est important d'ouvrir et de fixer le couvercle amovible avec prudence afin de ne pas perturber les poissons. Un Clarias perturbé, stressé, ne mange rien pendant au moins 1 à 2 heures !!.
Des problémes sanitaires, ainsi que des pertes de géniteurs peuvent être provoqués par une mauvaise gestion, une mauvaise qualité d'eau, ou des maladies.
mauvaise gestion.
Les conditions d'élevage ne sont pas suivies, ou appliquées strictement (manutention brutale, stress, suralimentation, programme de nettoyage non respecté, débit d'eau insuffisant, erreurs de l'opérateur etc….). Un faible concentration d'oxygéne est un facteur de stress redouté, qui atténue considérablement la santé et la résistance des géniteurs.
Manipulation pendant la propagation artificielle. Un femelle qui n'est pas manipulée correctement au cours de l'injection, la pesée ou l'extraction des ovules, peut être endommagée mortellement. (reins ou foie abimés, hémorragie). Des injections d'hormones avec des aiguilles ou une solution saline contaminées peuvent avoir le même effect.
La plupart des maladies sont dues à une mauvaise gestion. Il est d'une grande importance que le personnel de l'écloserie soit discipliné, soigneux, précis, et adroit. Les poissons doivent être l'objet de surveillance sérieuse et permanente pour assurer la santé et la survie de ceux-ci.
Mauvaise qualité d'eau.
Jusqu' à présent on a encore jamais constaté une mauvaise qualité d'eau du canal d'amenée. La mauvaise qualité d'eau à l'intérieur de l'écloserie est plutôt causée par des erreurs de l'operateur. (renouvellement de l'eau insuffisant, suralimentation, mauvaise hygiéne.)
Des maladies.
En milieu naturel, les Clarias en bonne santé vivent en symbiose avec des parasites et des bactéries toujours présents dans l'eau, mais tous les deux sont présents dans des quantités restreintes. Cependant en milieu artificiel, surtout quand la densité est trés élevée et quand la gestion et la qualité de l'eau ne sont pas optimale, ces micro-organismes peuvent proliférer trés vite et entrainer des résultats néfastes.
Les plus importantes maladies rencontrés sont:
Crâne fendu; Cette maladic est typique d'une dégradation de la qualité de l'eau due à l'accumulation des matiéres orgeniques au fond du bac et par conséquent une prolifération des micro-organismes. Les Clarias vivent dans ce milieu contaminé, où les parois de la cavité supra-branchiale (ou cavité de l'organe respiratoire accessoire) sont atteints et se nécrosent. A ce stade la maladie se géneralise rapidement, hémorragie, septicémie etc ….. En outro le cartilage des os craniens est attaqué, devient nécrotique et le crâne s'ouvre, suivi par la mort du poisson.
Si cette maladie se présente, les mesures suivantes sont à prendre:
Eliminer tous les poissons qui ont le crâne ouvert ou ayant le crâne trop bombé;
Nettoyer le bac, rincer abondamment avec l'eau au tant de fois qu'il est nécessaire afin que tous les résidus organiques soient éliminés;
Augmenter le débit d'eau afin d'assurer une oxygénation optimale (4 à 5 mg/1 O2 à la sortie) et éliminer tout éxerément ;
Diminuer l'alimentation, et surveiller qu'elle entièrement consommée. (contrôler, distribuer l'aliment à la main);
Vérifier l'execution des mesures hygiéniques.
Myxobacteries (Flexibacter): Cette bacterie, essentiellement rencontrée sur la peau, se multiplie trés vite et peut être responsable de pertes énormes. On trouve cette maladie chez les poissons qui se sont battus, ou qui ont été manipulés trop brusquement, (vidanges, pesée, reproduction) ou quand le mucus épidermique (ou couche protectrice de la peau) est abimé. Ceci peut également être causé par des blessures mécaniques. La maladie se manifeste par des tâches blanchâtres sur des blessures. Un frottis, examiné sous le microscope confirme la présence des myxobactéries. Un des traitements thérapeutiques suivants est alors recommandé:
Chloranphénicol base, 60 mg/l; bain de 2 heures pendant 4 à 8 jours.
Furaltadone HCL 10 mg/1, bain de 2 heures pendant 4 à 8 jours.
Furaltadone HCL 10 mg/1 et penicilline 10 mg/l bain de 2 heures pendant 4 à 8 jours.
Oxytétrocycline HCL ou Chloranphénicol palmitate 75 mg/kg/jour, mélangé à l'aliment, pendant 10 jours
Les traitements préventifs sont en géneral déconseillés afin d'éviter une résistance contre les antibiotiques ou bactéricides. Un traitement de 10 ppm de Furaltadone (bain) est appliqué pour des géniteurs sauvages en quarantaine (3 à 4 jours).
Maladies parasitaires. Les parasites peuvent être divisés en deux groupes: les protozoaires (parasites uni-cellulaires) et les métazoaires (parasites multi-cellulaires). On a rencontré: Paramécium, Trichodina, Gyrodactylus, Dactylogyrus, Chilodonella, et Argulus; tous des ectoparasites.
Les traitements thérapeutiques suivants sont appliqués:
Formolaldéhyde, 100 mg/1, bain de 30 minutes ou 25 mg/1, bain de 6 heures, pendant plusieurs jours
Sel ordinaire (NaCl) 2.5% (= 25 g/1, 10–15 min)
Vert de malachite, 1 mg/1, bain de 1 heure ou 0,1 mg/1, bain permanent.
Champignons. Un effet secondaire des lésions de la peau, sont des infections de Saprolegnia. Ces infections sont traitées en même temps que les ulcéres avec:
Vert de malachite, bain de 1 mg/1 pendant 1 heure
Dans les annexes 3 et 4 se trouvent quelques unités pratiques et leur conversion ainsi que quelques exemples de selcul des traitements.
Il est recommandé, dans le but d'obtenir des ovules tout au long de l'année, d'utiliser des géniteurs stockés en étang pendant la période de maturation naturelle, de mai jusqu'en septembre et ceux issus de l'écloserie le reste de l'année.
Les géniteurs de l'étang de stockage sont capturés à l'aide d'une senne. A l'écloserie on vide le bac à reproducteurs presque complétement. (laisser quelques 10 centimétres d'eau). Les sujets ayant un stade de maturation avancé sont sélectionnés, ceci est facile chez les femelles, mais presque impossible chez les mâles.
Les femelles sont choisies sur la base de:
Ventre mou, bien gonflé, l'embonpoint s'étendant au-delà de la nageoire pectorale jusqu'à l'orifice génital, sous la pression manuelle de l'abodomen on parvient facilement à obtenir quelques oeufs “dormants” par ovulation mécanique, le diamètre des ovocytes des géniteurs utilisables est > 1.0 mm (moyenne 1.2 mm).
Orifice génital gonflé, rougâtre, rosâtre; Cette caractéristique n'est pas toujours aussi évidente.
La seule indication chez le mâle est la présence d'une papille génitale bien développée, parfois légérement gonflée. Contrairement à beaucoup d'autres éspèces il est impossible d'obtenir quelques gouttes de laitance chez les C.lazera mâles lorsqu'on presse leurs flancs. Ceci est probablement dûau fait que la laitance se loge dans les lobes des testicules.
Les sujets choisis sont toujours, durant toute la reproduction artificielle, manipulés avec une serviette ou un torchon bien mouillé, il ne faut jamais prendre les poissons avec les mains nues. Attention aux blessures mécaniques!!
Le nombre de femelle que l'on doit sélectionner pour la reproduction des oeufs/larves dépend des facteurs suivants:
Nombre d'ovules obtenus. Ceci est souvent exprimé en pourcentage du poids corporel des géniteurs. Ce pourcentage est en relation linéaire avec le dévelopment gonadal saisonnier (voir section 4.5.). Les pourcentages suivants, laissant une marge de sécurité suffisante, sont utilisés pour le calcul du nombre de géniteurs nécessaire à l'obtention d'un nombre déterminé d'ovules:
15 pour cent, géniteurs étang, mai-septembre
10 pour cent, géniteurs écloserie, oct, nov, mars, avril
5 pour cent, géniteurs écloserie, déc-févr.
Capacité maximale d'incubation des oeufs fécondés. Celle-ci est à l'heure actuelle de 800 à 1000 g (voir section 4.7.).
Poids corporel des géniteurs. Le poids recommandé est de 500 à 1000 g. Sur cette base, on pourra calculer le nombre de sujets requis pour la propagation artificielle propement dite (voir annexe 5).
Un nombre minimum de 8 géniteurs est sélectionné le matin et maintenu isolé sans nourriture, dans un bac à reproducteurs bien oxygéné. Au-dessous de ce nombre, on stimule l'agressivité des poissons, ce qui provoque de violents combats, ceux-ci ont un effet négatif sur la qualité des oeufs et peuvent même provoquer une perte de géniteurs. Au-dessus de 15 sujets, on peut les partager en deux bacs afin de pouvoir récuperer les oeufs à un moment bien précis, pour assurer un pourcentage d'éclosion optimal. Il existe une relation bien précise entre la période latence (ou la durée entre l'injection hormonale et l'ovulation) et le pourcentage d'éclosion (voir 4.6. pour plus de détails).
On peut parvenir facilement à obtenir, sur “commande” des oeufs de C.lazera avec des traitements hormonaux. Une condition préalable est requise: les ovules dans l'ovaire doivent être au terme du cycle de vitellogenèse et se trouver dans la phase dormante ou de repos. Sans cette condition le traitement hormonal n'atteint pas son but. La répartition des ovules vitellogènes dans l'ovaire des C.lazera est illustrée dans la figure 17. Les femelles ayant le ventre mou et bien arrondi ont sûrement des ovaires bien développés et remplis d'ovules dormants. Par contre, l'état de maturité des femelles ayant le ventre dur et plat est douteux. Dans ce cas là, un simple prélevement et l'examen de quelques ovules de ces géniteurs peuvent indiquer le degré de maturité de la population. Chez les poissons-chats, on peut obtenir un petit échantillon d'ovules par succion en inserrant unecanule (fin tube en plastique d'environ 2mm de diamétre) dans l'ovaire par l'orifice génital. Cet échantillon est représentatif grace au développement synchronique des ovocytes, c'est à dire qu'il n'y a pas de difference significative quant au degré de maturité entre les échantillons d'ovocytes prélevés dans les différentes parties de l'ovaire. Lorsque la taille de la plupart des ovules est au-dessus de 1.0–1.2 mm on pourra injecter les poissons de ce groupe.
Jusqu'à présent la maturation finale et l'ovulatior ont éte provoquées chez les femelles de C.lazera avec les produits et les doses énumerées ci-après. Il n'est pas nécessaire d'administrer l'hormone aux mâles:
Doca en solution aqueuse, dose 5 mg/100 g poids corporel.
Doca en solution huileuse, dose 2.5 mg/100g poids corporel.
Extrait d'hypophyse de carpe, séché à l'acétone, dose 4 mg/kg poids corporel.
Extrait d'hypophyse de Clarias, dose 1 hypophyse/femelle.
HCG (gonadotrophine chorionique humaine), dose 2.5 U.I/g poids corporel.
Tous ces produits ont été utilisés à l'écloserie ot sont tous parvenus à déclencher la reproduction provoquée. L'utilisation de Doca est déconseillée, d'une part parceque ce produit requiert une ovulation mécanique et d'autre part parce que les pourcentages de larves viables obtenues sont nettement inférieurs. En général on applique la technique d'hypophysation avec les extraits de la glande pituitaire de carpe séchée à l'acétone, pour des raisons économiques. (1 g coûte 100 E.U. Dollars ce qui correspond à l'injection de 250 kg de poisson ou d'environ 17 millions d'oeufs obtenus L'induction de la reproduction avec les hypophyses de C.lazera “fraiches” ou sèchées à l'acétone donne autant de satisfaction que les extraits de carpe. L'annexe 6 décrit on détail la préparation des glandes pituitaires de C.lazera
Le dosage hormonal requis varie selon la période de l'année et selon que la femelle est plus ou moins “prête”, ce qui dépend de son âge, sa taille, sa sensibilité et surtout des conditions d'élevage. On a constaté que les femelles stockées en étanges réagissent de façon positive avec la moitié de la dose recommandée durant la période de reproduction naturelle. Il est cependant préférable d'administrer trop d'hormones que trop peu.
La solution préparée d'extrait hypophysaire, dans laquelle la gonadotrophine a'est dissoute, est administrée en une dose unique et déterminante.
Un désavantage de l'utilisation des extraits hypophysaires est d'une part la variation du stockage de la gonadotrophine, suivant la période de l'année en relation avec le cycle biologique du poisson donneur. Les poissons immâtures ne détiennent qu'une faible quantité de gonadotrophine dans leur glande, de même que, après la fraie naturelle, la teneur en gonadotrophine est au minimum. Par contre, cette teneur est maximale durant la phase “dormante” et la période de ponte naturelle. D'autre part, on injecte une partie d'une glande, dont l'hormone qui nous interresse n'est en fait qu'une fraction minime. C'est pourquoi, beaucoup de chercheurs travaillent sur l'isolation des substances biologiques ou chimiques “pures” d'un prix abordable pour les pisciculteurs. L'hormone gonadotrophine chorionique humaine (HCG) et les analogues synthétiques de l'hormone libérante (LRH-a) sont jusqu'a présent encore bien trop chères.
Le solvant utilisé pour préparer la solution d'extrait pituitaire est une solution de sel ordinaire (NaCl) à 0.9 pour cent. On dissout 9 g de sel propre, épuré d'iode, dans un litre d'eau distillée ou de l'eau potable bouillie et refroidie. Il est recommandé d'injecter 1 à 2 ml de solution hypophysaire par poisson. La quantité de solution nécessaire est calculée par rapport au nombre de femelles sélectionnées.
La quantité d'extrait hypophysaire est déterminée d'après le poids total des géniteurs, après quoi on pèse la quantité d'extrait avec une balance de precision ou une cuiller de volume connu. (Notre extrait de la glande pituitaireest déja pulvérisé, en gros, et conditionné en petit flacon de l g) Si l'on possède des glandes hypophysaires entières, calibrées et sechées, on compte simplement le nombre de glandes requises.
L'extrait pesé est pulvérisé soigneusement dans unmortier de porcelaine bien sec. Après quoi on ajoute quelques gouttes de solvant calibrées avec une seringue graduée. On mélange bien le tout en s'assurant que la poudre soitbien fine. Ensuite on ajoute quelques ml de solvant et l'on verse la solution dans une fiole. Il faut rincer le mortier et le pilon plusieurs fois. Ce qui reste de solvant est mis directement dans le flacon, puis on laisse reposer la solution pendant une demi-heure, pour la dissolution de l'hormone.
Si on travaille avec un groupe de géniteurs de tailles comparables on peut injecter à chaque sujet la quantité employée pour le calcul de la quantité de solvant requise (en général l ml par poisson). Par contre si l'écart des poids corporels est important, on est obligé de peser d'abord la femelle après quoi on calcule précisement la quantité de solution hypophysaire requise (Annexe 7) avant d'administrer l'hormone.
La méthode d'injection la plus appropriée est l'injection intramusculaire dans le muscle dorsal, entre la base de la nageoire dorsale et la ligne latérale. L'endroit précis où est introduit l'aiguille n'est pas trés important à condition que cela soit fait à partir de la base de la nagoire dorsale. L'instrument est introduit en diagonale, sous un angle d'environ 30 °. Une fois retiré on frotte doucement l'endroit pour faciliter la repartition de l'extrait et pour prévenir un retour du liquide. On peut aussi empêcher ce retour en augmentant la viscosité de la solution par addition de 10 à 20 pour cent de glycérine à la solution, la glycérine est mélangée directement à la poudre séchée afin de favoriser la pulvérisation de celle-ci.
L'administration directe dans la cavité abdominale (injection intrapéritonéale) est appliquée parfois. Cette méthode fut surtout utilisée lors des premiers essais avec le C.lazera. L'aiguille est introduite, partant latéralement sous la base de la nageoire pectorale dans la cavité abdominale.
Cette méthode risque d'endommager les organes internes et aussi d'entraîner une perte d'extrait par injection accidentelle dans l'oesophage ou le tractus digestif. L'injection par voie intrapéritonéale semble peu recommandable.
L'utilisation de l'hormone Doca entraînera souvent des ulcères à l'endroit de la piqûre. Une administration de 50 mg de Chloramphénicol ou d'Oxytétracycline, par kg de poids corporel mélangé à solution hypophysaire limite la maladie et le risque de perte de géniteurs.
Si l'on doit injecter deux groupes de géniteurs (plus de 16 sujets) il est préférable d'introduire un écart de l heure entre chaque groupe. Ce temps correspondant au délai nécessaire pour l'extraction manuelle des oeufs de 8 à 10 femelles. Si les géniteurs sont gardés individuellement (aquaria ou petit bac), ilest conseillé d'introduire un écart de 5 à 10 minutes entre chaque injection hormonale.
Il est nécessaire de toujours renouveler les précautions à prendre pour la manipulation des géniteurs, ceux-ci devraient être enveloppés dans une serviette humide et placés sur une petite table recouverte d'une feuille de mousse ou une serviette épaisse. De cette façon, on élimine le risque d'enlever le mucus épidermique du poisson et on évite les maladies causées par les bactéries.
Les injections hormonales, sont en général, appliquées le soir en fonction de la température de l'eau. Un exemple de calcul de l'heure d'injection se trouve en annexe 8. L'emploi d'un tranquilisant n'est pas indispensable. L'excitation causée par la manipulation pourra être limitée en cachant les yeux de la femelle avec la serviette humide. Aprés l'injection, les poissons sont soigneusement remis dans le bac; il ne faut jamais les jeter dans l'eau!!
Après l'injection unique, on remet les géniteurs dans leur bac et on ferme le robinet d'entrée d'eau. Ceci est fait pour minimiser la fluctuation de la température pendant l'intervalle entre l'injection et l'ovulation. (= délai d'ovulation ou période de latence). Une densité de 8 à 16 géniteurs par 1 m3 d'eau ne représente aucun risque de sous-oxygénation. Il faut absolument éliminer tous les facteurs de stress!! Il est connu que le stress a une action négative sur la qualité des oeufs.
Le processus de maturation finale et d'ovulation prend du temps, dépendant en grande partie de la température du milieu aquatique. La figure 22 et 23 illustre la période entre l'injection et l'expulsion manuelle des oeufs, en fonction de la température pour C.lazera.
Si le pisciculteur connait la température de l'eau, le jour de l'injection et par conséquent, le délai d'ovulation approximatif, il pourra établir un horaire des événements de la reproduction de façon à ce que l'extraction manuelle des oeufs puisse se faire à une heure convenable, de préférence le matin. Ensuite en observant la température de l'eau durant la maturation finale et en prenant la température moyenne, on pourra calculer l'heure exacte de la fin de ce processus biologique, ou l'ovulation (annexe 8).
La figure 24 illustre l'effet de l'injection hormonale sur les ovocytes. Les paramètres physiques de la maturation finale (augmentation de taille grâce à l'hydratation et translucidité des ovocytes) montrent que seuls des ovocytes ayant une taille au-dessus de 1.0 à 1.2 mm réagissent de façon positive sur l'hormone. Cette taille correspond à la taille des ovocytes qui sont au terme de la vitellogénèse (ou des ovocytes parvenues à la phase “dormante”). Il n'est pas nécessaire chez les C.lazera de saturer leur papille génitale pour empêcher la perte des oeufs ovulés dans le bac de stockage, ou pendant la manutention.
La fécondation se fait artificiellement selon la méthode “séche”. Aprés l'ovulation, les oeufs amassés dans la cavité ovarienne sont expulsés mécaniquement par légère pression des flancs et massage de l'abdomen, avec l'index et le pouce mouillés. Les oeufs sont récupéres dans un récipient émaillé, bien sec. Une équipe de deux personnes bien entrainéés, peut proceder en 30 ou 60 minutes à l'extraction manuelle de 10 à 15 femelles. Une personne tient la tête de la femelle et fait jaillir les oeufs tandis que l'autre tient la queue et guide le récipient de façon a récuperer les oeufs éjectés.
Le moment correct pour l'extraction manuelle est critique pour l'obtention de bons résultats d'éclosion (fig.22). Il existe un moment optimum trés bref, en particulier lorsque la température est élevée. A cet instant, les oeufs sortent trés facilement et cette opération ne demande qu'une trés légere pression manuelle. Si l'on appuie trop fort, le risque d'endommager les organes intérieurs, notamment les reins, s'accroit considérablement. Il est indispensable de commencer le massage abdominal, juste en dessous de le machoire inférieure jusqu'à l'orifice génital, afin d'enlever tous les oeufs ovulés. Une femelle “spent” c'est à dire Le femelle complètement vidée de ses oeufs “mûrs”; a le ventre creux, totalement relaché, les ovaires d'une femelle “spent” ne contiennent que des cellules primitives et des ovocytes vitellogénéses n'étant pas encore parvenues à la phase “dormante”.
Le moment optimum pour l'extraction manuelle des oeufs devrait être calculé avec précision. Trés peu de temps avant, ou après ce moment idéal, les oeufs sont soit “pas assez mûrs”, soit “trop mûrs”. Ceci se traduit par une baisse considerable du pourcentage d'éclosion (ou nombre de larves viables écloses) et une augmentation de la proportion des larves déformées. Cette réduction est due à:
un développement incomplet de la maturation finale, après quoi les oeufs sont ovulés mécaniquement par pression des flancs, ou
une atrésie (putréfaction et résorption naturelle des oeufs par l'ovaire) des oeufs par l'ovaire) des oeufs ammassés dans la cavité ovarienne.
La période approximative dont on dispose pour l'extraction manuelle par pression des flancs est de 20–30 minutes, 60-90 minutes et 120–240 minutes pour respectivement une température moyenne de l'eau de 30, 25 et 20 °C.
Les quantités d'oeufs obtenues artificiellement (fécondité relative) après induction hormonale de femelles maintenues soit en étang soit en écloserie sont illustrées dans les figures 25 et 26. On recommande (voir par. 4.4.6) de réaliser la propagation artificielle avec les femelles maintenues en étangs (mai-septembre) et celles maintenues en permanence en écloserie pour le reste de l'année. Dans le tableau 3 sont énumerés la quantité d'oeufs obtenue, et le nombre d'oeufs obtenus par kilogramme de poids corporel d'une femelle (fécondation absolue) pour les différentes périodes de l'année. La fécondation absolue a pu être calculéé étant donné que le poids d'un oeuf ovulé varie entre 1.2 et 1.7 mg.
| periode del'année | provenance des géniteurs | fécondité relative (%) | fécondité absolue (nombre d'oeufs) |
| déc-fév. | écloserie | 5 | 35.000 |
| oct-nov-mars- | |||
| avril-mai-sept | écloserie | 10 | 70.000 |
| étang | 15 | 105.000 |
Il semble que si l'on parvient à maîtriser la température de l'eau de façon a ce qu'elle soit plus ou moins constante autour d'une moyenne de 25 à 27 °C, on obtiendra une fécondité relative d'environ 10 pour cent tout au long de l'année, avec des géniteurs maintenus en écloserie.
Dans nos essais, il a été découvert que l'on peut reproduire la même femelle de façon répétée à des intervalles de 3 à 4 semaines. Les résultats obtenus sont identiques, c'est à dire, à chaque propagation provoquée on obtiendra, dans unemarge de variation naturelle, la même quantité d'oeufs et le même nombre de larves viables. Toutefois, il est conseillé, dans la pratique, de propager la même femelle au maximum une fois chaque 6 à 8 semaines.
Une heure avant le début de l'extraction des oeufs, on prépare la solution de laitence. L'anatomie des mâles de C.lazera ne permet pas l'obtention de laitance par pression manuelle ni avec un collecteur de laitance. Toute fois on vient aisément à obtenir plusieurs gouttes de sperme tres concentré en incisant les lobes des testicules d'un mâle sacrifié, avec un bistouri.
Sans eau, les spermatozoide demeurent inactifs et peuvent être conservés dans un réfrigérateur pendant au moins 24 heures sans perdre leur capacité de fécondité. La laitance est placée dans une fiole où elle à une solution physiologique saline (0.9 pour cent de sel ordinaire propre). Même aprés une dilution d'un millième, seule une petite quantité est requise pour réussir la fécondation. Il a été estimé qu'un millilitre de laitance est suffisant pour féconder 50 kg d'oeufs (l ml de laitance contient entre 10 et 20 milliards de spermatozoîdes Hogendoorn en Vismans dans Hogendoorn (1983)).
La fécondation a lieu dans le même récipient que celui dans lequel on a ammassé les oeufs d'une ou plusieurs femelles. On y ajoute la solution de laitance ensuite les oeufs et la laitance sont doucement mélangés. Alors on y ajoute un ou deux volumes d'eau propre pour activer les spermatozoïdes. La fécondation est obtenue en remuant légerement le récipient pendant environ une demi minute. Apres une vie tres breve mais tres intense caractériséepar des mouvements vigoureux, les spermatozoides demeurent inactifs à peu pres en même temps que le micropyle se ferme. Ainsi les spermatozoides ne disposent que d'un temps tres limité pour que l'un d'eux pénètre dans l'oeuf. Ensuite les oeufs fécondés sont rincés à l'eau propre pour enlever la laitance et mis en incubation.
L'incubation des oeufs fécondés se fait soit en eau courante soit en eau stagnante dans un incubateur (ou bac d'éclosion) de type californien. Les oeufs sont placés en une couche, de facon homogène, sur les plaques perforées des paniers d'incubation. Chaque bac d'éclosion contient quatre de ces paniers. La charge optimale d'un panier est de 50 à 60 g d'oeufs. Chaque bac d'éclosion contient donc au maximum 200 à 250 g d'oeufs fécondés, ce qui correspond à un nombre de 140.000 à 175.000 oeufs.
Dès que les oeufs rentrent en contact avec l'eau leur disque adhésif composé de glucoproteines, c.à.d. de sucre et d'acides amines, s'active. L'adhérence est plus forte après 30 à 60 minutes et diminue au fur et à mesure du développement des oeufs. Il est important d'incuber les oeufs fécondés dans la demi-heure qui suit la fécondation (premier contact avec l'eau) sinon les oeufs risquent de s'agglutiner en bloc grâce à cette adhérence. Cette agglutination empêche une oxygénation correcte des oeufs à l'intérieur du bloc, faute de quoi ils meurent. Le développement des champignons (Saprolegnia sp) et la consommation élevée d'oxygène des oeufs morts gênent le bon développement des oeufs viables.
A l'heure actuelle on maîtrise, comme déjà mentionné ci-dessus, deux méthodes d'incubation, à savoir: Incubation en esu courante.
Un faible débit en eau (d'environ 1 l/min jusqu'à 2 1/min au terme de l'incubation) est suffisant pour assurer l'apport continu en oxygène à haute concentration pour le développement des oeufs, grâce à la fabrication spéciale des paniers d'incubation. Une circulation d'eau est créée par laquelle l'eau pénetre par en-dessous et les oeufs restent immobiles. La consommation est négligeable aux stades initiaux, s'accroit au fur et à mesure que l'oeuf se développe. Il est recommandé de maintenir la teneur en oxygène entre 5 et 6 mg/l.
Il est nécessaire de protéger les oeufs au cours de leur développement contre leurs ennemis comme les bactéries, les champignons et les prédateurs (crustacés et insectes aquatiques). On se sert de Wescodyne (solution iodine) à une concentration de 25 mg/l pendant 5 minutes contre des bactéries présentes dans l'eau. Il est impossible de traiter contre des bacteries à l'intérieur de l'oeuf transmis par le géniteur (transmission verticale) les oeufs endommagés ou morts sont un excellent milieu de culture pour les champignons. On traite les oeufs fécondés avec une solution de 5 mh/l de vert de malachite pendant 15 minutes. Ce traitement peut être répété après 8 à 10 heures.
Incubation en eau stagnante.
Un systeme de recirculation de l'eau est installé dans le bac d'éclosion à l'aide d'une pompe à air (fig. 27). Une pierre poreuse branchée sur la pompe à air est placée dans un bout de tuyau PVC de 32 mm au fond du bac. Les bulles d'air qui montent à la surface entrainent la montée de l'eau par aspiration dans le tuyau. Ensuite à l'aide d'un deuxième tuyes souple ou fixe, légèrement incliné, l'eau est transportée par gravité vers l'autre extrémité du bac. Ce système assure une oxygènation optimale pour le développement adéquat des oeufs grace àu movement ascendant de l'eau provoqué par la remontée en surface des bulles d'air.
L'utilisation de l'incubation en eau stagnante nous permet de pratiquer l'incubation dans de l'eau bouillie dépourvuede microbes et de traiter en permanence les oeufs contre le développement fongique (0.05 ppm de vert de malachite On pourra, également augmenter la température de l'eau à l'aide d'un element chauffant.
Les deux méthodes ont donné entière satisfaction et on peut obtenir d'excellents pourcentages d'éclosion de 60 à 80 pour cent. Les incubations de contrôle d'une petite quantité d'oeufs fécondés dans des disques de Petri remplis complètement d'eau et placés dans un endroit calme (laboratoire) ont abouti à des pourcentages d'éclosion optimaux de 70 à 90 pourcent. Toutes fois, étant donné les tres bons resultats constant la deuxième methode est recommandée à condition que l'on dispos d'un circuit d'air puissant.
L'incubation est exécutéepar une troisième person Ainsi l'équipe requise pour la propagation est constituée de trois personnes. Tous ces operations peuvent, éventuellement, être réalisées par deux personnes expérimentées et bien entrainées.
A l'heure actuelle des traveaux sont en cours sur une troisième méthode d'incubation tres prometteuse qui consiste à se débarrasser de la matière collante, après quoi les oeufs non adhérents sont incubés dans un entonnoir (type bouteille de Zoug) soit en plusieurs couches dans le bac d'éclosio
L'oeuf mûr fécondé ou non fécondé gonfle en contact avec l'eau et prend au maximum une fois et demi son volume La fécondation de l'oeuf n'est pas indispensable pour le faire gonfler, ni même pour obtenir le premier clivage. Des que l'oeuf commence à gonfler le micropyle se ferme ce qui rend désormais la fécondation impossible. C'est pourquoi les oeufs doivent être manipulés à sec au moment de leur expulsion de l'abdomen de la femelle.
L'oeuf gonflé se compose de trois éléments: un germe, un espace périvitellin et une enveloppe. Le germe contient la masse du vitellin et le cytoplasme en phase de clivage, respectivement au pôle vègetal et au pôle animal. Autour du germe, s'étend l'espace perivitellin, rempli d'un liquide de même caracteristique osmotique. Le tout est délimité par une membrane trés dure et résistante à la pression des doigts, après hydratation. La figure 16 illustre le développement des oeufs.
La période d'incubation des oeufs, rapide chez les C. lazera est fonction de la temperature (fig.28) et de la presence des enzymes ayant une action dissolvante sur la membrane, ces enzymes sont évacués si l'on utilise la méthode d'incubation en eau courante. C'est pourquoi l'éclosion des larves est plus rapide en eau stagnante qu'en eau courante. A 25 °C, par exemple, le temps que mettent les oeufs à se développer (dans l'eau stagnante) est respectivement de 24 à 28 heures et de 28 à 36 heures pour les oeufs an eau courante (voir fig. 28).
Etant donné que les poissons sont des animaux à sang froid etque par consequent tout processus biologique dépendra de la température du milieu aquatique, le pisciculteur a là un instrument commode pour soit retarder soit avancer le delai d'ovulation ou la periode d'incubation. La temperature optimale pour la morphogénèse de l'embryon de C.lazera est de 30 °C. Une temperature trop élevée peut provoquer l'éclosion prématurée d'embryons incomplétement formés, pour la plupart incapable de survivre.
En général, la propagation artificielle peut échouer à deux niveaux de l'enchainement des événements, à savoir:
Traitement hormonal.
Au niveau hormonal l'échec se traduit par une
mauvais delai d'ovulation ou période de latence (voir section 4.6.);
stress des géniteurs. Il est connu qu'une femelle stressée gravement durant l'intervalle entre l'injection et l'ovulation parvient normalement à la rupture folliculaire mais la qualité des oeufs obtenues est insuffisante
quantité d'oeufs. Si on place plusieurs couches d'oeufs sur les plaques perforées (plus de 60 g d'oeufs par panier d'incubation), l'oxygénation n'est plus optimale et le pourcentage d'éclosion diminue considérablement.
conditions d'incubation. Il est important que les conditions d'incubation préalables déja mentionnées (oxygène, température, propeté de l'eau, absence de prédateurs etc…) soient réunies.
mauvaise concentration des traitements. Deux erreurs fondamentales provoquant la mort massive des oeufs ont été observées. Premièrement, une erreur de calcul de la concentration, le degré correct du produit doit être calculé avec beaucoup de soins, car, si elle est trop forte, elle devient toxique pour les oeufs de poisson. Deuxiémement, une dilution incorrecte, la concentration calculée à mettre dans le bac d'éclosion doit être diluée jusqu'à un volume correspondant à 5–10 pour cent de volume d'eau du bac. Ensuite, cette solution est versée d'une façon très homogène dans le bac d'éclosion. (voir annexe 4).
En général la mortalité durant la fécondation et le dèbut de développement des oeufs est minime, cependant la plupart de la mortalité se situe juste avant et au moment de l'éclosion. Les oeufs sains restent transparents, et ont une couleur verte. L'embryon au pôle animal se distingue par une couleur brunâtre. Les oeufs morts deviennent blancs et sont un excellent milieu pour la prolifération des champignons.