La technologie appliquée en écloserie pour l'élevage d'alevins de Clazera est l'élevage intensif en eau courante. L'eau est utilisée une fois, après quoi elle est évacuée. Cet élevage est basé sur les principes fondamentaux suivants :
Théoriquement, il faut essayer de maintenir la qualité de l'eau à un niveau acceptable à partir du moment où l'eau entre dans le bac jusqu'à ce qu'elle en sorte. Quand l'eau rentre dans le bac, l'oxygène est consommé par les poissons et ceux-ci y ajoutent les éxcréments du processus du métabolisme (matières fécales et urine). Il est donc important que le taux d'oxygène de l'effluent n'arrive pas en dessous du taux minimum requis et que les taux de métabolités toxiques pour les poissons comme l'amonium (NH4+) et le nitrite (NO2-), substance intermédiaire de la nitrification de l'amoniaque, restent inoffensifs, pour les larves.
Dans la pratique, il n'est pas évident de réunir en même temps tous ces principes fondamentaux et simples.
Contenant : le bac d'éclosion fonctionne également comme bac de premier élevage. Pendant toute la vie larvaire (résorption vitelline) et même au-delà, les larves restent dans ces bacs d'éclosion. La figure 2 illustre ces bacs et les installations nécessaires au premier élevage. Ces installations et leur fabrication ont été décrites en détail dans le document technique n° 20 (propagation artificielle).
Un couvercle lesté d'une feuille plastique réfléchissante et posée sur les deux tiers antérieurs du bac, crée un milieu d'obscurité et de calme. La partie postérieure par contre, est bien éclairée (tube néon), afin de :
L'entrée d'eau est aménagée de façon à ce que l'eau rentre dans le bac à 30–40 cm de l'extrémité antérieure du bac (fig. 2). Cet aménagement crée un milieu très favorable au regroupement des larves viables (pas de courant d'eau important et l'obscurité). Comme on l'a déjà remarqué ci-dessus, les larves sont incapables de nager correctement, mais elles se déplacent de temps à autre. Elles n'ont pas encore la force de traverser un courant d'eau provoqué par un faible débit (2 à 5 l/mn).
Le niveau d'eau dans le bac est réglé avec la position du tropplein. Co trop-plein, comme d'ailleurs tous les trop-pleins de l'écloserie, est équipé d'une poignée fabriquée en aluminium afin d'éviter toute contamination de l'eau par l'opérateur. Une crêpine-écran, maille de 0,5 mm est placée en diagonale à une dizaine de centimètres du tropplein. En dessous de cette crêpine se trouve un tuyau souple perforé de trous très fins et raccordé au système de circulation de l'air (soufflerie). Des bulles d'air fines remontent à la surface du bac sur toute la largeur, à travers l'étamine. Ceci empêche l'accumulation des déchets et/ou des larves en mauvais état de santé devant la crêpine-écran et donc le débordement du bac si cette crêpine est bouchée, entraînant une perte considérable de larves.
Peuplement : On a vu (voir document no 20) qu'il est possible d'incuber 200 g d'oeufs fécondés dans chaque bac d'éclosion. Puisque I g d'oeuf représente 500 à 700 oeufs et que le pourcentage de larves viables est de 50 %, on obtient un nombre de larves d'environ 60.000 larves vésiculées par bac. Ceci représente au total 240.000 larves pour l'ensemble des bacs d'éclosion utilisés simultanément en reproduction par hypophysation. Le bac d'éclosion contient 100 à 120 l d'eau (lame d'eau de 12 à 15 cm) ce qui correspond à une densité de I larve par 2,7 à 2.0 cm3 (= 1,3 à 1,5 ml).
Débit/oxygène : La larve vésiculée qui n'a pas encore de branchies fonctionnelles, exige un environnement aquatique riche, de préférence, saturé en oxygène. Il faut veiller à ce que la teneur en oxygène ne tombe pas en-dessous de 5 mg/l. Un faible débit en eau (maximum 5–10l/mn est suffisant pour maintenir un niveau d'oxygène pratiquement saturé dans la totalité du bac (6 à 7 mg/l). Il faut veiller à ce que les larves ne s'échappent pas, ni ne soient pressées contre la crêpine-écran par un courant trop fort.
Température : La larve vésiculée, comme l'oeuf, a besoin d'une température bien déterminée pour son développement. La température mensuelle moyenne de l'eau de l'écloserie (qui varie entre 23 et 27 ° C pendant l'année) est légèrement en-dessous de la température optimale pour les juveniles (27 à 30° C) à l'exception du mois de janvier quand la température descend jusqu'à 20 – 24° C. Les températures les plus élevées sont enregistrées pendant les mois de mars à juin (24–28° C) On peut conclure que mis à part le mois de janvier, la température de l'eau de l'écloserie est sub-optimale pour la croissance des jeunes poissons.
Lumière : La nécessité d'utiliser de la lumière pour le bon fonctionnement de l'écloserie a déjà été discutée ci-dessus, cela reste une condition de succès très importante.
Tranquillité : La tranquillité des larves, comme d'ailleurs pour
tous les stades de développement des poissons, est un facteur de la
plus grande importance pour une croissance optimale et régulière. Toutes
les perturbations, les actions brutales, comme de toucher les bacs,
doivent être évitées au maximum.
A cet égard, il est fortement conseillé d'interdire l'entrée de
l'écloserie à toute personne, à l'exception du personnel strictement
nécessaire, c'est-à-dire deux employés et le responsable de l'écloserie.
Le personnel doit être conscient de ce problème et ne doit pas faire
de bruit qui peut déranger les poissons. Toutes les portes sont
équipées de ferme-portes afin d'éviter le claquement de celles-ci.
Les visites de l'écloserie, très intéressantes pour les visiteurs,
mais très nuisibles pour les poissons et le personnel, doivent être de
courte durée et réduites à un strict minimum.
Qualité de l'eau : La qualité de l'eau de l'écloserie a été
décrite en détails dans le document technique no 20 : Propagation
artificielle. Cette eau indemne de prédateurs, convient parfaitement
à l'élevage de jeunes poissons à l'exception du moment où se produit
une forte pluie car l'eau est très chargée de latérite en suspension
colloidale pendant 2 à 3 jours. Dans des conditions actuelles rien ne
permet d'éviter cette pollution et l'écloserie ne dispose pas de
système antipollution. On pourrait seulement faire attention aux données
climatologiques pour choisir la dote d'hypophysation. Durant quatre
années de reproduction provoquée nous avons constaté une seule fois des
pertes massives à cause de cette pollution de l'eau.
On a vu qu'un des principes de l'élevage intensif en eau courante
est l'évacuation des déchets et des résidus métaboliques. Une grande
partie de ces déchets est auto-évacuée avec le courant d'eau; les résidus
accumulés au fond du bac doivent être nettoyés par l'opérateur à
l'aide d'une pipette de 100 ml. Pendant l'élevage des larves, les
déchets sont essentiellement composés de cadavres de larves non viables
(on perd 10 à 20 % des larves récupérées après le premier triage
pendant cette période) et de saletés (aluvions, matériel organique,
etc…) accrochées à ces larves mortes.
I schéma de nettoyage et d'observation mentionné ci-dessous doit
être suivi strictement deux fois par jour (le matin à 8H00 et l'aprèsmidi
à 16H00) :
Le nettoyage de la crêpine-écran ainsi que l'espcce entre celle-ci
et le trop-plein doivent être effectués au moins quatre fois par jour
ou plus si nécessaire.
Le nettoyage du bac avec la pipette est un travail qui demande
beaucoup de soins, de temps et de patience à l'opérateur. Les larves
lucifuges ont l'habitude de s'accumuler autour des déchets infestés de
champignons. Il est fortement déconseiller de siphoner la saleté et
les larves viables. Les risques de blessures mécaniques suivies d'une
myxobocténie (Flexibacter) et de pertes considérables sont trop grands.
Les saletés sont d'abord déplacées jusqu'à la crêpine-écran à l'aide
d'un courant d'air (tuyau du système de l'air) ou d'un courant d'eau
provoqué par l'opérateur avec sa pipette remplie d'eau propre. Ensuite
les saletés et les larves déformées sont rejetées vers l'extérieur
en les aspirant avec une pipette.
Le travail de nettoyage est nettement facilité si on parvient à
créer une obscurité totale et permanente. Dans ce cas les larves en
mauvais état de santé et les déchets se trouvent accumulés dans la
partie éclairée du bac.
L'annexe I montre la fiche de propagation artifioielle et de
l'élevage de jeunes poissons. Toutes les activités, les observations
et les mesures (O2, poids moyen, etc…) doivent être inscrites sur
cette fiche. Celle-ci est indispensable pour obtenir un suivi correct
de l'élevage et une synthèse des résultats.
Hygiène : Les mesures d'hygiène complémentaires aux mesures de la qualité d'eau sont décrites en détail dans le document technique n° 20: Propagation artificielle pour l'élevage des géniteurs. Dans le contexte de l'élevage larvaire on pourrait seulement souligner l'importance de contrôler régulièrement le niveau et l'activité du désinfectant (1 ‰ de Benzal caniumchlorède). La présence de mousse quand on remue la solution désinfectante est un signe de bonne activité.
Pondant la résorption vitelline, les larves vésiculées ne nécessitent aucune alimentation exogène. La durée de cette résorption dépend de nouveau, comme tous les processus biologiques, des poissons, de la température du milieu aquatique. A 25–27° C, les larves commencent à nager à la recherche de nourriture après environ deux à trois jours. A ce stade, à peu près deux tiers de la poche vitelline est résorbée et les larves pèsent à peine 2–3 mg.
La différence entre les larves et le jeune frai est marquée par une transformation importante dans la vie du poisson; La phase larvaire se termine au moment où le poisson, ayant ouvert sa bouche, commence à nager comme un véritable poisson et à se nourrir d'organismes extérieurs.
Le développement du jeune frai comme celui des larves vésiculées est une phase délicate et déterminante pour la vie du poisson. La plupart des organes essentiels sont formés pendant cette période. Il est indispensable pour un bon démarrage de la croissance, et pour obtenir une métamorphose complète que les impératifs qui conditionnent ces phases essentielles (oxygénation suffisante, alimentation appropriée, évacuation des déchets organiques et in-organiques, lutte contre les ennemis) soient en permanence exécutés de façon optimale.
L'élevage du jeune frai est pratiqué dans les mêmes conditions que celui où les larves ont éclos et où on a pratiqué l'élevage larvaire. Il suffit de remplacer la crépine-écran par une autre dont les mailles sont écartées de 1.0 mm.
Les conditions d'élevage du jeune frai sont identiques à celles décrites en détail ci-dessus pour l'élevage larvaire. Le comportement des poissons change, ce qui rend beaucoup plus facile le nettoyage du bac d'élevage. Plus la métamorphose avance, plus le jeune frai est lucifuge, ce qui favorise la séparation du jeune frai viable de celui en mauvais état de santé. En plus, les poissons alimentés correctement s'amassent dans les angles les plus obscurs du bac pour digérer. La densité de jeunes poissons au milieu du bac, où se sont accumulés les déchets est en principe faible.
Le travail d'observation et de nettoyage reste un travail délicat et important. Le schéma suivant doit être suivi strictement :
Le nettoyage du fond du bac est nettement facilité puisque l'on peut maintenant siphoner les déchets sans risque d'aspirer le jeune frai. La vitesse se siphonage peut être réglée par la différence de hauteur entre le niveau d'eau dans le bac et l'extrémité du siphon. Cette vitesse doit être adaptée à la capacité des poissons de s'échapper du courant créé par le siphon et peut être augmentée au fur et à mesure que le jeune frai grandit et acquiert plus de force pour nager (fig. 3).
Les eaux usées et les jeunes poissons déformés ou malades sont récupérés dans un seau et jetés à l'extérieur de l'écloserie, et, surtout pas dans les rigoles de vidange. Il est recommandé, afin d'éviter tout risque d'infection de Flexibacter de ne jamais remettre les jeunes poissons siphonés, soit par erreur soir pour examen ou pour une détermination du poids moyen.
Le jeune frai a besoin d'une nourriture extérieure qui doit être satisfaisante à la fois en quantité et en qualité. Pendant les premiers deux à trois jours de l'alimentation d'origine extérieure, le jeune frai détient encore une parcelle de vitellus larvaire d'où il peut tirer sa subsistance pendant le temps nécessaire pour apprendre à trouver et à s'adapter à sa nourriture. Une fois le vitellus entièrement consommé, les poissons doivent obtenir une alimentation adéquate de l'extérieur, faute de quoi ils s'affaiblissent de manière irréversible. D'autant plus, qu'un jeune poisson affaibli est beaucoup plus sensible aux maladies.
La pratique du premier élevage (ou “nursery”), très délicate et sensible, exige beaucoup d'attention et des soins intensifs pour réussir particulièrement en ce qui concerne l'alimentation.
Hogendoorn (1980) a découvert qu'une bonne croissance et une bonne santé ne peuvent être obtenues qu'à condition d'utiliser une nourriture naturelle. Cette nourriture naturelle peut être : du zoo-plancton (ratifères ou cladocères) vivant ou surgelé ou des naupliés d'Artemia salina vivants, surgelés ou des kystes (= oeufs desséchés) décapsulés. Les meilleurs résultats ont été obtenus avec la nourriture vivante (Artemia ou zoo-plancton) administrée à satiété tout au long de la journée et de la nuit.
Dans les conditions actuelles à la station piscicole de la Landjia, il est beaucoup plus facile de nourrir avec les nauplies d'Artemia qu'avec le zoo-plancton cultivé en masse localement. La préparation des nauplié à partir des kystes décapsulés est décrite dans l'Annexe 2.
Le jeune frai est nourri à satiété avec les nauplié et les oeufs décapsulés non-éclos, 5 fois par jour (7H00, 10H00, 13H00, 16H00 et 18H00) de la façon suivante :
L'alimentation jusqu'à satiété est essentiellement basée sur le comportement des jeunes poissons. Quand ils sont affamés, ils nagent vigoureusement dans toute la colonne d'eau à la recherche de nourriture. Dès que l'on nourrit, les naupliés et les oeufs, plus lourds que l'eau tombent au fond du bac et on observe une excitation de tous les jeunes poissons qui mangent la nourriture distribuée. Une fois satisfaits, ils se regroupent dans les angles obscurs au-dessous des couveroles.
Il est conseillé de ne pas enlever les couvercles pendant la distribution de la nourriture et de n'administrer l'aliment que dans la moitié antérieure du bac (fig. 4). Ainsi on apprend aux poissons, en quelques jours, à se nourrir dans la partie obscure du bac et on améliore de nouveau la séparation naturelle entre les poissons viables et ceux en mauvais état de santé. Ces derniers se nourrissent généralement pas et peuvent être rejetés.
Le moment de la distribution d'aliment est un moment important et propice pour observer les poissons.
L'élevage du jeune frai qui s'étale sur environ 15 jours est caractérisé par une très faible mortalité (presque néant). A la fin de cette période les jeunes poissons pèsent environ 40 à 60 mg.
La quantité d'Artemia nécessaire pour l'élevage du jeune frai s'élève à environ 500 g par 10.000 poissons.
Lorsque le jeune frai de C. Lazera est alimenté dès le début avec un aliment artificiel pour truites, de la levure inactivée, du poisson homogénéisé, des oeufs de Clarias ou une solution spéciale d'oeufs de poule, le développement est très lent et la survie est très faible après la seconde semaine (Hogendoorn, 1980 et expérience personnelle). Ces nourritures sont bien absorbées au début, mais, pas aussi bien que l'Artemia ou le zoo-plancton. Elles semblent être mal digérées par le jeune frai.
Des expérimentations sont en cours avec des aliments artificiels de démarrage très sophistiqués. Il semble que, d'ici quelques années, ces aliments pourront remplacer l'aliment naturel vivant.
A partir du moment où le jeune frai a terminé complètement la métamorphose, on l'appelle alevin. Ce stade est également caractérisé par le changement de l'aliment naturel à l'aliment complet, artificiel. Ceci est l'aliment final de C. Lazera élevé en milieu artificiel.
Les poissons, devenus de vrais petits silures, sont moins vulnérables mais demandent une attention accrue, surtout en ce qui concerne les mesures sanitaires préventives et alimentaires.
Contenant : Les alevins maintenus jusqu'à présent dans les bacs d'éclosion sont transférés dans les bacs d'alevinage. Ces bacs ainsi que toutes les installations (lumière, air, obscurité, désinfection, etc…) sont décrits en détail dans le document technique no 20 : Propagation artificielle. La figure 6 montrele bon fonctionnement du bac d'alevinage.
Le transfert des jeunes poissons est un travail délicat et se fait par siphonage (fig. 5). Il est, en toutes circonstances, déconseillé de toucher ou de sortir de l'eau un jeune poisson avec une épuisette. Uniquement les sujets à rejeter peuvent être manipulés ainsi. Les poissons sont d'abord concentrés en poussant la crépine-écran vers l'entrée d'eau. Ensuite ils sont siphonnés à l'aide d'un tuyau souple d'un diamètre de 10 à 15 mm dans un seau. La vitesse du siphonage doit être reglée de façon à ce que les alevins ne soient pas éjectés contre les bords du seau par un courant d'eau trop fort. Ils doivent passer doucement du bac d'éclosion au seau. Le mucus épidermique des poissons siphonnés trop brusquement peut être blessé gravement. Ainsi les risques d'une infection de myxobactéries (Flexibacter) sont énormément augmentés. Le seau avec les alevins est d'abord submergé, avec soin, dans le bac d'alevinage, préparé et désinfecté auparavant, après quoi on le vide doucement sous eau (fig. 5). Avant de débuter cette opération de transfert, l'opérateur et un aide doivent désinfecter le matériel ainsi que leurs mains, poignets et avant-bras.
Peuplement : Les alevins de 40 à 60 mg sont maintenus à un peuplement pouvant aller jusqu'à 20 milles par bac d'alevinage, contenant 120 Litres d'eau (une lame d'eau de 15 cm). Ainsi on peut placer les quelques 200.000 alevins dans 10 bacs d'alevinage à une densité de I alevin par 6 ml. Une fois que les alevins ont obtenu un poids moyen de 250 à 300 mg, on peut procéder de la façon suivante selon le modèle d'intensification de l'élevage choisi :
élevage intensif, c'est-à-dire on garde un cycle de reproduction à la fois. La densité maximale est diminuée à une densité de 5 à 10 milles alevins par bac. En même temps le volume d'eau est augmenté à 200 l (une lame d'eau de 25 cm) ce qui mène la densité à I alevin par chaque 20 à 40 ml d'eau. Les alevins, enlevés par siphonage de deux bacs jumeaux, sont placés dans un bac à reproducteurs, contenant 1000 l d'eau ce qui correspond à une colonne d'eau de 40 cm. Dans ce cas on obtient une densité de 20 à 30 milles par bac ou de I alevin par chaque 30 à 50 ml.
élevage surintensif, c'est-à-dire on garde plusieurs cycles de reproduction à la fois. Le contenu d'un ou d'un bac et demi d'alevinage est transféré dans un bac à reproducteurs, pour céder la place à une nouvelle production de jeunes frais
La densité est un facteur, jusqu'à présent, peu connu pour les C. Lazera et nécessite certainement d'être étudiée plus profondément. La figure 10 illustre la diminution de la croissance et l'augmentation des risques de mortalité en fonction de la densité.
Débilloxygène : Le débit en eau doit être réglé de façon à ce que la teneur en oxygène de l'effluent ne tombe jamais au-dessous de 3mg/l. Si la quantité d'eau requise pour toute l'écloserie n'est pas trop élevée compte tenu des besoins en eau liés au nombre de larves élevées, il est conseillé de la maintenir au-dessus de 4 mg/l. Dans le document technique no 20 : Propagation artificielle (Janssen, 1985) on a vu que le débit en eau peut être calculé avec la formule de Willoughby de la façon suivante :
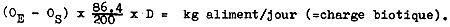
Le tableau I indique les quantités maximales d'aliment que l'on peut distribuer par bac en fonction des différents débits et différentes températures du milieu aquatique. Dans la pratique, ce tableau indique le débit en eau minimum pour une certaine quantité d'aliment calculée (voir para 3.3.2.) et une température donnée. Il est, toutefois de grande importance de mesurer le taux d'oxygène de l'effluent au moins une fois tous les 4–5 jours et de réajuster le débit en eau si nécessaire.
| température débit (l/mn) | 22 °C | 24 °C | 26 °C | 28 °C | ||||
| alimentation maximale (g) | ||||||||
| 6 | 240 | (190) | 225 | (180) | 215 | (170) | 205 | (165) |
| 8 | 320 | (255) | 300 | (240) | 285 | (230) | 275 | (220) |
| 10 | 400 | (320) | 380 | (300) | 360 | (280) | 340 | (270) |
| 12 | 480 | (385) | 455 | (365) | 430 | (345) | 410 | (330) |
| 14 | 555 | (445) | 530 | (425) | 505 | (400) | 480 | (385) |
| 16 | 635 | (510) | 605 | (485) | 575 | (460) | 545 | (440) |
| 18 | 715 | (575) | 680 | (545) | 645 | (520) | 615 | (490) |
| 20 | 795 | (635) | 755 | (605) | 720 | (575) | 685 | (545) |
Température, lumière, tranquilité et hygiène : Les mesures concernant ces facteurs, afin d'assurer une croissance optimale et une mortalité restreinte, sont identiques à celles décrites en détail ci-dessus pour l'élevage de larves (voir para 3.1.1.).
Qualité d'eau : Il est d'une grande importance, comme d'ailleurs pour chaque stade d'élevage dans le milieu contrôlé, que l'on assure une bonne qualité d'eau à partir du moment où l'eau rentre dans le bac à alevins jusqu'à ce qu'elle en sorte. Le schéma de nettoyage, qui se trouve ci-dessous, doit être exécuté très consciencieusement :
Ce nettoyage qui stresse les alevins, est exécuté une fois par jour tôt le matin. Ces alevins, moins sensibles au stress que les adultes, peuvent être nourris à partir de 11–12 heures. Il n'est pas nécessaire de nettoyer de cette façon l'après-midi. Il suffit de contrôler et d'observer, en toute tranquilité, les alevins qui doivent se trouver audessus de l'alimenteur (points 2, 3 et 4 du schéma). Il est seulement nécessaire de nettoyer doucement la crépine-écran et de siphonner les déchets sans perturber les poissons.
A partir des 10ème et 14ème jours on commence l'alimentation avec un aliment pour truites importé d'Europe (acheté avec la devise centrafricaine, le franc CFA, qui est convertible en francs français). Cet aliment est distribué à l'aide d'un distributeur automatique (cycle de 12 heures). De cette façon, il est possible de nourrir les alevins en permanence à partir d'environ midi jusquà 6h00 le matin. Le matin, quand la température de l'eau est la plus basse, on procède aux activités de nettoyage. Hogendoorn (1981) a démontré l'intérêt de nourrir les alevins en permanence au lieu de nourrir en une ou plusieurs fois dans la journée ou la nuit (fig. 8).
La première semaine de l'alimentation artificielle, on augmente progressivement la quantité d'aliment de façon à ce que les alevins s'habituent au niveau régime alimentaire. Pendant ce temps, on continue à nourrir avec les nauplié d'Artemia. Après environ une semaine on peut arrêter cette alimentation. Acce moment, l'alevin dépend complètement de l'alimentation artificielle, inerte qui doit lui apporter tous les éléments nécessaires à une bonne croissance en qualité et en quantité. Au début de cette phase délicate de changement alimentaire, la nourriture onéreuse importée convient le mieux. Il est très important, afin d'obtenir une croissance homogène pendant ce changement de vérifier constamment si les alevins se nourrissent à satiété. Sinon, il faudrait augmenter l'alimentation artificielle et/ou l'aliment vivant.
Une fois que les alevins ont obtenu un poids moyen d'environ 250 mg, on peut les nourrir avec l'aliment pour alevins préparé à la station à partir des ingrédients agro-chimiques locaux. Le document technique no 23 : Alimentation (Janssen, 1985) décrit en détail la composition et la préparation de cet aliment artificiel.
La quantité d'aliment importé nécessaire afin d'obtenir une croissance optimale est relativement faible (2 kg pour 10.000 alevins) et ne met en aucun cas la gestion de l'écloserie en danger.
Le tableau 2 indique les quantités journalières de l'aliment comlet artificiel, exprimées en pourcentage de la biomasse, en fonction du poids moyen des alevins et de la température. Plus on approche du la température optimale pour l'élevage d'alevins (30°C), plus la quantité que les alevins peuvent consommer augmente.
| poids moyen (mg) | 50 | 250 | 500 | 1000 |
| température (°C) | ||||
| 21 | 6.8 | 4.9 | 4.2 | 3.7 |
| 23 | 9.6 | 6.9 | 6.0 | 5.1 |
| 25 | 12.2 | 8.8 | 7.6 | 6.7 |
| 27 | 13.9 | 10.0 | 8.6 | 7.4 |
| 29 | 14.8 | 10.7 | 9.2 | 7.9 |
Une fois connus la température de l'eau (thermomètre mini-maxi), le poids moyen (déterminé chaque 4–5 jours, et ajusté pour les jours suivants), et la biomasse (estimée à partir du poids moyen connu et le nombre d'alevins estimés), on peut facilement calculer la ration alimentaire à l'aide du tableau 2 (voir Annexe 3). Il est d'une très grande importance de vérifier la consommation de la nourriture (l'après-midi est le moment idéal pour cette observation) et éventuellement d'ajuster l'estimation du nombre d'alevins.
L'alimentation, comme toutes les activités, est enregistrée sur la fiche du premier élevage, avec soin, tous les jours,
Une fois que les alevins sont alimentés avec l'aliment complet, les différences de taille, déjà existantes depuis le début de l'élevage du jeune frai, s'accentuent. Une alimentation correcte en quantité est essentielle. Une sous-alimentation favorise la différence de taille par une concurrence alimentaire accrue. Cette concurrence, stimulée par la distribution d'aliments avec les distributeurs automatiques, a un effet positif sur la consommation de la nourriture à condition que les alevins ne soient pas sous-alimentés,
Les C. Lazera ont un régime alimentaire omnivore avec une nette tendance prédatrice. En milieu contrôlé où les poissons-chats sont élevés à une très forte densité, les gros sujets n'ont aucune difficulté gaver des poissons dont la croissance est retardée.
Il est primordial afin d'éviter des pertes considérables, dues à ce canibalisme, d'enlever régulièrement les quelques gros sujets. Cette sélection est facilitée par des grillages de mailles différentes utilisés à cette fin.
La figure 9 montre les courbes de croissance des alevins nourris avec uniquement l'aliment pour truite importé et avec l'aliment local à partir de 250–300 mg (température moyenne 24–26°C). Les alevins nourris avec l'aliment importé atteignent un poids moyen d'environ 1 g après 5–6 semaines tandis que ceux nourris avec l'aliment local à partir de 250–300 mg ont besoin de 7–8 semaines pour obtenir le même résultat. L'Annexe 4, indiquant la croissance par semaine, peut être utilisée en pratique pour vérifier la croissance des jeunes poissons. Si la croissance obtenue est inférieure à celle indiquée, le. responsable doit d'abord vérifier la température, facteur déterminant pour la croissance des poissons, avant de contrôler les points mentionnés dans le schéma de nettoyage (para 3.3.1, point 5).
Le tableau ci-dessous regroupe les plus importants paramètres de l'élevage de jeunes poissons obtenus en écloserie en RCA.
| poids moyen (mg) | Alimentation | taux de conversion | mortalité (%) | durée (jours) | |
| type | quantité (kg/10.000) | ||||
| 1 à 3 | - | - | - | 20 | 0–4 |
| 3 à 50 | Artémia | 0.5 | ? | 0 | 5–14 |
| 50 à 250 | Trouvit | 2.0 | 1.0 | 10 | 15–26 |
| 250 à 1000 | Mel. 50 | 11.3 | 1.5 | 27–52 | |
| Total | 30 | 52 | |||
Le nombre d'alevins élevés par cycle est calculé de la façon suivante :
| potentiel d'incubation | 800 g |
| nombre d'oeufs par gramme | 500 à 700 |
| nombre d'oeufs (600 × 800) | 480.000 |
| nombre de larves (50 %) 50/100 × 480.000 | 240.000 |
| nombre de jeunes frais (80 %) 80/100 × 240.000 | 192.000 |
| nombre d'alevins (90 %) 90/100 × 192.000 | 173.000 |
Le tableau 5 montre le calcul du prix par alevin en fonction de la demande d'alevins par le service de vulgarisation :
Tableau 5 : Calcul du prix de revient par alevin par rapport à la production annuelle (prix en FCFA)
a) Calculé sur les coûts de fonctionnement
| production annuelle en millions | 0.25 | 0.50 | 1.00 | 2.00 |
| activité | ||||
| Personnel | 4.7 | 2.3 | 1.2 | 0.6 |
| Transport | 3.3 | 1.7 | 0.8 | 0.4 |
| Electricité | 1.7 | 0.8 | 0.4 | 0.2 |
| Aliment vivant (Artémia) | 1.4 | 1.4 | 1.4 | 1.4 |
| Aliment complet | 1.3 | 1.3 | 1.3 | 1.3 |
| Divers | 0.3 | 0.5 | 0.9 | 1.8 |
| TOTAUX | 12.7 | 8.0 | 6.0 | 5.7 |
b) Calculé sur l'ensemble des coûts
| production annuelle en millions | 0.25 | 0.50 | 1.00 | 2.00 |
| Activité | ||||
| Coûts fixes | ||||
| Bâtiments (30 Ans) | 4.4 | 2.2 | 1.1 | 0.6 |
| Installation (15 Ans) | 11.9 | 5.9 | 3.0 | 1.5 |
| Coûts de fonctionnement | 12.7 | 8.0 | 6.0 | 5.7 |
| Totaux | 29.0 | 16.1 | 10.1 | 7.8 |
A l'heure actuelle, l'écloserie produit entre 300 et 500 milles alevins. Ces alevins sont vendus à 10 FCFA par pièce.