Aunque la carpa común se propaga en aguas estancadas, su hábitat natural de reproducción son las llanuras anegadas y las tierras inundadas, donde el agua rica en oxígeno, la subida del nivel del agua y las hierbas inundadas estimulan el desove. En ese hábitat sus enemigos son pocos, los alevines pueden encontrar alimentos en abundancia y los índices de supervivencia son buenos. Las temperaturas ideales para el desove de la carpa común son 18°–22°C.
Por otro lado, en los estanques hay muchos enemigos microscópicos que representan una amenaza para la supervivencia de la puesta. Es interesante notar que la carpa común no desova en estanques en los que se encuentran otros tipos de peces, especialmente carnívoros. Sin embargo, en los estanques de reproductores algunas hembras desovan sin estímulo alguno e incluso sin que haya machos presentes, especialmente durante la segunda mitad de la temporada de desove.
La propagación estimulada artificialmente de la carpa común tiene lugar en estanques especiales de desove, o estanques Dubisch, como se ha descrito anteriormente. Si están bien maduras y la temperatura es adecuada, las carpas desovan de ordinario al día siguiente de haber sido puestas en el estanque durante las primeras horas de la mañana. El instinto de propagación de esta especie parece ser más fuerte en las regiones tropicales y subtropicales, donde desovan más fácilmente.
La carpa común desova incluso en estanques muy pequeños (25–30 m2), sobre esterillas de hierbas o kakabans, que sirven de colectores de huevos. La esterilla, con los huevos esparcidos sobre ella, puede trasladarse luego a los estanques de incubación.
En los lagos, la carpa común se propaga cuando las fuertes lluvias causan una subida del nivel de las aguas y se inundan las zonas próximas cubiertas de hierba. La captura de carpas comunes mientras desovan en grandes grupos en frezaderos poco profundos, para obtener luego sus productos sexuales artificialmente, tiene ya una larga historia.
Cuando no se conocía aún la manera de disolver la capa adhesiva que recubre los huevos, los huevos de carpa común, mezclados con semen, solían distribuirse sobre la superficie de un nido artificial utilizando un colador o espumadera con orificios de 2,0–2,5 mm (Figura 76) y a continuación se incubaban en cestas o cámaras de rociado. A veces los huevos se distribuían por las zonas herbosas de un estanque recién inundado.
Con la hipofisación de la carpa común se obtienen resultados satisfactorios en un 60–70 por ciento de los casos. Pero los resultados serán mucho peores si no se suministran a los peces cantidades suficientes de alimentos ricos en proteínas. La ovulación de la carpa común es total: es decir, todos los huevos ovulan al mismo tiempo y, por tanto, la hembra puede vaciarse de huevos en una sola operación. Sin embargo, en las hembras grandes, de más de 7–10 kg, la ovulación puede ser intermitente y es preciso proceder al desove artificial a intervalos de 1 h durante 5–8 h.
El desove de la carpa común puede inducirse por hipofisación, colocando las carpas en tanques muy pequeños o cajas de paño de red (hapas), donde tiene lugar la puesta. Si no hay colectores, los huevos se adhieren a las paredes del tanque o hapa. Colocando en el tanque colectores de huevos, como esterillas de hierba o plantas acuáticas, se consigue una mejor propagación.
Antes de que empezara a aplicarse la técnica de sutura de la apertura genital de las hembras, era necesario vigilar atentamente el tanque de espera para sacar las hembras que ovulaban y proceder al desove artificial.
La disolución de la capa adhesiva, la sutura de las hembras, la producción de primeros alimentos para los alevines y el control de los enemigos naturales han hecho que la propagación de la carpa común sea una operación fácil y extremamente fructuosa, con lo que esta especie ha pasado a ocupar el primer lugar entre las especies cultivadas en todo el mundo.
Técnicas similares de propagación se han adoptado para otros ciprínidos europeos, incluida la carpa carnívora Aspius aspius.
Las principales carpas chinas son la carpa herbívora (Ctenopharyngodon idella), la carpa plateada (Hypophthalmichthys molitrix) y la carpa de cabeza grande (Aristichthys nobilis). Todas desovan en los ríos y ponen huevos flotantes y no adherentes, que se dilatan considerablemente porque tienen un espacio perivitelino muy grande. Cuando es posible simular el hábitat fluvial, puede conseguirse el desove de reproductores maduros en tanques suministrándoles previamente una inyección de pituitaria de pez o de gonadotrofina coriónica humana. Pero de ordinario sólo es posible inducir la ovulación, y los productos sexuales han de obtenerse artificialmente fertilizando luego los huevos también artificialmente. El desove inducido más fácil de conseguir es el de la carpa herbívora, y el más difícil el de la carpa plateada. El desove espontáneo completo de las carpas chinas casi nunca se consigue. Puede suceder que la hembra ponga sólo el 50–70 por ciento de los huevos, mientras el resto (30–50 por ciento) se perderán a menos que se proceda a tiempo al desove artificial.
La técnica utilizada en China para inducir el desove y recoger los huevecillos ya se ha descrito en una sección anterior. Para inducir el desove de las carpas chinas se utiliza de ordinario GCH, pero puede utilizarse también con buenos resultados una mezcla de extracto de glándula pituitaria y GCH. Los mejores resultados se obtienen inyectando a los reproductores dos dosis iguales a distancia de 6 h.
Cuando se procede al desove artificial y los huevos se fertilizan artificialmente en un cuenco, se utiliza el sistema de doble inyección: una preparatoria y otra decisiva. Se suministra primero un 10 por ciento de la dosis calculada y el 90 por ciento restante se inyecta a las 18–24 h. Las dosis para las carpas chinas se establecen sobre la base del peso y la circunferencia del cuerpo en la parte más gruesa (Figura 77).
Es importante conocer exactamente cuando se produce la ovulación, pues un retraso en el desove artificial puede determinar una maduración excesiva de los huevos en el ovario.
El proceso de ovulación depende de la temperatura del agua en que se halla la hembra. Como ya se ha explicado, el intervalo entre la inyección decisiva y la ovulación en relación con la temperatura se expresa en horas-grados. Cuando la temperatura está dentro de los valores óptimos, las horas-grados son 200–220 aproximadamente, mientras disminuyen cuando las temperaturas son superiores (20°–26°C) y aumentan cuando son inferiores. La ovulación de la carpa china se produce a las 9–11 h de la inyección decisiva.
La fertilización de los huevos de las carpas chinas no plantea ningún problema, porque se trata de huevos no adherentes. Es necesario evitar corrientes fuertes en la vasija de incubación, porque pueden perjudicar a los huevos, que tienen una membrana muy delicada. Sometiendo los huevos a un tratamiento de tanino se evitarán ataques de bacterias y hongos.
La eclosión que con temperaturas de 22°–24°C se produce a las 24–32 h de la fertilización, puede acelerarse utilizando una enzima proteolítica alcalina.
Las larvas de carpa china nadan verticalmente durante el primer día y es fácil, por tanto, separarlas de las membranas de los huevos, los huevos maleados y los desechos, dejando que salgan por sus propios medios de la vasija de incubación. Si el tipo de incubadora no permite emplear ese procedimiento, es preciso sacarlas con un sifón o con un salabre, ya que en caso contrario pueden quedar entremezcladas con los desechos y perecer. Durante el segundo día las larvas reposan en el fondo, nadando sólo ocasionalmente. En ese período desarrollan varios órganos que les permiten respirar, nadar y alimentarse “como los peces”.
Los depredadores microscópicos, como Cyclops, son muy perjudiciales para las larvas de carpa china y, si no se toman medidas para erradicarlos o evitar que proliferen, pueden matar centenares de larvas. Durante el cuarto o quinto día, las larvas hinchan su vejiga natatoria. Los primeros alimentos de las larvas son protozoos y rotíferos y al cabo de una semana, aproximadamente, empiezan a consumir crustáceos, cada vez en mayor cantidad.
Los alevines de las carpas chinas son muy resistentes, a diferencia de los de la carpa común, que son muy sensibles. En 3–4 semanas, los alevines alcanzan 2,5–3,5 cm de longitud.
Las principales carpas indias son catla (Catla catla), rohu (Labeo rohita), mrigal (Cirrhinus mrigala) y kalbasu (Labeo calbasu). Desovan de ordinario en zonas inundadas próximas a las orillas de los ríos y ponen huevos semiflotantes y no adherentes.
La propagación semiartificial de las principales carpas indias se hace en los llamados “bundhs”, que son estanques de tipo especial en los que se simulan las condiciones fluviales. De ordinario se construyen a lo largo de la pendiente de un terreno ondulado, cerrándola con terraplenes. Reciben así cantidades considerables de agua de lluvia, que afluye a ellos de toda su vasta zona de captación, después de las precipitaciones. Los bundhs están provistos de desagües para eliminar el agua sobrante y de zonas poco profundas para frezaderos.
Los bundhs pueden ser de dos tipos: a) perennes o “húmedos” y b) estacionales o “secos”.
a) Bundhs húmedos. Son estanques perennes ya existentes y adecuadamente situados o estanques perennes construidos cerrando con un terraplén la pendiente de una vasta zona de capacitación. La parte más profunda del estanque conserva agua durante todo el año, mientras la zona somera marginal se seca durante la estación de estiaje. La zona somera se inunda con las aguas que afluyen después de las precipitaciones durante la estación de las lluvias. Los reproductores se crían en el estanque perenne mismo o se sueltan en él cuando comienza la estación de las lluvias, tomándolos de otros estanques. La afluencia de grandes cantidades de agua de lluvia, bien oxigenada y cargada de cieno, estimula el desove, que se produce naturalmente. Para evitar que los reproductores escapen, el desagüe se cubre con una rejilla de bambú o una tela metálica.
b) Bundhs secos. Son estanques estacionales poco profundos, de dimensiones mucho menores que los bundhs húmedos. Hoy día se tiende a construir los bundhs secos en terrenos apropiados. El agua se acumula en los bundhs con las primeras lluvias y entonces se pasan a ellos reproductores ya maduros procedentes de estanques perennes. El desove comienza, de ordinario, cuando el bundh se llena de agua de lluvia después de una precipitación intensa. La principal ventaja de los bundhs secos respecto de los bundhs húmedos es que en ellos es posible el desove selectivo de cualquiera de las principales especies de carpas para obtener semilla sin mezcla.
En ambos tipos de bundhs, la entrada de agua de lluvia bien oxigenada y cargada de cieno y la inundación de terrenos antes descubiertos son los principales factores que favorecen un buen desove.
Para proceder a la hipofisación de las principales carpas indias se empieza por colocar un hapa en el estanque. A continuación se ponen en él los reproductores seleccionados (una hembra y dos machos), después de inyectar a la hembra 2–3 mg de glándula pituitaria por kg de peso. Al cabo de 6 h se administra a la hembra una segunda dosis de 5–8 mg/kg de peso y se inyecta a los machos una dosis de 2–3 mg/kg de peso. El desove se produce de ordinario de 3 a 6 h después de la segunda inyección.
Los huevos fertilizados se sacan para colocarlos en un hapa de incubación. Los huevos de las principales carpas indias pueden incubarse fácilmente en cualquier incubadora en forma de embudo. El período de incubación de los huevos varía de 15 a 18 h con temperaturas de 27°–31°C. Esta técnica da excelentes resultados sobre todo con las carpas rohu y catla.
La demanda de oxígeno de las carpas indias inyectadas no es muy elevada y ello hace posible inducir el desove en un hapa, donde el intercambio de agua es escaso y no llega agua corriente.
El desove inducido de carpas indias puede obtenerse en tanques de espera con flujo continuo de agua. Puede emplearse también el desove artificial para producir huevos fertilizados, como se hace con las principales carpas chinas.
El bagre de canal puede propagarse dejándolo desovar en corrales y por hipofisación.
El desove en corrales se utiliza muy frecuentemente en el cultivo del bagre de canal y podría adoptarse también para otros peces que desovan en estanques o para los que desovan en nidos o en receptáculos. Los corrales se colocan en estanques o en cursos de agua que fluyan lentamente. De ordinario se colocan en hileras y sus dimensiones suelen ser 1,5–2,0 m de anchura, 2,5–3,5 m de longitud y 1 m de profundidad. Los corrales se construyen con tablas y red metálica anticorrosiva de 2,3–5,0 cm de malla. La parte inferior del corral penetra en el fondo del estanque y la parte superior sobresale 30–50 cm sobre el nivel del agua. Luego se sujetan en el fondo lecheras de 45 l o pequeños tambores abiertos por un lado, que sirven de receptáculos para el desove.
Durante la temporada de desove, se coloca una pareja de peces (un macho y una hembra) en cada corral. Es muy importante, pues, distinguir bien los sexos de los reproductores. Luego, los receptáculos de desove deben inspeccionarse todos los días o, al menos, a días alternos. Después de la puesta, se deja en el corral al macho, para que cuide de los huevos o se recoge la masa de huevos y se coloca en aparatos de incubación. Para la incubación suelen utilizarse artesas con paletas montadas sobre un eje, para remover el agua.
Los alevines que nacen dentro de un corral o receptáculo pueden salir nadando al estanque, a través de la red metálica, y en el corral pueden colocarse otros dos reproductores para que desoven. Las temperaturas favorables para el desove del bagre de canal van de 21° a 29°C y la temperatura óptima es 26°C.
El desove del bagre de canal puede inducirse, incluso en acuarios, suministrándole dosis adecuadas de extracto de hipófisis o GCH. Si se emplea extracto de pituitaria, se administran 12 mg de glándula secada en acetona por kg de peso, distribuidos en tres dosis iguales inyectadas a intervalos de 24–48 h. La mayoría de los peces inician el desove de 16 a 24 h después de la última inyección. La incubación se hace en general en incubadoras mecánicas, donde el agua se agita con palas rotatorias. La eclosión se produce a los 6 días, aproximadamente, con temperaturas de 25°–27°C.
Es posible anticipar el desove del bagre de canal algunas semanas suministrándole extracto de pituitaria o GCH.
Los alevines empiezan a comer a los 3–5 días y es muy importante que entonces dispongan de alimentos adecuados. En los Estados Unidos pueden encontrarse en el mercado varios tipos de alimentos artificiales para alevines de bagre de canal. Durante la primera semana los alevines necesitan comer cada 2–4 h, a lo largo de las 24 h del día. Posteriormente basta darles alimentos cuatro veces al día. Los alevines que no aprenden a comer en los primeros días después de haberse reabsorbido la vesícula vitelina no consiguen sobrevivir.
Los alevines se crían de ordinario en artesas o estanques. Las artesas pueden construirse de madera, metal, fibra de vidrio o plástico y tienen 2,5–3,0 m de longitud, 30 cm de profundidad y 50 cm de anchura. Todas deben tener agua corriente y han de estar dotadas de un desagüe y un tubo vertical con filtro. Cada artesa recibe unos 20 l de agua limpia bien oxigenada por minuto.
Los alevines permanecen en las artesas hasta que se convierten en jaramugos, o se trasladan a estanques para que crezcan en ellos. Los estanques suelen tener una superficie de 4 000–5 000 m2. Los insectos depredadores constituyen a menudo un problema en los estanques de alevinaje. Los daños causados por los insectos pueden prevenirse si no se llena el estanque hasta el momento de sembrar los alevines. Si el agua ha estado estancada por varios días hay que tratarla con un insecticida que no deje residuos dos o tres días antes de echar en él los alevines. Otro sistema muy utilizado consiste en echar dos veces en el estanque, durante la semana precedente a la siembra de los alevines, 20–40 l de aceite diesel o kerosene por cada hectárea de superficie de agua, aprovechando para ello días en los que no sople viento.
El índice de siembra en los estanques de alevinaje es de 100 000–500 000 por hectárea. Los pececillos han de recibir cada día alimentos equivalentes a un 4–5 por ciento de su peso corporal. La talla de los jaramugos criados en estanque depende de la intensidad de la alimentación y del índice de siembra.
Los sistemas utilizados en Europa para el cultivo del siluro constituyen claros ejemplos de la aplicación o adopción de técnicas diferentes según las instalaciones disponibles.
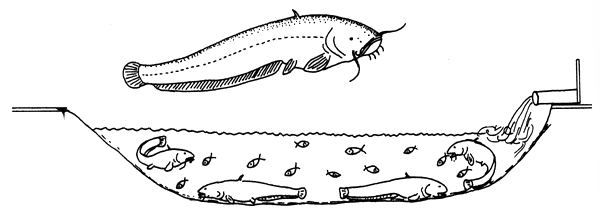
El siluro desova en aguas estancadas o en terrenos inundados. De ordinario pone los huevos en raíces suspendidas en el agua o en plantas acuáticas, es decir, en un nido. Los huevos son adherentes y cuelgan del nido en racimos.
Los reproductores han de recibir alimento abundante. El siluro es carnívoro y se alimenta de pececillos, ranas, renacuajos, etc. Sin embargo, acepta también fácilmente alimentos granulados. Mientras se prepara a los reproductores para el desove es preciso alimentarlos diariamente con pececillos (morralla) en cantidades equivalentes a 2,5–3,0 veces su peso corporal.
Cuando la temperatura es de unos 12°–15°C es preciso separar los peces de ambos sexos; de no hacer así, los machos muerden a las hembras causándoles graves heridas (Figura 78).
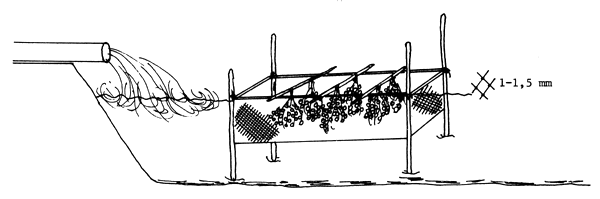
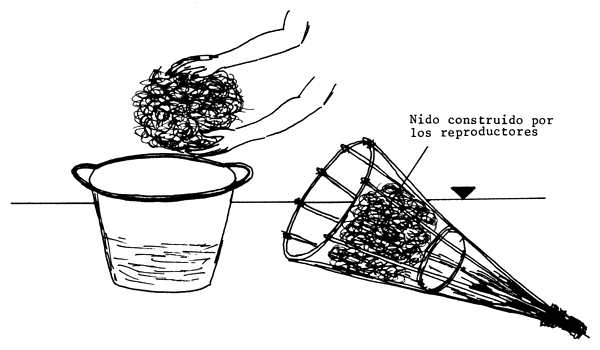
En el fondo de los estanques, que debe ser duro, se colocan nidos hechos con ramas en forma de tienda india y se sueltan en el estanque tantas parejas de reproductores cuantos nidos se hayan colocado. Los peces desovarán al cabo de pocos días, de ordinario en las primeras horas de la mañana. Antes del desove, los machos limpian el nido. Siguen luego algunos juegos sexuales, durante los cuales los reproductores nadan alrededor del nido, y se llega así a la puesta. Los huevecillos quedan confiados a la custodia del macho. Para facilitar la eclosión es preciso desmantelar los nidos y colgar las ramas cargadas de huevos dentro de una caja de paño de red (1,0–1,5 mm de malla) colocado cerca de la zona de entrada del agua al estanque (Figura 79).
En esas cajas se alimenta a los alevines con plancton. A veces se les dan también alimentos artificiales preparados especialmente con huevos duros, carne de pescado y harina. La mezcla así preparada se extiende sobre la pared lateral de un tiesto o sobre una bandeja negra, que se coloca dentro de la caja de alevinaje. Los alimentos sobrantes deben retirarse antes de que comience la putrefacción.
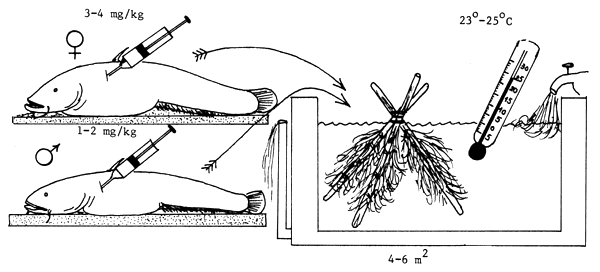
El desove del siluro puede inducirse inyectándole extracto de glándula pituitaria a razón de 3,5–4,0 mg de hipófisis secada en acetona por kg de peso. A los machos se les administra sólo la mitad de esa dosis. Tanto los machos como las hembras reciben la dosis que les corresponde en una sola inyección. Se coloca un nido en forma de tienda india en un pequeño tanque de cemento (4–6 m2) bien abastecido de agua y se suelta en el tanque una pareja de reproductores inyectados. Los peces desovan al día siguiente, si la temperatura es de 23°–25°C. Los huevos se incuban en cajas de incubación, incubadoras en forma de embudo, vasijas o artesas (Figura 80).
Una vez que han llegado a la piscifactoría, se calma a los peces poniéndolos en una solución de MS 222 en proporción 1:12 500 (es decir, 4 mg de MS 222 en 50 l de agua). Se cose la boca de los reproductores de ambos sexos con hilo sintético, haciendo previamente un pequeño orificio en los labios, para evitar que se muerdan. El hilo no ha de apretarse mucho, para permitirles respirar normalmente (Figura 81). A continuación se suministran al macho y a la hembra, en una sola inyección, las cantidades oportunas de extracto de pituitaria (3,5 mg de glándula secada en acetona por kg de peso a las hembras y mitad de esa dosis a los machos. De ordinario la inyección se hace al mediodía, y el desove artificial a la mañana siguiente, en las primeras horas. Las horas-grados para la ovulación de estos peces son 430–460. A diferencia de las carpas chinas, no hay peligro de que los huevos maduren en exceso en poco tiempo.
Después del desove artificial se procede a la fertilización, que se hace en una solución de sal común al 0,3 por ciento. Como los huevos son muy sensibles, no se deben mezclar enérgicamente durante la fertilización. Si los machos no producen suficiente semen, se abre uno de ellos, se extirpa medio testículo y se cose la herida. (El macho se recuperará y sobrevivirá.) Se tritura el medio testículo extirpado y se utiliza el semen obtenido para la fertilización. La fertilización de los huevos se produce al cabo de 2–5 min, después de lo cual han de colocarse en una incubadora adecuada.
Al cabo de 10–12 h se trata la masa de huevos con una solución de enzima proteolítica alcalina al 0,3–0,5 por ciento durante 2–3 min, para disolver la capa adherente que recubre los huevos; de esa manera los huevos se separarán y quedarán libres. Durante este tratamiento ha de interrumpirse el flujo del agua y los huevos han de removerse con una varilla, para facilitar la separación. Los huevos se tratan también contra los hongos, sumergiéndolos en una solución de verde de malaquita de 5 ppm durante 30–60 min.
Cuando comienza la eclosión, se sacan los huevos de la incubadora y se colocan en bandejas llanas, donde todos los huevos harán eclosión.
Las larvas se crían en cajas de tela de cedazo de 0,8–1,0 mm de luz. Como las larvas mueven el agua a su alrededor con enérgicos movimientos de la cola, no hay peligro de sofocación (cosa muy común entre las larvas de otros peces).
Los alevines, cuando empiezan a comer, son de color gris y se alimentan de plancton o de Tubifex picados. También comen ávidamente el amasijo artificial antes mencionado, que ha de extenderse sobre un tiesto o una bandeja negra colocados dentro del recipiente de cría (Figura 82). Es necesario proporcionarles algún lugar donde puedan esconderse, para evitar que se agiten nadando nerviosamente.
Cuando tienen dos o tres semanas y 2–3 cm de longitud, los alevines se echan en estanques donde haya lugares suficientes para esconderse y peces menores que les sirvan de alimento.
La tenca desova en aguas estancadas, esparciendo sus huevecillos, muy pequeños y adherentes, sobre la vegetación sumergida. La posibilidad de utilizarla para devorar detritus, con lo que ocupa un nicho propio en las operaciones de policultivo, ha determinado el interés por su propagación artificial.
La tenca alcanza la madurez sexual cuando pesa más de 300 g. Durante el desove es preciso separar los sexos para evitar que la puesta se haga desordenadamente. La separación de los sexos es sencilla, porque hay una clara diferencia en las aletas pélvicas de los dos sexos: el segundo radio de la aleta pélvica de los machos es fuerte y curvo (Figura 83).
La tenca responde a la ovulación inducida cuando la temperatura del agua es de 23°–24°C. A las hembras de unos 300 g de peso se les administran 9–10 mg de extracto de glándula pituitaria secada en acetona en una única inyección, que se hace en la cavidad ventral, por debajo de la aleta pélvica. A los machos de la misma talla se les administran sólo 6 g de extracto de pituitaria. Se ponen luego los peces de ambos sexos, juntos en el tanque de espera, donde el desove y la eyaculación se producen simultáneamente. Las salpicaduras de agua que se notan en el tanque señalan que ha comenzado la puesta.
A los 5–10 min de comenzar el desove, se saca a los machos y las hembras del tanque y se procede al desove artificial. Una hembra de 300 g da 30–50 g de huevos secos y un macho produce 3–5 gotas espesas de semen. Los huevos son adherentes. Igual que en el caso de la carpa común, se utilizan una solución de sal común para la fertilización y una solución de carbamida para disolver la capa adhesiva que recubre los huevos. Al cabo de 1½ h se tratan los huevos con una solución de tanino al 0,05 por ciento (5 g de tanino en 10 l de agua).
Los huevos se incuban en recipientes de vidrio (vasijas Zoug) o en embudos de plástico de ángulo agudo, porque son muy pequeños y pesados. Los huevos hacen eclosión al tercer día, con temperaturas de 22°–23°C. Las larvas, muy pequeñas, se recogen en aparatos en forma de embudo con una banda de tela de cedazo de 150–200 micras de malla.
Las larvas aspiran aire al quinto o sexto día. El primer alimento de los alevines de tenca son los rotíferos. La técnica de cría de los alevines de tenca es similar a la utilizada para los alevines de carpa común.
El lucioperca es un pez carnívoro importante en los estanques piscícolas y en las aguas naturales. Desova felizmente en aguas estancadas, depositando los huevos sobre materiales fibrosos, en nidos o sobre piedras, que el macho limpia antes de la puesta. El desove se produce generalmente en aguas a 9°–12°C de temperatura.
Para obtener huevos en aguas naturales, se tienden en los frezaderos cabos de más de 1 km con nidos artificiales colgantes, que se controlan cada dos o tres días. Los nidos cubiertos de huevos se trasladan para la incubación a una zona tranquila del lago, donde se colocan en cestas colgadas en el agua, o se llevan a un estanque en el que no haya otros peces. Los huevos pueden incubarse también en cámaras de rociado, en las que se obtienen resultados excelentes, con índices de eclosión del 100 por ciento en algunas ocasiones.
Para conseguir que desoven en pequeños estanques de fondo duro se colocan reproductores de ambos sexos en igual número y se prepara un nido para cada pareja.
Los nidos llenos de huevos pueden transportarse sin problemas a grandes distancias colocándolos en algodón o musgo húmedo. Pueden resistir el viaje porque tienen una doble membrana protectora. El transporte de los huevos es el mejor sistema para la distribución de estos peces, ya que los juveniles y los adultos son muy sensibles y difícilmente sobreviven al transporte a grandes distancias.
El desove inducido por hipofisación no ha dado resultados satisfactorios hasta ahora. Los peces tratados con hormonas adelgazan rápidamente y adquieren una coloración oscura; la muerte sobreviene a las pocas semanas.
Las larvas, que nadan verticalmente, no han de estar expuestas a la luz solar directa, que trastorna su equilibrio y llega a causarles la muerte. También los alevines, cuando empiezan a comer, deben mantenerse a la sombra, porque la luz viva les ciega y no pueden localizar sus presas. Aunque los alevines pueden alimentarse de crustáceos de 0,5 mm de talla cuando empiezan a comer, crecen mejor si durante la primera semana se alimentan de rotíferos. Cuando tienen aproximadamente un mes de edad, se producen casos de canibalismo si hay escasez de alimentos.
El gurami gigante desova en estanques, construyendo nidos que el macho vigila mientras airea los huevos. Su propagación puede inducirse colocando en estanques con agua limpia y de la profundidad adecuada material para los nidos y bastidores sobre los que puedan construirlos.
A pesar de los cuidados que los padres les prodigan, el índice de supervivencia de los huevos en condiciones naturales es bajísimo, debido a la acción destructiva de sanguijuelas, larvas de insectos y pequeños cangrejos, a la contaminación del agua dentro del nido y a las fluctuaciones del nivel del agua en el estanque. Por ello, para obtener mejores resultados es preciso recoger los huevos depositados en los nidos e incubarlos bajo control.
Los estanques de desove para el gurami gigante han de tener unos 300–500 m2 de superficie y 1 m de profundidad. Se echa un pez reproductor por cada 7–10 m2 de superficie del estanque y dos hembras por cada macho. Si se echan muchos machos al estanque, lucharán entre sí y se herirán mutuamente.
Los bastidores para los nidos tienen forma de embudo y se construyen con tiras de bambú o varillas. La longitud del bastidor ha de ser de 75–90 cm y el diámetro del embudo, en la boca, de 30–35 cm. El bastidor se clava en la pared del estanque, de manera que quede casi horizontal, a unos 15–20 cm por debajo de la superficie del agua, con la boca orientada hacia el centro del estanque. Puede también amarrarse, en posición horizontal, a dos varas clavadas en el fondo del estanque (Figura 84). Dentro del bastidor y en el agua, a su alrededor, se esparcen materiales fibrosos para la construcción del nido. En cada estanque se colocan diez bastidores. Cuando los reproductores llegan al estanque, recogen el material esparcido y construyen un nido circular dentro de la cavidad del bastidor.
Los nidos han de inspeccionarse regularmente para ver si hay huevos fertilizados. Apenas ha terminado el desove, se separan los nidos del bastidor y se recogen los huevos. Pueden así introducirse en el estanque nuevos reproductores, asegurando un aprovisionamiento regular de huevos.
Para separar los huevos del nido, se despega suavemente este último del bastidor y se pone en un cubo de agua, separando luego con cuidado las fibras exteriores. Los huevos, que son flotantes, se encuentran en el centro del nido, cuyas fibras han de eliminarse capa a capa. Cada una de las capas retiradas se sumerge en un recipiente con agua durante algún tiempo, hasta que los huevos asciendan a la superficie. Se recogen luego los huevos con un cuenco y se transportan rápidamente, en un recipiente con agua limpia de estanque, para proceder a la incubación y a la cría de las larvas que nazcan. Si hay que transportarlos a gran distancia, los huevos se colocan en bolsas de plástico con oxígeno a presión.
Los huevos son de color amarillo y casi transparentes y miden 2,5 mm de diámetro. El vitelo es fluido y tiene un glóbulo de aceite, al que se debe la flotabilidad. Los huevos hacen eclosión a las 48 h en aguas a temperatura de 28°C.
Para que los huevos hagan eclosión han de estar en tanques o acuarios aireados con una corriente lenta de burbujas de aire. En los tanques se colocan plantas acuáticas, como Hydrilla y Ceratophyllum, para que las larvas recién nacidas puedan adherirse a ellas y reposar.
Las larvas recién nacidas permanecen cabeza abajo, con la vesícula vitelina apuntando hacia arriba. Al cabo de algún tiempo se adhieren a plantas u otros objetos y apenas se mueven. Al quinto día de la eclosión asumen su posición natural de peces y empiezan a comer pequeños organismos, como Infusoria (ciliados).
Las larvas suelen alimentarse con cultivos de Paramecium, que se preparan en la piscifactoría. A los diez días de haber comenzado a comer, se da a los alevines zooplancton pequeño.
Los alevines crecen bien en estanques ricos en zooplancton, cuya proliferación puede favorecerse con estiércol de vaca. Los estanques de alevinaje se siembran con unos 200 alevines desarrollados por m2. Al cabo de 4–6 semanas miden 6–8 cm de longitud, con índices de crecimiento que dependen de la cantidad y calidad de los alimentos a su disposición.
El sistema tradicional de cultivo del mújol consiste en capturar juveniles, que forman cardúmenes en los estuarios y aguas costeras unos dos meses después de que los adultos han desovado en alta mar.
Para la propagación artificial, los reproductores se obtienen generalmente de granjas piscícolas de aguas salobres o pescándolos en aguas naturales durante su migración hacia los frezaderos. Los reproductores se ceban con alimentos ricos en proteínas en pequeños estanques de agua salada situados al aire libre. Requisito esencial para el desove es un prolongado acondicionamiento de los reproductores en agua con una concentración de sol de 32–35 partes por mil.
Las hembras maduras se trasladan luego a pequeños tanques bajo techo, en los que la temperatura del agua se mantiene a unos 20°–22°C. Al principio se toman muestras de las gónadas de las hembras (si es necesario) a intervalos de una semana, y luego todos los días, a medida que los huevos vayan madurando. Para ello se introduce una cánula de polietileno de 0,85 mm de diámetro en el oviducto y se retira una muestra de los huevos. El diámetro medio de los huevos indica su grado de maduración. Se considera que la hembra está lista para inyectarle hormonas cuando el diámetro medio de los huevos es al menos de 0,6 mm.
La dosis y la secuencia de la administración de hormonas depende del tipo de hormonas disponible y del desarrollo de los huevos. Si se emplea gonadotrofina de salmón purificada, la dosis total, calculada a razón de 12–21 mg por kg de peso, se administra en dos inyecciones de igual volumen, a distancia de 24–48 h. En Israel se ha utilizado con éxito glándula pituitaria de carpa común para inducir la ovulación del mújol. También se puede inducir el desove administrando, en dos inyecciones de igual volumen, 60 000 UI de gonadotrofina coriónica humana (GCH) por kg de peso. La inyección se hace intramuscularmente, en la base de la aleta dorsal. Las hembras desovan unas 12 h después de la segunda inyección. Durante la época de puesta los machos producen espermatozoides activos sin necesidad de tratamiento de hormonas.
El desove espontáneo inducido es preferible, en general, al desove artificial y la fertilización artificial. Se coloca cada hembra en un acuario de 200 l, en el que se suelta un macho “en celo” unas 2 h antes del momento en que se espera se produza la puesta. Antes del desove la hembra bebe cantidades excesivas de agua, que determina la hidratación completa de los huevos. La hidratación se manifiesta en un rápido ensanchamiento del abdomen. El ensanchamiento de la cloaca es señal de que está a punto de producirse el desove. En ese momento el macho nada a la par con la hembra o traza círculos alrededor de ella. Los huevos fertilizados, que son flotantes, pueden recogerse en un colector. Los reproductores que han desovado se retiran del tanque o acuario tan pronto como ha terminado la puesta.
Los huevos pueden incubarse en incubadoras circulares en forma de embudo, con densidades no superiores a 400 huevos por litro. Puede introducirse más oxígeno en el agua por aireación. Los huevos harán eclosión a las 50–60 h a temperaturas de 20°–22°C. Las larvas recién nacidas se pasan a tanques de cría, a razón de 10 por litro. Al cuarto día los ojos adquieren pigmentación y las larvas son capaces de buscar su propio alimento.
La preparación de los tanques de alevinaje y de alimentos para los alevines debe comenzar al menos una semana antes del desove. Se preparan cultivos separados de algas Dunaliella, Chlorella e Isochrysis y se pone en los tanques de alevinaje una mezcla de los tres cultivos de algas y del rotífero Brachionus plicatilis. Es preciso conseguir una concentración del orden de 100 millones de células de algas y 5 000–10 000 rotíferos por litro de agua de mar. La temperatura debe ser de 20°–22°C. La aireación del estanque es útil para mantener el contenido de oxígeno y lograr una buena circulación del agua. Añadiendo poco a poco agua dulce después de la primera semana, se reduce la salinidad del agua a 24 partes por mil para el trigésimo día.
A partir del décimo día, la alimentación de los alevines se complementa con copépodos y nauplias de artemia. A partir del cuadragésimo día se les dan artemia y copépodos de mayor talla y luego piensos artificiales. Para trasladar los pececillos a los estanques hay que esperar a que tengan al menos 45 días.
En el Apéndice II se dan detalles sobre los distintos productos químicos utilizados en las operaciones de propagación y cría de pececillos.
En el Apéndice III se presentan, en forma de tabla, los aspectos esenciales de la biología reproductiva de los peces, expuestos en el Capítulo 10.
En el Apéndice IV se presenta un resumen cronológico de los progresos más importantes conseguidos en la propagación artificial de los peces.
| 2) Se corta la cabeza con una sierra fina | ||
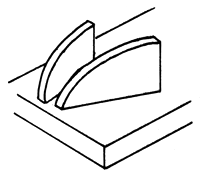
| 1) Soporte de madera para sujetar la cabeza | 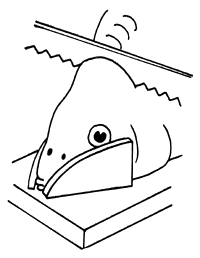 | 3) Guía para la extracción |
 |  | |
| 5) Se taladra la cabeza | ||
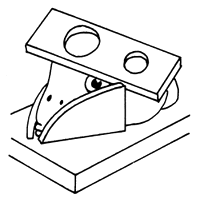
 | 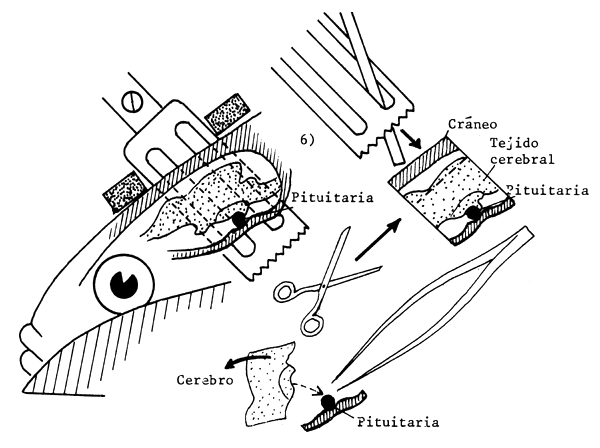 | |
| 4) Taladradora con sierra anular | ||
Figura 73 Extracción de la glándula pituitaria de un pez
| 1) Poner las glándulas en acetona inmediatamente después de la extracción | 2) Verter la acetona | 3) Añadir más acetona |
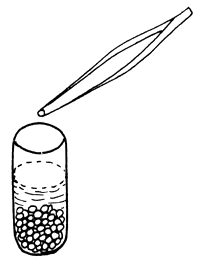 | 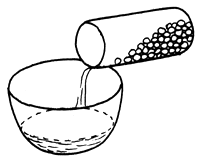 | 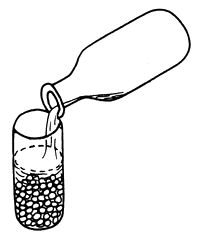 |
 | 4) y 5) Cambiar la acetona a las 8 h |  |
| 6) Eliminar toda la acetona al cabo de 24 h |  |  |
| 7) Secar por evaporación | ||
 | ||
| 8) Conservar en frascos lacrados | ||
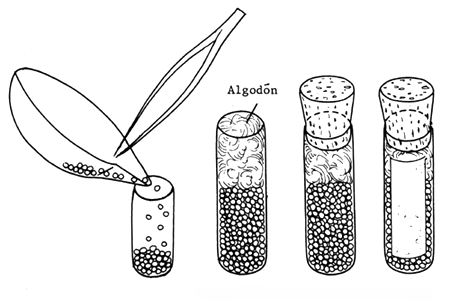
Figura 74 Preparación de glándulas pituitarias secadas en acetona
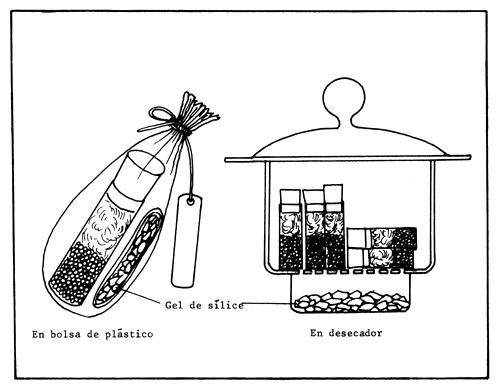
Figura 75 Conservación de glándulas pituitarias
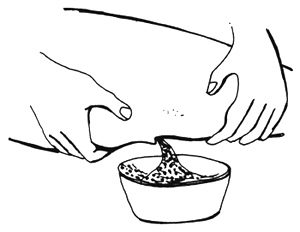
| 1) Añadir licor seminal a los huevos | 2) Remover bien con una pluma |
 | 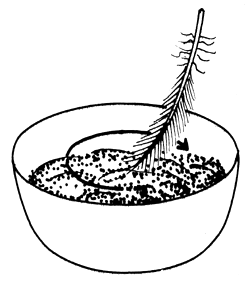 |
| 3) Mezclar con una cuchara de plástico | 4) Colador con agujeros mayores que los huevos |
 | 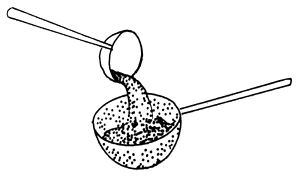 |
| 5) Distribuir los huevos sobre la superficie del nido artificial | 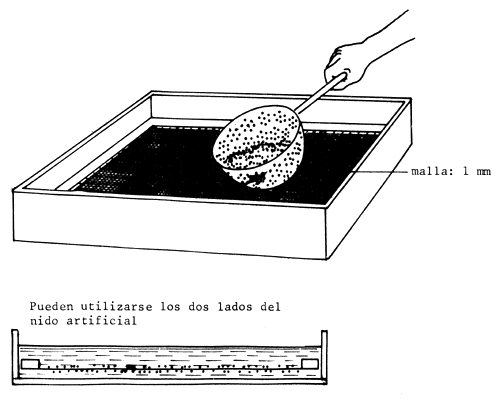 |
Figura 76 Colocación de huevos fertilizados de carpa común en un nido artificial
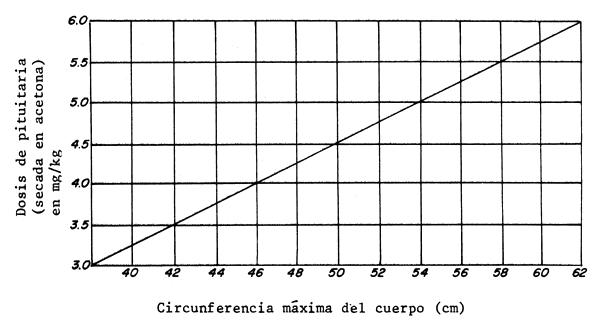
Figura 77 Relación entre la dosis de pituitaria y la circunferencia máxima del cuerpo en las hembras de carpas chinas
| A) Los reproductores se alimentan de pececillos vivos |
 |
| B) Cuando la temperatura llega a 12°–15°C, separar los sexos |
 |
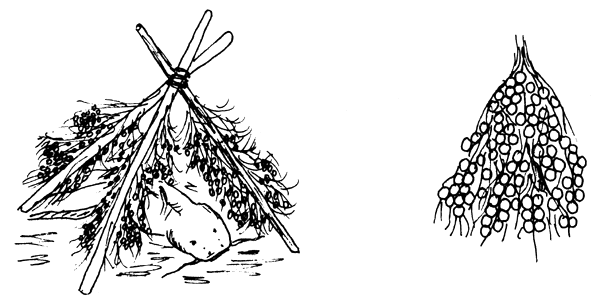
| C) Cuando la temperatura llega a 20°–22°C, preparar nidos en forma de tienda india con raíces secas y ramas de pino |
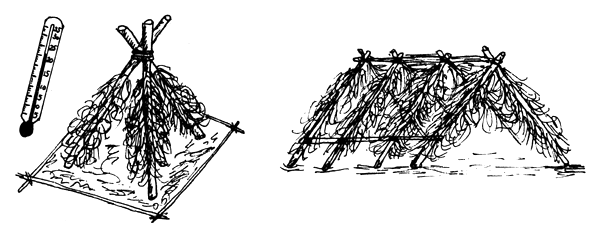 |
Figura 78 Propagación del siluro (Silurus glanis). Trabajos preparatorios
 | |
| Cuando la temperatura llega a 23°–25°C, colocar los nidos y soltar a los reproductores en los estanques | |
 | 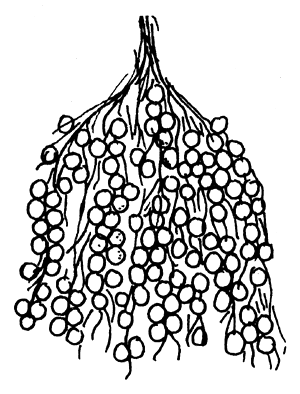 |
| El macho vigila los huevos | Nido cubierto de huevos |
 | |
| Colocar las ramas llenas de huevos en una hapa de red de malla fina para la incubación | |
Figura 79 Propagación del siluro (Silurus glanis). Inducción del desove en estanques de tierra mediante construcción de nidos
 |
| A) Se inyecta extracto de pituitaria |
 |
| B) El desove se produce al día siguiente |
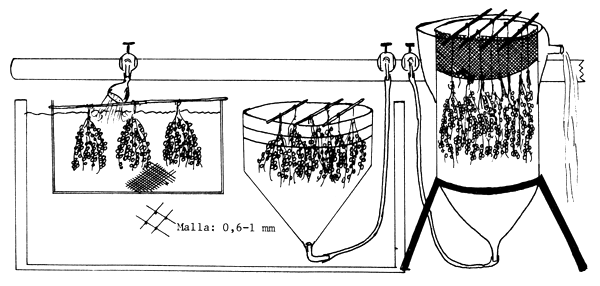 |
| C) Incubación de los huevos |
Figura 80 Propagación del siluro (Silurus glanis). Inducción del desove por hipofisación en pequeños tanques de cemento
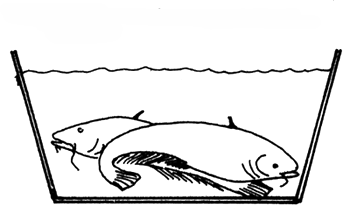
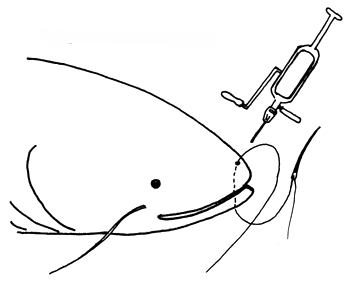
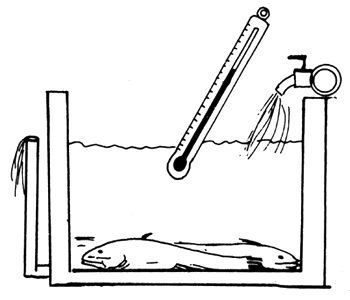
| A) Se calma a los peces con MS 222 | B) Se les cose la boca |
 |  |
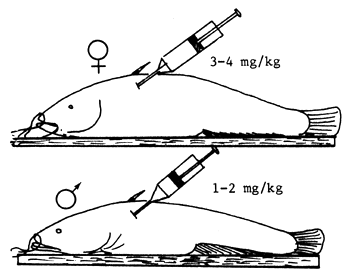 |  |
| C) Hipofisación | D) En agua a 23°–25°C |
 |  |
| E) Desove artificial | |
| F) Incubación |
Figura 81 Propagación del siluro (Silurus glanis). Inducción de la ovulación y desove artificial
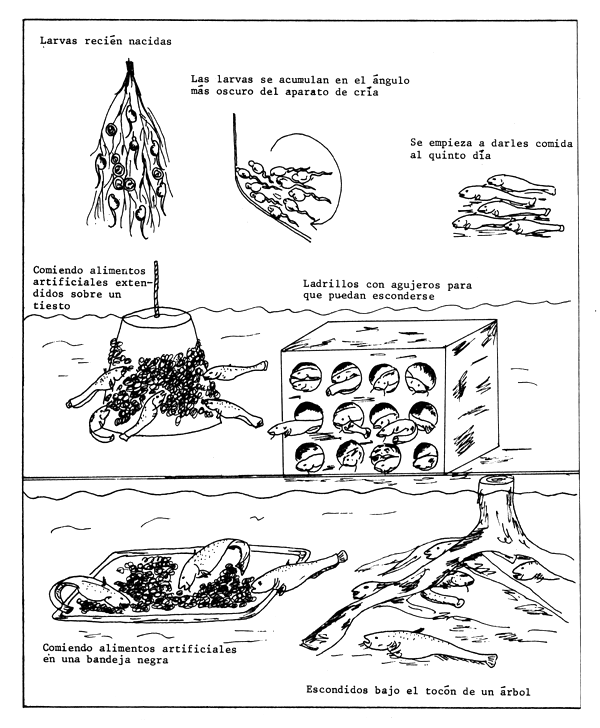
Figura 82 Propagación del siluro (Silurus glanis). Cría de larvas y alevines
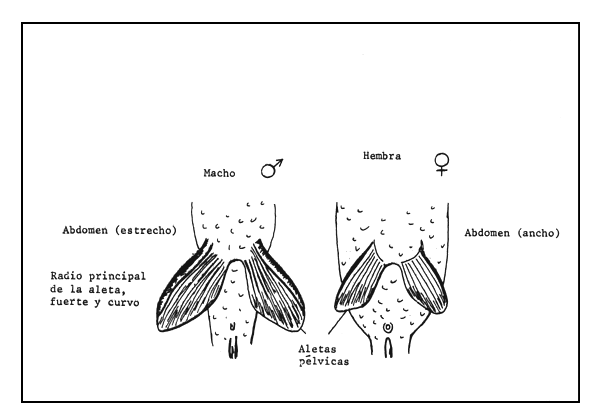
Figura 83 Dimorfismo sexual de Tinca tinca
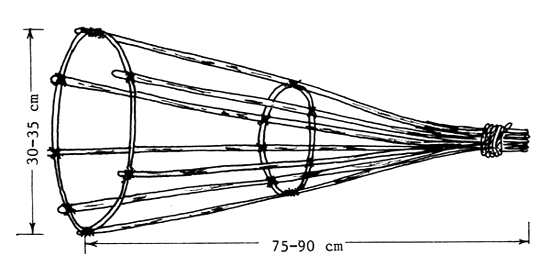 |
| A) Bastidor para nido hecho de tiras de bambú o varillas |
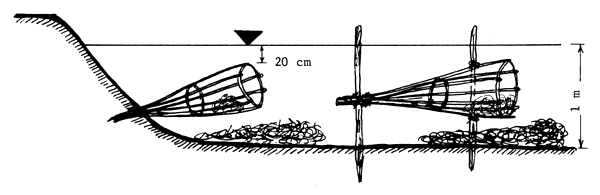 |
| B) Bastidores y materiales fibrosos en el agua |
 |
| C) Se saca el nido con los huevos |
Figura 84 Propagación inducida del gurami gigante (Osphronemus goramy)