Le marquage est un procédé utilisé depuis très longtemps pour l'étude des migrations, de la croissance et de la mortalité des animaux marins. Une revue générale des techniques utilisées chez les poissons et les invertébrés a été faite par Rounsefell en 1963 et, plus récemment, par Jakobsson (1970) et Neal (1970). Dans le cas particulier des crevettes, les principales difficultés rencontrées sont:
leur petite taille et la fragilité qui en résulte,
le processus d'exuviation au moment de la mue. Toute perturbation de ce mécanisme peut entraîner une perturbation de la croissance ou une mortalité additionnelle. Il existe deux types de méthodes, celles qui permettent de distinguer les individus les uns des autres, et celles qui ne permettent de marquer qu'un groupe d'individus que l'on suivra alors comme une cohorte artificielle.
Une opération de marquage doit être planifiée dès le départ pour réunir le maximum de chances de survie. Pour un marquage en estuaire par exemple, il conviendra de choisir des sites où les paramètres hydrologiques (température, salinité, oxygène dissous) sont favorables à l'espèce considérée en évitant par exemple les dessalures trop importantes ou les températures trop élevées.
Les installations de marquage (circulation d'eau, volume disponible, aération) devront être étudiées en conséquence.
Cette opération doit être réalisée en évitant au maximum de maltraiter les crevettes. Il serait préférable d'éviter le chalut, lorsque cela est possible et en particulier dans les estuaires, au profit des filets fixes ou des nasses. Lorsqu'il est inévitable, le chalutage doit procéder par opérations courtes (10–15 minutes par exemple). La durée du trait peut être réduite en fonction de l'abondance de l'espèce recherchée, des espèces d'accompagnement et de l'abondance des corps “étrangers” sur le fond (pierres, éponges) qui écraseront les crevettes à la remontée du chalut. Costello (1964) suggère de réduire la pression dans le cul du chalut en l'armant d'anneaux rigides cousus à l'intérieur et maintenant la poche ouverte.
Les problèmes posés par la conservation des crevettes vivantes sont plus aigus si le marquage est effectué sur la berge. En mer, une bonne circulation d'eau suffit en général. Des incidents peuvent éventuellement se produire si la salinité de l'eau de surface, pompée par le navire, est très différente de celle du fond où vivent les crevettes. Il faut également veiller à la température et il sera parfois préférable de stopper le marquage pendant les heures chaudes.
Dans les estuaires, sur des embarcations de petite taille, une solution simple consiste à attacher des cages flottantes au bateau ancré. La circulation est alors assurée par les courants naturels.
Si le marquage est effectué sur les berges, l'installation sera plus complexe et comprendra une pompe et une alimentation en air. Ce dernier équipement peut être évité en injectant l'eau par des dispositifs spéciaux à effet venturi, assurant l'aération ou tout simplement en laissant l'eau frapper la surface avec une pression suffisante.
La table de marquage doit comporter deux récipients plats contenant de l'eau de mer où les crevettes transitent pendant le marquage (Fig. 40) et éventuellement une rigole de convoyage des crevettes marquées jusqu'au bac de récupération. Il peut être nécessaire de baisser la température des bacs de conservation et Emiliani. (1971) décrit le système utilisé par le laboratoire de Galveston (U.S.A.).
L'utilisation d'un anesthésique peut être souhaitée pour réduire les soubresauts de la crevette pendant le marquage, cependant Zein Eldin (cité par Neal, 1970) a montré la nécessité d'utiliser des concentrations élevées d'anesthésique et souligné la difficulté à ne pas dépasser l'intervalle étroit de dosage non fatal provoquant cependant une sédation rapide.
Il est souvent préférable de procéder au marquage des animaux tout de suite après la capture lorsqu'ils sont encore choqués et bougent peu. L'expérience montre qu'ils récupèrent ensuite très vite et redeviennent très vifs au bout de 20 à 30 minutes. L'opération de marquage est alors plus délicate pour le marqueur, et plus éprouvante pour l'animal.
Le but de l'opération est de marquer un groupe d'individus de caractéristiques données, pour le suivre au cours du temps. Il est préférable de marquer des groupes homogènes surtout lorsque les phénomènes à observer sont susceptibles de varier avec l'âge.
6.3.1 Le calibrage
Les jeunes crevettes en migration sont en général calibrées naturellement en ce sens que l'éventail des tailles et des âges capturés est faible. Ce n'est pas le cas en mer et un tri est nécessaire. Allen et Costello (1962) ont mis au point une méthode simple à l'aide de casiers à claire-voie. Le passage des crevettes à marquer dans deux casiers de “maillage” différent conduit à sélectionner un groupe de taille homogène, les crevettes de taille supérieure étant retenues par le premier casier et celles de taille inférieure s'échappant à travers le second.
6.3.2 L'utilisation des colorants vitaux
Menzel et Racek les utilisent dès 1955. Arnold (1965) a passé en revue leur utilisation chez les poissons. Diverses méthodes sont utilisables:
6.3.2.1 L'immersion totale dans un liquide colorant permet l'imprégnation des membranes et du tube digestif. La rémanence de la couleur n'est que de quelques jours selon Dawson (1957). Cette méthode a été discutée par Racek (1955). La permanence du bleu Trypan est de deux semaines, mais avec 50 pour cent de mortalité immédiate. Le bleu Nil sulfate donnerait, selon cet auteur, de meilleurs résultats. La marque disparaît à la mue (Meyer-Waarden et Tiews, 1965).
6.3.2.2 L'ingestion de boulettes alimentaires colorées permet également la coloration du tube digestif. Dès 1957, Dawson expérimentait ces deux techniques qui, depuis lors n'ont été que peu utilisées en raison de la disparition rapide du colorant. La permanence est parfois bonne, supérieure à 200 jours, cependant les intoxications par suringestion de colorant sont fatales. D'après l'auteur, ce défaut peut cependant être évité.
6.3.2.3 L'injection intra-musculaire
Elle a été utilisée sur les crevettes dès 1955 par Menzel (1955), puis Dawson (1957), Costello (1959), Costello et Allen (1964), Klima (1965, 1974), Berry (1967), Kutkuhn (1962) et McCoy (1968), et semble donner les meilleurs résultats.
Costello (1964) a rédigé un mode opératoire détaillé de cette technique, de la capture au largage et nous reprendrons ici l'essentiel de son travail. L'équipement standard est constitué de seringues à tuberculine de 0,5 ou l cc, avec de très petites aiguilles hypodermiques. Une seringue automatique peut être utilisée (Fig. 41). Le colorant filtré est injecté latéralement à travers la membrane articulaire, entre le 5ème et le 6ème segment abdominal (ou entre le 3ème et le 4ème, Neal, 1970). Pour les crevettes de taille inférieure à 60 mm (longueur totale), l'injection peut être faite à travers le premier segment abdominal. Il faut éviter de percer le conduit digestif et d'injecter des bulles d'air. La cadence de marquage est de 200/240 crevettes à l'heure et peut atteindre 300 crevettes/heure.
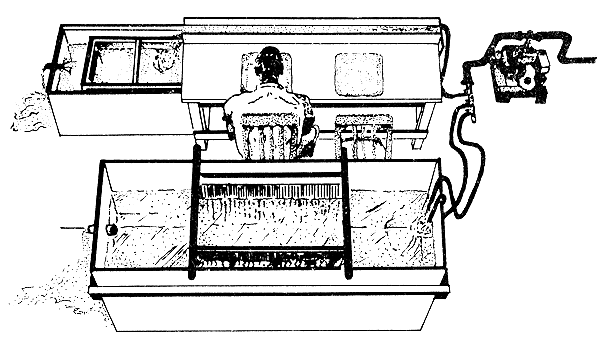
Figure 40: Installation de marquage à terre (d'après Costello, 1964)
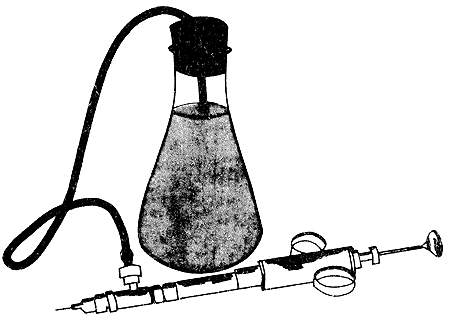
Fig. 41: Système d'injection automatique (d'après Neal, 1969)
Les crevettes marquées doivent être comptées au fur et à mesure du marquage. Les crevettes éventuellement retirées ensuite, en raison de leur état, seront soustraites du total. Le colorant injecté dans le système vasculaire par l'artère dorsale abdominale se fixe dans les branchies (Fig. 42A) où il peut persister plusieurs semaines1. Le défaut de cette technique est le risque d'un pâlissement rapide de la couleur pouvant entraîner un abaissement artificiel du taux de récupération au cours de la période de recapture.
6.3.3 Les pigments fluorescents
6.3.3.1 La pulvérisation de masse
Il est possible de pulvériser à haute pression (14 kg/cm2) sur des crevettes une poudre fluorescente (Benton et Lightner, 1972). Les grains de poudre se logent dans les membranes souples de la carapace et peuvent y être observés par fluorescence en lumière ultra-violette. Cette méthode a plusieurs inconvénients:
tout d'abord la faible persistance de la marque qui disparaît à la première mue, sauf exception où elle fut retenue 130 jours. Loesch et al. (1976) utilisant cette méthode, montrent que les grains peuvent traverser la carapace et persister après plusieurs mues.
La nécessité d'utiliser la lumière ultra-violette pour la détection, ce qui limite son application à des expériences de marquage et recapture menées de bout en bout par l'expérimentateur lui-même.
Le marquage massif en mer se heurterait peut-être aux règlementations en matière de colorants alimentaires, les crevettes non détectées pouvant être ingérées accidentellement.
Elle a un avantage pour les études à court terme, consistant en la possibilité pour un seul homme de marquer plusieurs centaines d'individus par heure (Neal, 1970).
6.3.3.2 L'injection
Elle peut se faire sous forme de solution de produit fluorescent dans de la vaseline (Klima, 1965). La marque a alors une forte rémanence (276 jours) mais nécessite toujours l'intervention de l'expérimentateur et l'utilisation des U.V. pour la détection. Smith (1970) examine l'utilisation de ces pigments pour le marquage des jeunes poissons. Selon lui la marque reste visible pendant 8 à 11 mois. Clark et Caillouet (1973) l'utilisent sur Penaeus setiferus juvénile, et Edwards (1977) sur Penaeus vannamei.
Neal (1970) et Penn (sous presse) signalent que les particules de vaseline cheminent cependant lentement vers les branchies où elles peuvent s'accumuler surtout si l'injection est trop importante.
6.3.4 Les encres d'imprimerie, testées par Klima (1965) comme marques secondaires sont jugées peu satisfaisantes car elles ne restent pas au point d'injection mais diffusent vers les branchies où elles masquent la marque primaire.
6.3.5 Les mutilations physiques
L'ablation partielle d'un uropode (“clipping”) est une méthode utilisable pour des expériences à court terme. Elle a été utilisée par Barr (1971) sur des caridae.
Il a l'avantage de permettre l'identification de chaque individu par un numéro. Le marquage peut porter sur tous les individus aptes à supporter la marque, il peut s'étendre dans le temps et dans l'espace sans difficulté car les caractéristiques de l'individu marqué peuvent être aisément retrouvées grâce au numéro.
6.4.1 Les marques externes
Elles sont visibles de l'extérieur et fixées à l'animal par divers procédés:
6.4.1.1 La marque d'Atkins (Fig. 42B) est constituée d'un fil de nylon traversant l'animal de part en part, noué en boucle et porteur d'une pastille de plastique colorée et numérotée (Allen et Costello, 1962; Penn, 1975; Ruello, 1970, 1975, 1977). Une marque semblable a été utilisée par Tiews (1964) sur Crangon crangon, mais simplement nouée autour de la carapace. Placée par Costello et Ruello en travers du ler segment abdominal, elle est fixée par Penn à la jointure des ler et 2ème segments pour faciliter la mue.
6.4.1.2 Le ruban de vinyl
Marullo et al. (1976) ont utilisé un ruban de plastique souple, enfilé à travers l'animal. Ce ruban a l'avantage de ne pas blesser les tissus et de ne pas entraver l'animal. Il peut cependant se décolorer et devenir peu visible. L'opération de marquage est plus rapide mais la toxicité du plastique coloré n'a pas été testée. Traitée à l'aureomycine pour limiter l'infection, cette marque a été utilisée avec succès très récemment aux Etats-Unis (Klima, 1979 et Klima et Parrack, 1980) et au Koweit (Mohamed et al., MS). C'est à ce jour la marque externe la plus efficace sur les juvéniles puisque l'on peut marquer des crevettes de 50 à 100 mm et obtenir d'excellents taux de recapture.
6.4.1.3 Les disques de Petersen et leurs dérivés (Fig. 42C)
Cette technique ancienne a été très largement utilisée depuis des années et elle a considérablement évolué. La marque était constituée à l'origine de deux disques de 7,9 ou à 9,5 mm de diamètre, placés de part et d'autre de l'animal, reliés par un fil d'acier traversant le corps de la crevette à travers le premier segment abdominal (Ivesen et Idyll, 1960; Potter, 1975). La méthode est améliorée par Neal (1970) qui réduit le disque et utilise une aiguille en acier inoxydable pour éviter la corrosion. le sertissage est simplifié par l'utilisation d'une pince à circuits imprimés. Les aiguilles sont trempées dans un antibiotique (chlortétracycline à 2 pour cent). Ce type de marque, contesté par Kurata (1962) en raison de son inévitable interférence avec la mue, a été largement utilisé aux Etats-Unis (Lindner et Anderson, 1956; Iversen et Jones, 1961; Neal, 1969), en Côte d'Ivoire (Garcia, 1973, 1975), au Sénégal (Lhomme, 1978), à Madagascar (Le Reste et Marcille, 1976) et en Australie (Lucas, Young et Brundritt, 1972) en donnant apparemment de bons résultats. Welker et al. (1975) ont comparé cette marque avec les injections colorées et les marques internes et n'ont pas trouvé de différence significative dans la croissance ou les taux de recapture.
Le stade ultime d'évolution de cette marque est le “toggle tag” utilisé par Penn (1975) en Australie. La marque numérotée est fixée au corps entre le ler et le 2ème segments abdominal par un fil en PVC (35 mm de long et 0,5 mm de diamètre) terminé par deux barrettes en T qui saillissent de part en d'autre de l'animal. Le tout est mis en place à l'aide d'un pistolet spécial (Floy tag). La souplesse du nylon de liaison permet de limiter l'ulcération des tissus. Le “toggle tag” et la marque d'Atkins donnent des résultats similaires.
6.4.1.4 Les marques fichées
Fixées dans le muscle de l'animal, ces marques (“dart tag” et “anchor tag”) se sont révélées désastreuses pour les crevettes. Dell (1968) a décrit la marque et le pistolet utilisé pour sa mise en place. Utilisées par exemple par Bearden et McKenzie (1972) elles ont l'inconvénient d'être dissymétriques (elles ne dépassent que d'un côte) déséquilibrant la nage. Les oscillations trop importantes de la marque entretiennent une ulcération permanente source de mortalité additionnelle (Neal, 1969; Lucas et al., 1972).
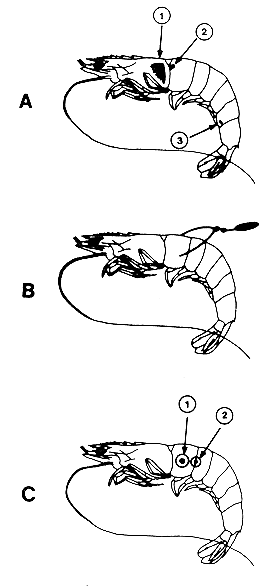
Fig. 42: Divers types de marques internes et externes
A. Injection colorée (1) marque interne en vinyl (2) et
injection fluorescente (3)
B. Marque d'Atkins
C. Disques de Petersen: méthode originale (1) et modification
proposée par Neal, 1970 (2)
6.4.2 Les marques internes
Une marque de ce type a été décrite par Neal (1970), il s'agit d'une petite pastille de plastique numérotée, de 5 × 2 × 0.25 mm, glissée dans le muscle abdominal à travers une membrane articulaire. Elle est donc invisible et conservée au moment de la mue. Pour être détectée, elle doit être accompagnée d'une marque primaire (injection colorée). L'utilisation d'une pommade antibiotique réduit l'infection. Penn (sous presse) indique que cette marque peut être rejetée à la mue après infection localisée et érosion des tissus environnants.
Les marques métalliques codées, utilisées par Jefferts, Bergman et Fiscos (1963) ainsi que West et Chew (1968), sur Pandalus platyceros, sont en acier inoxydable codé par des bandes de couleur. Elles ne semblent pas provoquer de mortalité additionnelle et la croissance est correcte. Il existe un appareil permettant la mise en place rapide. Après l'insertion, la marque est magnétisée pour faciliter la détection lors de la récupération. Elle a été essayée chez les penaeïdes par Welker (cité par Neal, 1970) avec succès. La détection au cours de la pêche industrielle poserait cependant quelques problèmes techniques.
Il consiste à faire porter simultanément deux marques à l'animal. Il est utilisé en théorie pour détecter d'éventuelles pertes accidentelles de marques. Chez les crevettes, il a été utilisé pour augmenter les possibilités offertes par les injections colorées. Celles-ci, clairement visibles de l'extérieur, au moins au début, constituent la marque primaire, identifiant par exemple une date de marquage. La marque secondaire permet, après recapture, d'identifier, par un examen plus détaillé, des sous-groupes (de taille, d'origine géographique différente, etc.). Dans ce cas, la marque secondaire peut être constituée d'une injection de gelée fluorescente dans la queue. Klima (1965), Fig. 42A: deux sites d'injection sont possibles, ce qui augmente les combinaisons disponibles. Cet auteur n'a observé aucune mortalité additionnelle évidente. Cette méthode a également été utilisée par McCoy et Brown (1967) sur des juvéniles. Le double marquage est effectué en 1 ou 2 opérations. Dans le premier cas, les deux colorants (vital et fluorescent) sont injectés en mélange. Le premier gagne les branchies dans les 24 heures et le second après 48 heures. Le mélange des deux marques se détecte jusqu'à 45 jours plus tard en lumière ultra-violette.
La marque secondaire peut permettre d'identifier l'individu si elle est constituée d'une pastille numérotée (paragraphe 6.4.2). Le double marquage ainsi réalisé a alors les avantages du marquage individuel, sans interférer avec la mue. Il a en revanche les inconvénients des injections colorées qui pâlissent avec le temps. La méthode a cependant été utilisée par Berry (1967).
Elle constitue une des phases délicates du marquage. C'est au cours de cette opération que la prédation peut être une cause importante de mortalité additionnelle. Un principe essentiel doit être retenu: les crevettes ne doivent jamais être rejetées à l'eau individuellement. Elles doivent, autant que possible, être relâchées au niveau du fond. D'autre part, seules les crevettes en parfait état seront relâchées. Cette vérification s'opère par observation dans un bac d'eau courante fortement aérée. Les crevettes, d'abord choquées, récupèrent rapidement et l'expérience montre qu'en général une attente d'une heure est suffisante car les crevettes qui restent vivantes au-delà de ce laps de temps survivent plusieurs jours en vivier (Garcia, 1970, 1976; Lhomme, 1978; Le Reste et Marcille, 1976). Berry (1967) a conservé les crevettes marquées à bord pendant 24 heures. Pour des marquages de juvéniles, Klima (1965) a prolongé cette période à 18 jours.
Une période de récupération est souhaitable mais elle ne doit pas être trop longue car elle finit par produire un effet inverse à celui que l'on recherche en affaiblissant les animaux marqués (Beverton et Bedford, 1965).
Le largage proprement dit s'effectue, soit à l'aide d'une cage spéciale s'ouvrant au fond (Costello, 1964; Le Reste et Marcille, 1976) grâce à un messager expédié de la surface, soit à l'aide d'une enceinte en plastique peu coûteuse (Fig. 43) ouverte par simple traction sur un orin (Garcia, 1972), soit de façon encore plus simple, par des enceintes démontables, lestées, totalement libres, en plastique, rejetées à la mer et qui s'ouvrent toutes seules sur le fond grâce à un processus simple et ingénieux utilisant la fonte d'un bloc de sel (Emiliani, 1971) (Fig. 44). Ce système est actuellement utilisé en routine dans le golfe du Mexique. Dans les lagunes, où les profondeurs sont faibles, elles peuvent être relâchées au fond à l'aide d'un tuyau permettant aux crevettes introduites en surface de gagner directement le fond (Emiliani, op. cit.),
Dans certains cas (zones restreintes, petites baies) elle est effectuée par le chercheur et son équipe. Le plus souvent, elle est effectuée par les pêcheurs, et un soin considérable doit être apporté à la préparation de cette phase, avant et après le marquage car une bonne part du succès en dépend.
6.7.1 L'information préliminaire
Les pêcheurs doivent être informés par des contacts personnels avec les patrons, les matelots, les armateurs, les trieuses dans les usines, etc., et par la mise en place d'affiches colorées indiquant clairement la marque utilisée, sa position, l'adresse de retour ainsi que la récompense offerte. L'organisation d'une loterie périodique est de nature à améliorer le retour des marques si la prime est très élevée.
6.7.2 La collecte des informations de recapture
Il est nécessaire de récupérer la crevette entière, avec tous les renseignements qui s'y rattachent (date et lieu de recapture). Cependant, il est imprudent de diminuer la récompense en cas de remise de la marque seule ou d'absence de renseignements détaillés, car on s'expose alors à recevoir des renseignements erronés. Un contact très étroit avec la profession assurera la collecte des recaptures et des informations dans les meilleures conditions. Il peut être nécessaire de prévoir la dissémination de bidons de formol pour une conservation correcte des crevettes recapturées. Lorsque les bateaux effectuent des marées longues, il est souhaitable que les patrons notent les numéros des recaptures au fur et à mesure sur leurs cahiers de bord car la crevette est un animal à croissance rapide et le maximum de précisions sur la date de recapture est nécessaire. La collecte des informations annexes concernant la pêcherie, et spécialement l'effort de pêche, doit être particulièrement planifiée. Un effort supplémentaire peut être souhaitable pendant les quelques semaines qui suivent le marquage pour obtenir des renseignements particulièrement précis concernant la répartition géographique de l'effort.
6.7.3 Les biais
Les sources de biais qui affectent les résultats des marquages sont nombreuses et ont été revues dans les ouvrages de base de Beverton et Holt (1957), de Ricker (1975) et, plus récemment, de Gulland (1969) et il faudra se référer à ces manuels pour une étude approfondie du problème. Quelques aspects essentiels pour les crevettes seront repris ici et dans le reste de l'exposé on désignera respectivement par Z, F et M les coefficients instantanés de mortalité totale, par pêche et naturelle. Pour une bonne compréhension du texte qui suit il sera utile de se référer également au chapitre 7, sur les mortalités.
6.7.3.1 Biais de type A de Ricker.
Ils affecteront les valeurs de F mais non celles de Z.
(a) Mortalité initiale, due au marquage. Elle a été étudiée par Penn (1975). Elle peut être réduite par une station de 1 à 2 heures des crevettes marquées dans un bac avec circulation d'eau et aération pour éliminer les crevettes les plus faibles. Le largage doit également être soigné et effectué au niveau du fond pour éviter une prédation trop intense par les poissons qui suivent le bateau, attirés par les opérations de pêche. Garcia (1975) a montré que le taux de recapture dépendait de l'heure du largage et que la différence entre les taux de recapture des crevettes marquées de jour ou de nuit était plus importante pendant les périodes où l'eau est plus claire. La mortalité immédiate peut également être diminuée en évitant de marquer des crevettes de trop petite taille. Lucas, Young et Brundritt (1972) ont montré que les disques de Petersen provoquaient une mortalité additionnelle chez les crevettes de moins de 30 mm (LC).
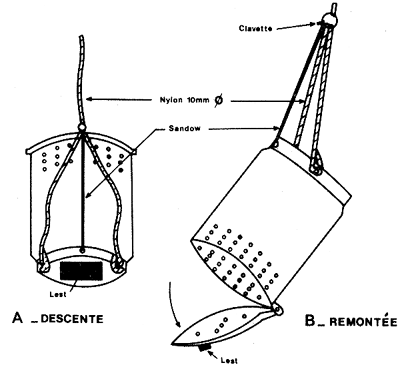
Fig. 43: Système simple de largage au niveau du fond à faible profondeur. La cage descend librement, la traction du cable au niveau du fond déclenche l'ouverture (d'après Garcia, 1973)
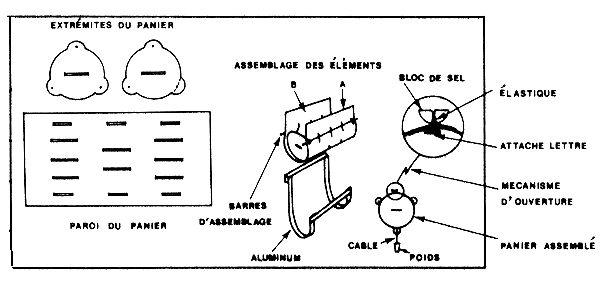
Fig. 44: Cage de largage autonome à ouverture automatique. La cage descend librement, la fonte du bloc de sel déclenche l'ouverture au bout de 10 mn environ (d'après Emiliani, 1971)
(b) Mauvaise notification des recaptures à taux constant. Pour limiter au minimum ce phénomène, il convient d'assurer une bonne campagne d'information avant le marquage et d'organiser la collecte des marques et le paiement des récompenses. Selon Penn (sous presse) une perte importante d'animaux recapturés se produit en particulier chez les individus de petite taille lorsqu'une forte proportion des petites tailles est traitée sur des peleuses automatiques.
Le taux de marques recapturées mais non détectées par les usines peut être calculé en utilisant la technique du “salage”. Elle consiste à introduire directement dans les captures des bateaux un nombre connu de crevettes marquées pour observer le pourcentage notifié par la suite. Un bon traitement statistique de ce problème est donné par Paulik (1961). Cette technique a été utilisée par Berry (1967) et Costello et Allen (1968) sur Penaeus duorarum. Le taux de marques non notifées dépend évidemment du type de marque. Il est a priori d'autant plus faible que la marque est visible. En ce sens, le disque de Petersen ne peut pratiquement pas passer inaperçu à l'étêtage alors que l'injection colorée est beaucoup plus discrète. Dans ce dernier cas, le pâlissement de la marque colorée peut, de plus, entraîner une augmentation progressive du pourcentage de marques non détectées ce qui affecte la valeur de Z calculée. La courbe de recaptures n'est d'ailleurs plus linéaire dans ce dernier cas.
Dans le même ordre d'idée, il faut noter que “l'intérêt” de la profession pour un marquage, et donc la minutie employée pour détecter les recaptures, faiblit vite quand l'abondance des crevettes marquées diminue. Il convient donc de ne prendre en considération que les premières semaines de l'expérience (Costello et Allen, 1968).
6.7.3.2 Biais de type B de Ricker: lorsque ce type de biais existe, la décroissance des nombres de recaptures obtenues est plus important que la décroissance réelle dans la population non marquée.
Ces biais affectent la valeur de Z, mais non celle de F.
(a) Pertes de marques à taux constant. Les disques de Petersen sont peu susceptibles de causer ce biais mais le pâlissement progressif des couleurs injectées peut être assimilé à ce phénomène si avec le temps, un pourcentage constant de marques deviennent trop pâles pour être détectées. La courbe de recapture peut même n'être plus linéaire si ce pourcentage n'est pas constant et Ricker (1975, p. 114) propose une méthode permettant de surmonter la difficulté. Rappelons que selon Penn (sous presse) les marques internes en PVC peuvent également être rejetées à la mue.
(b) Mortalité due au marquage constant. C'est un biais très classique. Il se traduit en général par une surestimation de la mortalité naturelle calculée par marquage. D'après Lucas, Young et Brundritt (1973) les diques de Petersen n'introduisent plus ce biais pour des crevettes de plus de 30 mm LC,
(c) Migration à taux constant hors de la zone de capture. Ce biais est potentiellement très important lorsque le marquage a lieu en lagune ou en estuaire, peu de temps avant la migration. Le taux de migration est alors perçu comme un taux de mortalité additionnelle, que l'on ne peut distinguer de la mortalité naturelle lors de l'estimation.
Ces biais sont difficiles à détecter et encore plus à quantifier et corriger. C'est pour cela que l'on considère en général que les marquages permettent d'obtenir une valeur de Z décomposable en F + X où X représente une “mortalité” composite intégrant la migration, la mortalité additionnelle due à la marque et la mortalité naturelle. Elle est parfois assimilée à M en l'absence d'indices contraires et peut être considérée comme la limite supérieure des valeurs possibles de M. En outre, la combinaison de la valeur de F trouvée par marquage avec la valeur de Z trouvée par l'analyse des structures d'âge, par exemple, permet d'obtenir une meilleure valeur de M.
6.7.3.3 Biais de type C de Ricker
Ils affectent à la fois Z et F. On classe dans cette catégorie les biais qui rendent inutilisables les recaptures dans le premier intervalle de temps, et ceux qui proviennent d'une différence de vulnérabilité entre les animaux marqués et non marqués causée par:
(a) Une modification du comportement des animaux marqués, liée à la marque et modifiant leur capturabilité au début de la phase de recapture.
(b) Une répartition différente des animaux marqués et non marqués, associée à une distribution non aléatoire de l'effort de pêche dans les premiers intervalles de temps. Par la suite, l'effort doit être distribué au hasard ou bien les poissons marqués doivent avoir la même distribution que les poissons non marqués pour que les nombres recapturés puissent être considérés comme des indices d'abondance de la population non marquée. Ce point est plus largement exposé au paragraphe 7.2.3.
Le premier type d'erreur peut être aisément détecté lorsque l'on dispose de bonnes données car les premiers points sur la courbe de recapture sont situés nettement au-dessus ou au-dessous de l'alignement des suivants. Le biais est peu important quand on récupère encore beaucoup de marques après le ou les intervalles biaisés mais peut être sérieux dans le cas contraire. Gulland (1969) et Ricker (1975) proposent des méthodes pour surmonter ce biais dont le principe est d'utiliser seulement les points non biaisés (voir également le paragraphe 7.5).
Le problème d'une distribution différente des individus marqués et non marqués est très important et le marquage doit être planifié pour éviter cette difficulté. Le plus simple consiste à quadriller tout le fond de pêche (et pas seulement la zone où a lieu la pêche) et à marquer tous les individus capturés par unité d'effort en chaque point, ou, s'ils sont trop nombreux, une proportion constante d'entre eux. Ces problèmes sont abordés dans le chapitre consacré aux mortalités.
Cependant, lorsque le fond de pêche est trop important, ceci peut être impossible à réaliser et Gulland (1969) propose une approche sur population non brassée qui consiste à calculer F pour les crevettes marquées, et en déduire q connaissant l'intensité de pêche dans la zone restreinte où se trouvent les marques. Si on pense que cette valeur est valable aussi pour les individus non marqués, l'évaluation de l'intensité de pêche appliquée à l'ensemble du stock (“overall fishing intensity”) permet de calculer une valeur de F valable.
6.8.1 Sur la croissance
Il est évident que les marques externes sont susceptibles de gêner considérablement le mécanisme de la mue, même si la technique actuelle d'insertion (dans la membrane intersegmentaire) est préférable à la méthode originale (à travers le premier segment abdominal). Kurata (1962), en raison de ces restrictions, a considéré l'utilisation des marques externes comme totalement incompatible avec la physiologie des crevettes.
D'après Penn (1975) les marques externes provoquent un ralentissement de la croissance pendant les deux premiers mois, et la croissance à la première mue est souvent nulle, dans des conditions expérimentales. En revanche, Neal (1970) note une croissance des crevettes “injectées” supérieure à celle des crevettes porteuses d'une marque externe rigide, en aquarium.
Cependant, en dépit de toutes ces restrictions, les marquages ont été utilisés, faute d'une méthode plus appropriée, dans de nombreuses régions (golfe du Mexique, Koweit, Australie, Afrique de l'Ouest, Madagascar) et d'excellents résultats ont été obtenus, montrant que dans les conditions naturelles les croissances observées étaient compatibles avec celles que l'on obtient par d'autres méthodes et représentaient un outil précieux pour mettre en évidence les variations saisonnières de croissance liées aux facteurs externes ou à la reproduction (Garcia, 1976, 1977; Penn, 1975; Lhomme, 1978; Klima, 1979).
6.8.2 Sur la physiologie
Une étude comparative faite par Zein Eldin et Klima (1965) n'a pas montré de différence entre la consommation d'oxygène d'individus marqués par injection et celle de témoins. Penn (1975) et Garcia (1975) ont observé un ralentissement de la croissance mesurée par marquages pendant la ponte.
Les marques externes occasionnent une plaie qui noircit rapidement. Cependant, à la mue, ce noircissement disparaît, la plaie se cicatrise (Penn, 1975) et une cuticule néoformée vient en général gainer l'axe de la marque externe, l'isolant complètement du muscle (Ruello, 1970; Fontaine et Lightner, 1973; Penn, 1975). Penn note que la cicatrisation est ralentie avec les marques rigides fichées de type “anchor tag” car une infection se produit généralement empêchant la fermeture de la plaie.
6.8.3 Sur le comportement
Selon Costello et Allen (1961), les marques externes modifieraient les possibilitiés natatoires et d'enfouissement des crevettes, les rendant ainsi plus vulnérables aux prédateurs. Il est exact que lorsque la marque n'est pas bien ajustée un déséquilibre est perceptible pendant la nage. Penn (1975) confirme que l'enfouissement est gêné par la marque rigide, mais Lucas et al. (1972) n'ont observé de gêne ni pour l'enfouissement ni pour la natation.
Selon Penn, toute l'activité générale serait réduite pendant les deux premiers mois qui suivent le marquage (mouvements, mues).
6.8.4 Sur la survie
De très nombreux auteurs ont observé que le pourcentage de recaptures diminue chez les crevettes de petite taille (Fig. 45) (Lindner et Anderson, 1956; Iversen et Jones, 1961; Lucas et al., 1972; Garcia, 1973, 1975; Le Reste et marcille, 1974; Lhomme, sous presse). La diminution observée est cependant souvent difficilement interprétable car on ne peut dissocier les effets de la sélectivité (capturabilité plus faible des petites tailles) de ceux du marquage (mortalité accrue).
Compte tenu du stress évident que représente la marque, on peut penser que la mortalité liée au marquage devrait être incriminée. Il convient de distinguer la mortalité initiale qui survient dans les quelques heures qui suivent le marquage de la mortalité additionnelle qui vient s'ajouter aux mortalités naturelles et par pêche tout au long de la période d'observation.
6.8.4.1 La mortalité initiale due au marquage
Elle existe et se traduit en particulier par une perte importante des effectifs marqués pendant la période de conservation à bord avant le largage. Elle dépend beaucoup alors des conditions de capture et de conservation à bord. Cette mortalité peut être réduite par une phase d'attente à bord avant largage pour éliminer les individus les plus faibles. D'après Penn (1975) les crevettes encore en vie après 72 heures survivent jusqu'à la mue suivante avec une marque externe (en aquarium). Garcia (1975) note que 93 à 99 pour cent des crevettes marquées avec des disques de Petersen et considérées comme saines survivent parfaitement au-delà de la première heure et ne montrent pas, par la suite, de mortalité supérieure à celle des témoins pendant 12 à 24 heures.
Il n'est jamais certain que toute la mortalité initiale se produise avant largage et il est très important de déceler son existence au-delà car la réduction du nombre d'individus initialement marqués entraîne un biais dans l'évaluation de F.
Lucas et al. (1972) ont montré que les disques de Petersen ne provoquaient pas de mortalité initiale contrairement aux marques fichées de type “anchor tag” (50 pour cent de perte). Penn (1975) a calculé pour les “toggle tags” une mortalité initiale de 20 pour cent. Lucas et al. n'ont noté aucun effet létal des injections colorées mais il faut rappeler que les colorants “vitaux” peuvent être toxiques à dose élevée (Costello, 1964) et que seule une utilisation prudente de cette technique (test des dosages, filtrage des solutions, élimination des bulles d'air à l'injection, etc.) peut permettre de limiter ses inconvénients.
La prédation au moment du largage peut également être une source de mortalité initiale importante. La plupart des auteurs admettent qu'un largage en masse, au niveau du fond est préférable. Garcia (1975) a observé, pour différents lots marqués, que le taux de recapture dépendait de l'heure du largage (Fig. 46) et que la différence était plus faible lorsque les eaux étaient plus turbides. Il a émis l'hypothèse que ce phénomène pourrait être lié à la prédation des crevettes par les poissons qui, attirés vers le bateau par le chalutage et les rejets, pourraient suivre la cage dans sa descente vers le fond.
6.8.4.2 Mortalité additionnelle
Elle est implicitement admise dans toutes les opérations de marquage pour lesquelles on obtient une estimation de F et de X, mortalité naturelle “apparente” ou mortalité résiduelle, incluant la mortalité naturelle, l'émigration, la perte de marques et la mortalité additionnelle due à la marque.
Lucas et al. (1972) ont montré, en aquarium, l'existence d'une mortalité additionnelle avec des disques et des “anchor tags” pour les crevettes de petite taille mais non pour les adultes. Ceci est confirmé par Penn (1975) avec des marques “toggles” et d'Atkins. Cet auteur indique aussi que la couleur de la marque n'influe pas sur la survie ce qui confirme les travaux de Costello et Allen (1961) qui affirmaient que la couleur n'avait aucun effet sur la prédation. Selon Penn (1975) une mortalité importante se produirait au moment de la première mue après le marquage.
6.8.4.3 Conclusions
Bien que la mortalité causée par le marquage soit le problème majeur posé par cette technique d'étude, il est très difficile de la mettre en évidence de façon indiscutable, et a fortiori, de la chiffrer. Il est évident qu'elle dépend des conditions de marquage (équipement, différence entre les conditions à bord et au fond, capture, méthode de marquage, largage, etc.). Il est sûr également que l'observation expérimentale est souvent elle-même sujette à caution. En effet, les résultats sont souvent paradoxaux et, par exemple, de nombreux auteurs ont noté un taux de survie des crevettes marquées supérieur à celui des témoins (Costello et Allen, 1961; Lucas et al., 1972; Klima, 1965). Les deux premiers auteurs ont même suggéré un effet prophylactique de l'injection colorée. Penn (1975) pense que ce paradoxe découle de ce que l'essentiel de la mortalité en aquarium se produit à la mue par stress ou cannibalisme et que l'activité générale des crevettes marquées est réduite conduisant à un nombre de mues inférieur à celui des témoins, ce qui explique leur mortalité moindre. Des mortalités très élevées sont d'ailleurs observées même dans les lots témoins (Lucas et al., 1972; Penn, 1975) ce qui souligne les conditions générales de stress dans lesquelles s'effectue l'expérience.
On peut donc se demander dans quelle mesure les résultats obtenus en aquarium sont extrapolables à l'expérience réelle de marquage. Penn (1975) a d'ailleurs émis cette restriction et Lucas et al. (1972) l'admettent et indiquent que les résultats expérimentaux, en aquarium, “dépendent des conditions ambiantes” et que leur utilisation ultérieure doit être faite avec prudence.
Il sera donc très utile lors des expériences de marquage de chercher également à déceler les biais possibles par des méthodes indirectes: comparaison des résultats obtenus avec des lots différents, avec les deux sexes, à diverses saisons et avec plusieurs types de marques.
Un test utile est également la comparaison des structures de taille des crevettes marquées, recapturées, et exploitées par la flottille pour s'assurer que les populations marquées et exploitées sont bien les mêmes (Fig. 47) et que les résultats obtenus sur les populations marquées sont bien extrapolables à l'ensemble du stock exploité.
Dans l'exploitation des résultats, il est vraisemblable que les recaptures obtenues à “long terme” (au-delà des 30 premiers jours qui suivent le marquage) donneront des résultats moins biaisés, aussi bien en ce qui concerne les mortalités que la croissance.
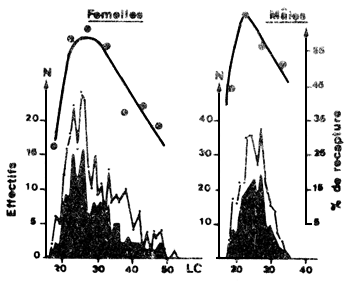 | 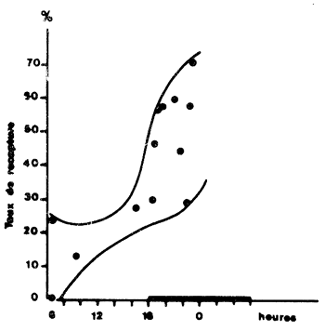 |
Fig. 45: Taux de recapture en fonction de la taille dans le premier mois qui suit le marquage (d'après Garcia, 1975) En clair, crevettes marquées; en grisé, crevettes recapturées | Fig. 46: Variations du taux de recapture suivant l'heure de largage (d'après Garcia, 1975) |
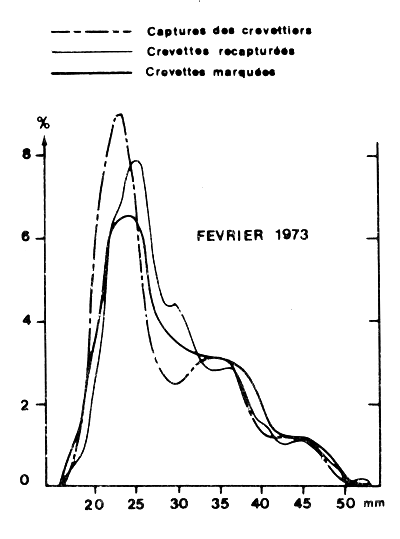
Fig. 47: Comparaison des courbes de fréquence des crevettes marquées, récupérées et pêchées par les crevettiers pendant la même période (d'après Garcia, 1977)