María Elena Torres
Investigadora
Instituto de Investigaciones Tecnológicas, INTEC
Santiago, Chile
INTRODUCCION
Los árboles fijadores de nitrógeno presentan un gran potencial económico. Entre ellos, los árboles leguminosos de la especie Prosopis, por su alta tasa de fijación de nitrógeno, ayudan a mejorar la productividad de los suelos. Además, sus frutos pueden ser ventajosamente utilizados como forraje (1).
Para obtener una buena fijación de nitrógeno es necesario lograr una buena simbiosis entre la planta y un microorganismo específico del género Rhizobium.
La cepa de Rhizobium a ser utilizada como inoculante debe ser altamente competitiva y efectiva con la planta hospedera correspondiente, debe poseer una buena sobrevivencia y tolerar condiciones adversas del medio ambiente, como sequía, salinidad, suelos ácidos, etc.
Actualmente se conoce poco sobre la simbiosis Prosopis-Rhizobium, sobre el microorganismo mismo y la efectividad de diferentes cepas de Rhizobium procedentes de diversas especies de Prosopis.
La primera información sobre la posibilidad de nodulación de árboles del género Prosopis y, por ende, de fijación de nitrógeno, data del año 1972 (2). Sólo en 1976 se demostró la correlación entre presencia de nódulos, materia seca y fijación de nitrógeno en ensayos experimentales (3).
En el presente trabajo se describe la aislación de cepas nativas de rizobio de la Pampa del Tamarugal y su elección. Esta se efectúa según capacidad de producir infección radicular y por su efectividad en la fijación de nitrógeno, en árboles leguminosos de las especies Prosopis alba y Prosopis tamarugo.
También se describe en este trabajo la tolerancia a la salinidad tanto del microorganismo aislado como de la asociación Prosopis-Rhizobium.
MATERIALES Y METODOS
Cepas de Rhizobium
El Dr. Felker, CKWRI, Texas A & 1 University, proporcionó las cepas F-1 y F-2, aisladas de nódulos de mezquite. Las cepas C-1 y C-2 (cepas nativas) fueron aisladas de nódulos de Prosopis tamarugo de la Pampa del Tamarugal, zona desértica del Norte de Chile, situada entre los 19°33' y 22°30' de latitud sur. El sector muestreado está situado en una área considerada entre las más secas del mundo y a una altura sobre el nivel del mar de alrededor de 1.000 metros.
Medios de cultivo
Las cepas de Rhizobium fueron mantenidas en Agar con Manitol, extracto de levadura y rojo congo. La composición del medio se indica a continuación: K2HPO4, 0,5 g; MgSO4. 7 H2O, 0,2 g; NaCl, 0,1 g; extracto de levadura Difco, 1 g; Manitol, 10 g; Agar 15 g; para 1.000 cc. de agua destilada.
El medio de cultivo utilizado para la aislación de rizobios tenía la misma composición, a excepción del Manitol, el que se reemplazó en un 70% por arabinosa.
Los medios fueron autoclavados durante 15 minutos a 121°C.
Medio Jensen
Medio de cultivo con agar, libre de nitrógeno, cuya composición es la siguiente: CaHPO4, 1,0 g; K2HPO4, 0,2 g; MgSO4. 7 H2O, 0,2 g; NaCl, 0,2 g; FeCl3, 0,1 g; agar, 15,0 g; elementos trazas 1 ml, por cada litro de agua destilada. Se esterilizó por autoclave durante 15 minutos a 121°C.
Solución elementos trazas: B, 0,05%, Mn, 0,05%; Zn, 0,005% Mo, 0,005%; Cu, 0,002%. La solución se preparó en agua destilada y se aciduló con gotas de HCI concentrado, para facilitar la disolución de los elementos. Se esterilizó por autoclave durante 15 minutos a 121°C.
Preparación del inóculo
El inóculo se preparó cultivando los microorganismos seleccionados en un medio de mantención, a 28°C. Los cultivos se cosecharon y se suspendieron en agua peptonada. Las diluciones se estandarizaron entre 107 y 108 células/ml.
Tratamiento de las semillas
Las semillas se obtuvieron de árboles del Fundo Refresco de CORFO-SACOR (Pampa del Tamarugal). Las semillas de Prosopis alba y Prosopis tamarugo se sumergieron en ácido sulfúrico concentrado por 10 y 8 minutos, respectivamente.
Aislación de rizobios de nódulos
Las raíces recolectadas se lavaron en agua para remover restos de suelos y otros contaminantes. Los nódulos seleccionados se esterilizaron en superficie, sumergiéndolos por 3 a 5 segundos en etanol a 95°. Luego se sumergieron por 4 minutos en solución acidificada de cloruro mercúrico al 0,1% (0,5 ml de HCI concentrado por cada 100 ml de solución).
Luego de enjuagar cinco veces con agua destilada estéril, se aplastó el nódulo en 0,5 ml de agua destilada estéril y la suspensión obtenida se sembró en placas Petri con Agar-Manitol-Arabinosa-Rojo Congo.
Una vez obtenido crecimiento en estas placas, se sembró en tubos con agar inclinado, en medio de mantención Agar-Manitol-Rojo Congo.
Con el objeto de preseleccionar las cepas de Rhizobium por su capacidad de nodular las plantas de Prosopis alba y Prosopis tamarugo, se realizó un test de infección. Este ensayo se hizo en tubos de 200 mm de altura y 30 mm de diámetro, a los que se le agregó medio Jensen. Las semillas tratadas con ácido y germinadas en placas Petri con Agar, se implantaron en los tubos con medio Jensen y se inocularon con las cepas de Rhizobium. Este ensayo se llevó a cabo bajo condiciones controladas de temperatura (28 a 30°C). El fotoperíodo diario de catorce horas se logró con tubos fluorescentes de 40 W y suplementados con tubos Agrolight (Westinghouse). El ensayo de infección se realizó con doce réplicas para cada una de las cepas aisladas.
Ensayo de Efectividad
Este ensayo fue efectuado en cámara de crecimiento con temperaturas entre 29 y 35°C; con un fotoperíodo diario de catorce horas y una humedad relativa entre 30 y 40%.
Las semillas y el inóculo se prepararon en la forma ya descrita. Se utilizaron macetas con vermiculita (lavada con abundante cantidad de agua potable y luego agua destilada), se irrigaron con una solución nutritiva exenta de nitrógeno, de la siguiente composición: K2SO4 anhidro, 436 mg; MgSO4 anhidro, 493,6 mg; Ca (H2PO4)2, 117 mg; CaSO4, 272 mg y sequestrene 138 Fe (complejo de Fe - EDTA, Ciba-Geigy Corp.) 83 mg por litro de agua destilada. Esta solución además contenía los siguientes micronutrientes: H3BO3, 150 μg; ZnSO4. 7H2O, 13 μg; MnSO4. H2O, 85 μg; (NH4)6Mo7O24. 4H2O, 13 μg; CuSo4 . 5H2O, 12 μg, por litro de agua destilada. Se ajustó el pH a 6,0 y se esterilizó por filtración.
La misma solución nutritiva con nitrógeno se usó para los controles con nitrógeno. Esta contenía además: Ca(NO3)2 . 4H2O,385 mg; KNO3, 96,2 mg; (HN4)2SO4, 48,1 mg.
Ensayo de tolerancia a la salinidad
Este ensayo se realizó con la misma metodología y condiciones recién descritas. La prueba se hizo con diferentes salinidades en las soluciones empleadas para el riego, a partir del segundo mes de implantado el ensayo en macetas. En estudios de salinidad se acostumbra usar mezclas de sales de sodio, calcio y magnesio. Sin embargo, en este ensayo sólo se empleó cloruro de sodio, puesto que las sales de calcio y magnesio precipitarían el fósforo de la solución nutritiva y las plantas leguminosas son muy exigentes en su demanda de fósforo.
A la solución nutritiva normal se le adicionó cloruro de sodio en una concentración de 0,9%.
Para los ensayos de efectividad y tolerancia a la salinidad de la simbiosis planta-rizobio se hicieron los siguientes tratamientos tanto para P. alba como para P. tamarugo.
Testigo - semilla no inoculada (4 réplicas)
Testigo - semilla no inoculada + nitrógeno (4 réplicas)
Semilla inoculada - cepa extranjera (6 réplicas)
Semilla inoculada - cepa nativa (6 réplicas)
Las dosis de nitrógeno total para el tratamiento no inoculado + nitrógeno fue de 420 mg de N.
Las macetas se colocaron en bloques al azar. Seis meses después del inicio del ensayo se evaluó el aspecto y tamaño de la planta, peso seco de la parte aérea y el nitrógeno fijado por cada planta por el método de Kjeldahl.
RESULTADOS
Ensayo de infección
Las plantas de tamarugo y algarrobo inoculadas con cepas Rhizobium especificas para las especies Prosopis, aisladas en la Pampa del Tamarugal se evaluaron en cuanto a su capacidad de formación de nódulos doce semanas después de la inoculación. Se probaron ocho diferentes cepas nativas aisladas.
Esta evaluación se realizó por:
En el Cuadro l se indican los resultados del test de infección en las ocho cepas evaluadas (C1 a C8).
CUADRO 1
Test de infección con cepas nativas de Rhizobium
en Prosopis alba y Prosopis tamarugo
| Tratamientos (1) | Nodulación (% plantas noduladas) | |
|---|---|---|
| Prosopis alba | Prosopis tamarugo | |
| C1 | 0 | 0 |
| C2 | 100,0 | 77,7 |
| C3 | 100,0 | 50,0 |
| C4 | 0 | 0 |
| C5 | 0 | 0 |
| C6 | 5,0 | 10,0 |
| C7 | 50,0 | 10,0 |
| C8 | 0 | 0 |
(1) Resultados promedio de doce repeticiones
Los nódulos aparecieron entre la quinta y sexta semana después de la inoculación. En general, aparecieron en raíces secundarias nuevas. Los nódulos de los tratamientos C2 y C3 presentaron excelente aspecto y tamaño. Al realizar un corte transversal mostraron color rojo oscuro en su interior, indicando la presencia de leg-hemoglobina y, por ende, fijación de nitrógeno por parte de la planta. Los nódulos formados por los tratamientos C6 y C7 resultaron pequeños.
Conclusiones
De las ocho cepas de Rhizobium aisladas en la Pampa del Tamarugal, sólo serían efectivamente microorganismos del género Rhizobium las cepas C2, C3, C6 y C7. De éstas, sólo la C2 y C3 son suficientemente infectivas como para ser consideradas en la etapa “determinación de ‘efectividad’ o capacidad de fijar nitrógeno” por parte de las plantas noduladas. Entre ellas se eligió la cepa C2 por haber presentado una nodulación más temprana que la cepa C3. En otras plantas leguminosas una nodulación precoz está relacionada con una mayor efectividad y mejor productividad.
Efectividad de cepas de Rhizobium en Prosopis alba y Prosopis tamarugo
La evaluación del ensayo se realizó a seis meses de la fecha de inicio.
La respuesta de las diferentes cepas utilizadas se realizó seis meses después de su inoculación mediante:
En los Cuadros 2 y 3 se presentan los resultados del efecto de la inoculación en Prosopis alba y P. tamarugo, con la cepa nativa C2 y las cepas extranjeras F-1 y F-2.
CUADRO 2
Evaluación de efectividad en fijación de nitrógeno
en Prosopis alba inoculado con diferentes cepas (1)
| Tratamiento | Nodulación (%) (2) | Tamaño planta promedio (cm) | Peso seco x planta (mg) | Nitrógeno (%) (base seca) |
|---|---|---|---|---|
| Control no inoculado | 0 | 29 | 70,7 | 3,1 |
| No inoculado + nitrógeno | 0 | 32 | 105,6 | 3,7 |
| Inoculados | ||||
| F-1 (3) | 75,0 | 26 | 67,8 | 3,1 |
| F-1 (4) | 100,0 | 28 | 68,9 | 3,5 |
| C2 (3) | 67,0 | 26 | 70,4 | 3,4 |
| C2 (4) | 100,0 | 29 | 109,8 | 2,7 |
(1) Resultados promedios de cuatro a seis repeticiones.
(2) No se cuantificó número de nódulos, porque la mayoría de las plantas presentaban sólo 2 ó 3 nódulos.
(3) Semillas inoculadas recién germinadas.
(4) Plantas inoculadas ocho semanas después de la germinación.
Las plantas inoculadas no nodularon en su totalidad. Considerando el aspecto general, los resultados se correlacionaron bastante bien con el peso de materia seca y el nitrógeno fijado.
Los nódulos crecieron siempre en las raíces secundarias, muy cerca del punto de desarrollo de la raíz principal. Todas las plantas noduladas presentaron sólo 2 ó 3 nódulos, bastante pequeños pero de buen aspecto y de color rojo en su interior. El carácter individual de los nódulos es típico de la morfología indicada en la literatura para P. Alba.
La cepa que mostró mejor rendimiento en materia seca, incluso sobre el testigo con nitrógeno, es la cepa nativa, aislada en la Pampa del Tamarugal. Sin embargo, presentó una baja tasa de nitrógeno, lo que indicaría una baja actividad específica de nitrogenasa, por parte de los nódulos.
Los tratamientos respondieron bien a la inoculación, ya que fijaron un porcentaje de nitrógeno superior al tratamiento testigo, aunque el rendimiento en materia seca fue similar. Esto podría explicarse por el corto período del ensayo. En general, para poder diferenciar mejor las respuestas a los diferentes tratamientos en especies arbóreas, el ensayo debería realizarse por períodos más largos.
En conclusión, puede decirse que las plantas fijan nitrógeno del aire, desarrollándose bien en un medio carente de nitrógeno, lo que indicaría que las cepas inoculadas son eficientes.
Cabe hacer notar que en plantas de Prosopis alba hubo diferencia en cuanto a porcentaje de nodulación respecto al momento de la inoculación. Las plantas inoculadas ocho semanas después de la germinación presentaron 100% de nodulación, a diferencia del otro tratamiento, que sólo presentó 75 y 67% de nodulación.
CUADRO 3
Evaluación de efectividad en fijación de nitrógeno
en Prosopis tamarugo inoculado con diferentes cepas (1)
| Tratamiento | Nodulación (%) (2) | Tamaño planta promedio (cm) | Peso seco x planta (mg) | Nitrógeno (%) (base seca) |
|---|---|---|---|---|
| Control -no inoculado | 0 | 8,1 | 4,5 | 3,2 |
| No inoculado + nitrógeno | 0 | 23,6 | 30,5 | 4,9 |
| Inoculados | ||||
| F-1 (3) | 25,0 | 11,1 | 27,7 | 3,6 |
| F-1 (4) | 75,0 | 7,8 | 13,3 | 3,6 |
| C2 (3) | 75,0 | 9,7 | 18,3 | 3,3 |
| C2 (4) | 75,0 | 7,6 | 17,1 | 3,5 |
(1) Los resultados son promedios de tres repeticiones. Se perdieron muchas plantas por ataque de hongos.
(2) No se cuantificó el número de nódulos, porque la mayoría de las plantas sólo presentaban de 2 a 3 nódulos.
(3) Semillas inoculadas recién germinadas.
(4) Plantas inoculadas ocho semanas después de la germinación.
Las plantas de tamarugo, en general, se veían débiles y enfermas.
La diferencia entre el tratamiento testigo y los tratamientos inoculados fueron notables, no tanto en tamaño como en desarrollo de follaje. En efecto, los rendimientos en materia seca sobrepasan varias veces el peso seco de las plantas testigo. El rendimiento máximo se obtuvo con el tratamiento nitrogenado, seguido del tratamiento inoculado de la cepa F-1, aunque esta cepa fue la que presentó menor porcentaje de nodulación.
El porcentaje de fijación de nitrógeno fue bastante parejo para todos los tratamientos, salvo para el testigo nitrogenado, que fue excepcionalmente alto.
En general, el porcentaje de nodulación en tamarugo es bastante más bajo que en algarrobo. Pequeños nódulos se presentaron dispersos en raíces laterales, aunque presentaban un buen color y aspecto general.
En Prosopis tamarugo no hubo diferencias notables en el porcentaje de nodulación en relación al momento de la inoculación, salvo para el tratamiento F-1. Esto bien podría atribuirse a problemas fitopatológicos.
Determinación del efecto de la salinidad en la fijación de nitrógeno en Prosopis alba y Prosopis tamarugo, inoculados con diferentes cepas de Rhizobium
La evaluación del ensayo se realizó seis meses después de la fecha de su inicio.
El efecto de la salinidad en la fijación de nitrógeno se evaluó por:
En los Cuadros 4 y 5 se presentan los resultados del efecto de la salinidad en la fijación de nitrógeno en las plantas leguminosas P. alba y P. tamarugo.
CUADRO 4
Efecto de la salinidad en la fijación de nitrógeno
en Prosopis alba inoculados con diferentes cepas (1)
| Tratamiento | Nodulación (%) (2) | Tamaño planta promedio (cm) | Peso seco x planta (mg) | Nitrógeno (%) (base seca) |
|---|---|---|---|---|
| Control - no inoculado | 0 | 29,0 | 70,7 | 3,1 |
| No inoculado + nitrógeno | 0 | 32,0 | 105,6 | 3,7 |
| Inoculados | ||||
| F1 - sal (3) | 70,0 | 33,5 | 128,3 | 2,9 |
| F1 - sal (4) | 100,0 | 25,5 | 92,5 | — |
| C2 - sal (3) | 67,0 | 26,0 | 104,4 | 3,1 |
| C2 - sal (4) | 100,0 | 31,0 | 130,1 | 2,3 |
(1) Los resultados son promedios de cuatro y seis repeticiones.
(2) No se cuantificó el número de nódulos, porque la mayoría de las plantas sólo presentaba de 2 a 3 nódulos.
(3) Semilla inoculada recién germinada.
(4) Planta inoculada ocho semanas después de germinación.
El aspecto de las plantas fue aceptable, tanto en tamaño como en rendimientos en peso seco. Todos los tratamientos respondieron mejor que el control no inoculado.
No existió correlación entre los pesos secos y el porcentaje de nitrógeno fijado por las plantas, en especial con el tratamiento C2.
Si se comparan los rendimientos en materia seca entre los tratamientos sin sal y con sal (Cuadros 2 y 4), se puede decir que el tratamiento con sal da mejores rendimientos, a pesar de que no existe la misma tasa de fijación de nitrógeno.
Los nódulos presentaron buen aspecto y crecieron siempre en las raíces secundarias.
CUADRO 5
Efecto de la salinidad en la fijación de nitrógeno
en Prosopis tamarugo inoculado con diferentes cepas (1)
| Tratamiento | Nodulación (%) (2) | Tamaño planta promedio (cm) | Peso seco x planta (mg) | Nitrógeno (%) (base seca) |
|---|---|---|---|---|
| Control no inoculado | 0 | 8,1 | 4,5 | 3,2 |
| No inoculado + nitrógeno | 0 | 23,6 | 30,5 | 4,9 |
| Inoculados | ||||
| F1 - sal (3) | 25,0 | 10,6 | 16,4 | 3,4 |
| F1 - sal (4) | 50,0 | 5,9 | 10,9 | 3,6 |
| C2 - sal (3) | 25,0 | 6,5 | 13,8 | 4,0 |
| C2 - sal (4) | 25,0 | 8,2 | 11,5 | 3,7 |
(1) Los resultados son promedios de tres repeticiones. Se perdieron muchas plantas por problemas con hongos.
(2) No se cuantificó el número de nódulos, porque la mayoría de las plantas sólo presentaba de 2 a 3 nódulos.
(3) Semilla inoculada recién germinada.
(4) Planta inoculada ocho semanas después de la germinación.
En general, el aspecto de las plantas fue deficiente, aunque el rendimiento en materia seca resulta bueno al compararlo con el tratamiento control no inoculado, pero sin lograr alcanzar a los valores del tratamiento No Inoculado + Nitrógeno.
En este ensayo tanto el porcentaje de nodulación, como la sobrevivencia de las plantas fueron bajos.
En P. tamarugo el tratamiento con 0,9% de sal fue menos efectivo que el tratamiento sin sal (Cuadros 3 y 5). Al comparar estos ensayos puede decirse que las plantas inoculadas responden mejor que el control no inoculado, pero la materia seca producida estaría bastante por debajo del tratamiento No Inoculado + Nitrógeno. La tasa de fijación de nitrógeno fue la esperada en este tipo de ensayos.
La baja sobrevivencia de las plantas de P. tamarugo en las condiciones utilizadas para este tipo de ensayos se atribuyó al ataque producido por hongos.
DISCUSION Y CONCLUSIONES
En primer lugar, se ha constatado a través de este estudio la existencia de nódulos en plantas de Prosopis pertenecientes a un ecosistema natural.
Estos nódulos sólo se encontraron en aquellos árboles que crecían en suelos en los que no había nitrógeno disponible.
En relación con los aspectos metodológicos generales de los ensayos de fijación de nitrógeno en plantas leguminosas de la especie Prosopis, se puede destacar que éstos deben realizarse a temperatura ambiente entre 28°C y 35°C. A temperatura bajo 26°C no ocurre nodulación.
El sistema de Jarros Leonard, utilizado frecuentemente en ensayos de fijación de nitrógeno en plantas leguminosas, no fue conveniente para la especie Prosopis, debido al alto régimen hídrico que presenta este sistema. Por ello, fue necesario reemplazarlo por el sistema de macetas con vermiculita como soporte inerte.
Otro hecho singular lo constituye el inadecuado desarrollo de las plantas de Prosopis tamarugo. Esto puede haberse debido a la susceptibilidad de esta especie al ataque de variados tipos de hongos, no observándose el mismo efecto en Prosopis alba.
Entre las conclusiones específicas extraídas de este trabajo pueden indicarse las siguientes:
 | Vista de un bosque de tamarugos. | |
| Excavación en árbol de P. tamarugo, con el fin de ubicar nódulos formados por Rhizobium. | ||
 | ||
Estudio correspondiente al proyecto “Zonas Aridas”, de la Gerencia de Desarrollo de la Corporación de Fomento de la Producción.
REFERENCIAS
1. NATIONAL ACADEMY OF SCIENCES, U.S. 1977. Leucaena, promising forage and tree crop for the tropics. Washington, D.C. 115 p.
2. FELKER P., CLARK P.R. 1980. Nitrogen fixation (acetylene reduction) and cross inoculation in 12 Prosopis (mesquite) species. Plant and Soil 57, 177–186.
3. BAILEY A.W. 1976. Nitrogen fixation in honey mesquite seedlings, J. Range Management 29, 479–481.
4. NATIONAL ACADEMY OF SCIENCES, U.S. 1979 Microbial Processes: Promising Technologies for Developing Countries. Washington, D.C.
5. PEPPLER H.J. 1967. Microbial Technology. Reinhold Publishing Corporation.
6. NUTMAN P.S. 1978. Breeding for high symbiotic effectiveness in red clover. Rothamsted Ann rev.
7. VINCENT J.M. 1970. A manual for the practical study of root-nodule bacteria. International Biological Programme Handbook No 15. Oxford. Blackwell Scientific Publications, 164 p.
8. Curso corto intensivo sobre “Tecnología de Rhizobium realizado del 7 al 26 de julio de 1980, en la Universidad Federal do Rio Grande do Sul, Brasil (auspiciado por MIRCEN, UNEP, UNESCO).
9. FELKER P. Comunicación personal.
María Elena Torres M.
Investigadora
Instituto de Investigaciones Tecnológicas, INTEC
Santiago, Chile
INTRODUCCION
La productividad de los suelos en zonas áridas y semiáridas a menudo se ve limitada no sólo por falta de agua, sino también por escasez de nitrógeno. Arbustos y árboles de la familia leguminosas del género Prosopis crecen abundantemente en estas áreas. Estas plantas presentan un gran potencial ya que son capaces de estabilizar y mejorar suelos, aprovechar muy bien el agua subterránea, y proveer sombra y forraje, además de producir leña y carbón.
El nitrógeno fijado por estas leguminosas puede ser aprovechado en parte por otras plantas no leguminosas cercanas. Por ejemplo, en Africa, se está utilizando Acacia albida para aumentar la productividad de maní, sorgo y mijo (1). De ahí la importancia de establecer adecuadamente la simbiosis Planta Leguminosa-Rhizobium específico. Una vez lograda la optimización de esta asociación simbiótica a través de la selección de cepas efectivas de Rhizobium especifico se puede sacar un máximo provecho a la fijación biológica de nitrógeno. No sólo se trata de que la planta se autoabastezca de nitrógeno, sino también se espera mejorar la calidad y productividad de los suelos.
La selección de las cepas se realiza primero en laboratorio, determinando si producen “infección” o nodulación en la planta. Luego se continúa con los ensayos de “efectividad” en invernadero o cámara de crecimiento, y posteriormente en terreno.
El rizobio que infecta más comúnmente al género Prosopis es el rizobio típico de las leguminosas tropicales.
La taxonomía del género Prosopis se ha basado hasta ahora en su afinidad por la planta hospedera. Recientemente se ha comprobado que existen algunas cepas que pueden infectar a varios grupos de plantas de diverso género. Esto es bastante común para rizobios que nodulan plantas tropicales y subtropicales, como el rizobio para cowpea (una especie de garbanzo). Tradicionalmente se consideraba a este microorganismo como promiscuo o inespecífico; sin embargo, en algunos casos ha presentado bastante especificidad (2). Este rizobio para cowpea ha sido clasificado en un nuevo género: Bradyrhizobium, aunque no todas las cepas capaces de infectar leguminosas tropicales pueden ser clasificadas así.
El objetivo principal de este trabajo es presentar el efecto de diferentes cepas de Rhizobium en la fijación de nitrógeno en Prosopis chilensis.
El ensayo se realizó con semillas procedentes de dos regiones diferentes pero en cada una de ellas se recolectaron separadamente las semillas de cada árbol.
MATERIALES Y METODOS
Medios de cultivo
Las diversas cepas de Rhizobium fueron cultivadas en un medio sólido de extracto de levadura con manitol (3).
Los ensayos de infección se realizaron en tubos conteniendo medio Jensen (3) libre de nitrógeno.
Cepas de Rhizobium
Las cepas de Rhizobium utilizadas son la cepa 139 (F originalmente, aislada de nódulos de mezquite que crecía en invernadero), la cepa 156 (obtenida de NIFTAL, aislada de P. chilensis) y la cepa 163 (C-2 originalmente aislada de nódulos de Prosopis tamarugo que crecía en la Pampa del Tamarugal).
Semillas
Las semillas utilizadas son colecciones únicas de un solo árbol de cada una de las poblaciones muestreadas: Prosopis proveniente de la Il Región (Accesión II-1) y Prosopis proveniente de Lampa (Accesión L).
Las semillas se trataron con ácido sulfúrico concentrado, durante 10 minutos. Luego se lavaron abundantemente con agua destilada estéril y se pusieron a germinar en placas de Petri con agar. Una vez germinadas se transfirieron a tubos con medio Jensen para test de infección o a macetas con vermiculita para el test de Efectividad. Se inoculó con la cepa de Rhizobium correspondiente, utilizando 1 ml de inóculo por cada semilla, que equivale a un contenido de alrededor de 107 a 108 células/ml.
Todos los ensayos se realizaron en cámara de crecimiento bajo condiciones controladas de temperatura, entre 29 y 32°C, fotoperíodo diario de catorce horas y humedad relativa del 30 a 40%.
En los test de infección sólo se verificó presencia o ausencia de nódulos y aspecto general de la planta. En los ensayos de efectividad se evaluaron los resultados a los cuatro meses de iniciado el ensayo, mediante medición de peso seco de la parte aérea de las plantas y nitrógeno total, por el método de Kjeldahl.
Se midió también la efectividad de los nódulos en reducción de acetileno por cromatografía gaseosa de acuerdo a métodos usuales (4 y 5).
RESULTADOS Y DISCUSION
Todas las plantas de Prosopis presentaron nodulación con las cepas de Rhizobium evaluadas.
Los resultados de los ensayos se presentan resumidos en los Cuadros 1 y 2.
Los resultados promedios de peso seco de la parte aérea, del nitrógeno total fijado por la planta y la actividad de la nitrogenasa evaluada por medio de la reducción del acetileno a etileno, fueron analizados estadísticamente por medio de Análisis de Varianza.
El coeficiente de correlación entre peso seco y nitrógeno total de la parte área de las plantas está altamente correlacionado (0,96 a 0,99, dependiendo del tratamiento). La reducción de acetileno a etileno no presenta una buena correlación con el peso seco y nitrógeno acumulado por la planta; para algunos tratamientos fue de 0,98 y en otros casos fue de 0,44.
CUADRO 1
Evaluación de la fijación biológica de nitrógeno
de tres cepas de Rhizobium en Prosopis chilensis II-I (1)
| Tratamiento | Peso seco parte aérea (mg/planta) | Nitrógeno base seca (mg/planta) | Peso seco nódulos (mg/planta) | Etileno (mg/mg nódulos/hora) |
|---|---|---|---|---|
| Cepa 139 | 833,3 | 16,2 | 25,4 | 28,9 |
| Cepa 156 | 576,4 | 11,0 | 14,4 | 15,8 |
| Cepa 163 | 646,1 | 10,9 | 26,8 | 16,0 |
| Testigo + Nitrógeno | 573,6 | 15,6 | 0,0 | |
| Testigo | 317,4 | 7,8 | 0,0 |
(1) Los resultados son promedio de 6 repeticiones.
Del análisis de varianza se observa que existe diferencia significativa entre los tratamientos inoculados y el testigo sin inocular, con un límite de confianza del 95%. Este hecho refuerza la hipótesis que estos árboles responden a la inoculación con la cepa de Rhizobium apropiada.
Por otra parte, no hay diferencia estadística significativa entre los diferentes tratamientos, considerando sólo el peso seco. Sin embargo, sí existe a un límite de confianza del 90% analizando el nitrógeno fijado. De este análisis se concluye que la cepa 139 se comporta mejor que la 163 y ésta mejor, a su vez, que la 156. Esta conclusión se corrobora al realizar un análisis de medias.
CUADRO 2
Evaluación de la fijación biológica de nitrógeno
de tres cepas de Rhizobium en Prosopis chilensis-Lampa (1)
| Tratamiento | Peso seco parte aérea (mg/planta) | Nitrógeno base seca (mg/planta) | Peso seco nódulos (mg/planta) | Etileno (mg/mg nódulos/hora) |
|---|---|---|---|---|
| Cepa 139 | 574,2 | 11,2 | 13,5 | 29,4 |
| Cepa 156 | 589,4 | 10,2 | 16,5 | 26,8 |
| Cepa 163 | 430,7 | 7,8 | 7,1 | 15,2 |
| Testigo + Nitrógeno | 352,2 | 8,1 | — | — |
| Testigo | 193,3 | 2,2 | — | — |
(1) Los resultados son promedios de 6 repeticiones.
Las plantas procedentes de la “accesión” Lampa presentan una alta variabilidad en todos los tratamientos; por este motivo se analizaron los resultados comparando las medias. De esto, se puede concluir que existe diferencia significativa entre los tratamientos inoculados y el testigo, pero no entre las plantas inoculadas.
CONCLUSIONES
Los resultados de este estudio muestran que la efectividad de la fijación biológica de nitrógeno en Prosopis chilensis puede variar, dependiendo de la cepa de Rhizobium.
Al mismo tiempo, parece prudente la recomendación de la práctica de la inoculación con el Rhizobium seleccionado al establecer nuevas plantaciones de Prosopis.
El comportamiento de plantas de diferentes poblaciones de Prosopis presenta alta variabilidad, tanto en relación al crecimiento y producción de biomasa, como en la efectividad de la fijación biológica de nitrógeno.
El contenido total de nitrógeno de la planta es el mejor indice de comparación cuando la planta crece en un medio libre de nitrógeno, en cambio el test de reducción de acetileno presenta mayor variabilidad.
Estudio correspondiente al Grant FGT-CL-1-83-13 de National Academy of Sciences, USA/NCR con un Grant de USAID.
REFERENCIAS
1. CHARREAU C., VIDAL P. 1965. Influence de l'Acacia albida sur le sol, nutrition minerale et rendements des mils Pennisetum au Senegal. L'Agron. Trop. 20, 600–626.
2. DOBEREINER J., CAMPELO A.B. 1977. Importance of legumes and their contribution to tropical agriculture, p. 191–220. In R.W.F. Hardy and H. Gibson (ed). A treatise on dinitrogen fixation, section 4: Agronomy and Ecology, John Wiley and Sons, New York.
3. VINCENT J.M. 1970. A manual for practical study of root-nodule bacteria. p. 164 IBP Handbook. Backwell Scientific Publications, Oxford.
4. SILVESTER W. Comunicación personal.
5. HARDY R.W., HALSTEN R.D., JACKSON E.K., BURNS R.C. 1968. The acetylene-ethylene assay for N2 fixation: laboratory and field evaluation. Plant Physiol. 43: 1185–1207.
6. FELKER P., CLARK P. 1980. Nitrogen fixation (Acetylene reduction) and cross inoculation in 12 Prosopis (mesquite) species. Plant and soil 57: 117–186.
7. DREYFUS B.L., DOMMERGUES Y.R. 1981. Nodulation of Acacia species by fast- and slowgrowing tropical strain of Rhizobium. Applied and Environmetal Microbiology. 41: 97–99.
Gabriel Cogollor Herreros
Facultad de Ciencias Agrarias, Veterinarias y Forestales
Universidad de Chile
Manuel Cheúl Ale
Departamento de Silvicultura y Manejo
Corporación Nacional Forestal
Miguel Poblete Rojas
Facultad de Ciencias Agrarias, Veterinarias y Forestales
Universidad de Chile
INTRODUCCION
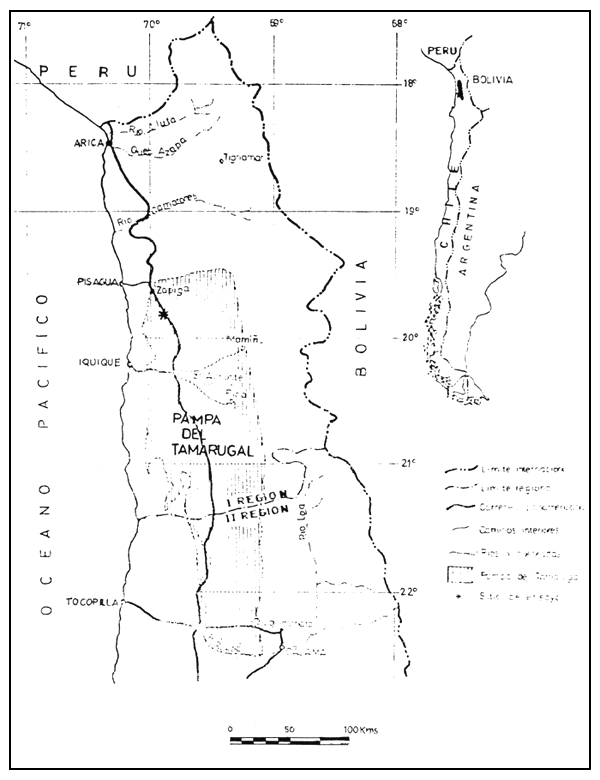
La Pampa del Tamarugal es una planicie con una superficie aproximada de 1.250.000 há entre la Quebrada de Tiliviche por el norte y el Río Loa por el sur, en la Primera Región. Al oriente limita con la Precordillera de los Andes y al poniente con los contrafuertes de la Cordillera de la Costa (Gráfico 1).
La actividad agrícola es reducida, localizándose en zonas con suficiente disponibilidad y calidad del agua, principalmente circunscritas a pequeñas quebradas y oasis (Habit, 1980).
Un recurso de potencial importancia son las formaciones vegetales con la especie Prosopis tamarugo Phil., “tamarugo”, presentando la masa natural más extensa cerca del pueblo de La Tirana (extremo norte del Salar de Pintados), con aproximadamente 100 há.
El ecosistema del tamarugo, representado por la Pampa del Tamarugal, es considerado como una pradera, cuyo objetivo principal es la producción de hojas y frutos que sirven de alimento al ganado (Habit, 1980).
Posee una inclinación de 1% a 2% de Este a Oeste, con altitud sobre el nivel del mar que varía entre 300 y 1.200 m (Bellinhurst, 1983).
El ecosistema de la Pampa del Tamarugal presenta un clima desértico normal, caracterizándose por elevadas temperaturas diurnas, gran oscilación térmica diaria, carencia casi absoluta de precipitaciones, presencia ocasional de neblinas, baja humedad relativa y alta radiación solar (Habit, 1980).
La humedad relativa media es muy baja, de modo que la sequedad impera en todo rigor (51%). (CORFO, 1965).
Aunque la humedad relativa del aire durante el día fluctúa entre 10 y 30%, se presentan varios días al mes con 80 y 100% de humedad, sin precipitar durante la noche. Normalmente, no se presentan grandes neblinas; sólo se registran unas 6 ó 10 durante los meses de diciembre a febrero, que coinciden con la temporada de precipitaciones en la cordillera y altiplano, fenómeno que se conoce como “invierno boliviano”.
Las temperaturas fluctúan entre mínimas absolutas de -5° a -12°C y máximas de 35° y 36°C, con un promedio de 250 días al año despejados y 550 cal/cm2 día. El promedio mensual de evaporación del suelo es de 260 m3/há fuera del bosque de tamarugos y de 50 m3/há dentro del bosque (Toro, 1967).
Los suelos constituidos por materiales de relleno de origen fluvial, provenientes de la Cordillera de los Andes, están cubiertos por una costra salina superficial de 0,10 a 0,60 m o más de espesor.
Los salares ocupan de preferencia la porción más meridional de esta pampa, con una superficie total estimada de 3.750 km2.
La superficie de los principales salares actualmente identificables (unos 1.700 km2) está compuesta por sales de sulfato cálcico y cloruro sódico, producto de la evaporación del extenso lago que ocupó esta sección de la Pampa del Tamarugal.
Dentro de este ambiente se encuentra Prosopis tamarugo Phil., la especie mejor adaptada y con posibilidades de ser una alternativa económica como productor primario de forraje (frutos y hojas).
Con la reforestación de tamarugo, tarea emprendida por la Corporación de Fomento de la Producción (CORFO), en 1965, se logró la plantación de 20.050 há, distribuidas en la siguiente forma (Informes Internos CORFO):
GRAFICO 1
Ubicación de la Pampa del Tamarugal
| SALARES | há |
|---|---|
| Pintados | 12.650 |
| Bellavista | 2.600 |
| Obispo (Zapiga) | 4.800 |
| Total: | 20.050 |
Investigaciones posteriores, realizadas por Toro (1967), Sudzuki et al. (1973) y CORFO (1971), en relación con los sistemas radiculares, absorción de humedad atmosférica y rendimiento forrajero, demostraron la acertada elección del tamarugo como especie a forestar.
Ya se observa, al realizar un viaje por la Carretera Panamericana Norte, el cambio logrado en la belleza escénica y el ambiente con las plantaciones de tamarugo, en contraste con el desierto; tal es así que habitantes de la ciudad de lquique y pueblos cercanos utilizan los referidos sectores como zona de recreación.
1. ANTECEDENTES ENTOMOLOGICOS
La producción de frutos en el tamarugo se ve afectada anualmente por la ocurrencia relativamente frecuente de larvas de lepidópteros que dañan las inflorescencias y frutos jóvenes, con valores estimados en un 75 por ciento.
Klein y Campos (1978) estudian y describen la distribución morfológica, biología y hábitos de artrópodos fitófagos del tamarugo, algunos endémicos de la zona asociados al follaje, ramillas, flores y frutos, señalados, además, como los principales enemigos naturales encontrados.
Entre las especies de mayor potencial reproductivo se destacan 3 lepidópteros: la mariposa violeta Leptotes trigemmatus Butler, la polilla del fruto Cryptophlebia carpophagoides Clarke y la polillita de la flor Ithome sp.
Además, los polinizadores nativos de las diferentes especies de Prosopis spp. de la zona, particularmente la abeja Centrix mixta Friese y la abeja melifera Apis mellifica introducida del centro del país, representan un factor importante en la utilización del tamarugo.
Posteriormente se realizaron ensayos de control químico de las plagas del tamarugo, demostrándose la posibilidad de aplicar tratamientos con productos económicamente rentables, cuidando de no incidir negativamente sobre los insectos polinizadores.
Con respecto al control biológico, como respuesta a las limitaciones establecidas por todo control químico de plagas, se orientó la investigación hacia el estudio de los entomófagos que limitan las poblaciones de las plagas más importantes del tamarugo (FAO/BID/1970).
Los antecedentes enunciados permitieron planificar el diseño de la investigación para las plantaciones de tamarugo en Zapiga.
Se planteó, como objetivos, la evaluación del daño por insectos en la producción de frutos de tamarugo y el estudio de su control químico.
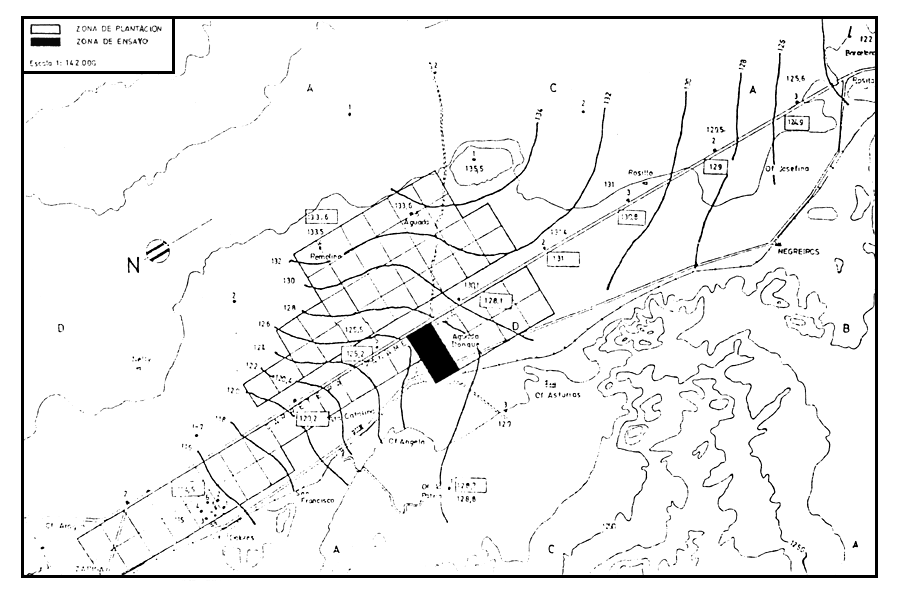
2. PLANTACIONES DE TAMARUGO EN ZAPIGA
Las plantaciones con tamarugo en Zapiga constituyen el extremo norte de las actividades de reforestación con esta especie en el país. Se encuentran ubicadas 180 km al sur de Arica, 126 km al oriente de Iquique, 72 km al norte del campamento de CORFO en Refresco, y 31 km al norte del pueblo más cercano, Huara.
Las plantaciones referidas se presentan ordenadas en 64 cuadrantes de 1 km × 1 km (Gráfico 2), de los cuales existen los siguientes datos de superficie y fechas de reforestación (Documentos Internos CORFO).
| Año de plantación | Superficie (há) |
|---|---|
| 1969 | 200 |
| 1970 | 1.400 |
| 1971 | 1.580 |
| 1972 | 1.400 |
| 1973 | 600 |
| Total 5.180 |
El diseño de la plantación presenta un ordenamiento en cuadrados con un distanciamiento entre árboles de 13,5 metros.
Las actividades de reforestación se iniciaron con 200 há en 1969. Estos dos cuadrantes de 1 km × 1 km se encuentran ubicados al lado sur del Campamento de Operaciones de CORFO en Zapiga, bordeando la Carretera Panamericana y el cordón cordillerano costero, entre las oficinas salitreras de Dolores por el norte y Negreros por el sur (Gráfico 2). En los cuadrantes referidos se instaló el ensayo.
GRAFICO 2
Plantaciones de Prosopis tamarugo en el Salar de Zapiga
3. DISEÑO E INSTALACION DE ENSAYOS
3.1 Diseño de ensayos
Dado el mayor tiempo de adaptación, supervivencia de la plantación y ubicación cercana al Campamento de Operaciones de CORFO en Zapiga, se definieron los dos cuadrantes de plantación del año 1969 como área de estudio.
La adaptación del tamarugo en 13 años se manifiesta en distintos crecimientos en altura y diámetros, notoriamente apreciables al comparar visualmente el tamaño de los árboles en las hileras de plantación, entre hileras y de oriente a poniente.
Existen condiciones del sitio y, posiblemente, de la constitución genética del tamarugo que determinan una variabilidad de crecimientos.
Elgueta y Calderón (1971) demuestran que existe una estrecha relación entre el crecimiento en altura y la edad del árbol.
Además, al tratar de explicar el crecimiento en altura, en función de la profundidad de la napa freática y de la salinidad de ella, no pudieron observar ninguna tendencia; no obstante, afirman, no es posible con los análisis realizados concluir que no exista relación.
Realizada la prospección de las 200 há con plantaciones de tamarugo, y dada la ordenación de los dos cuadrantes de oriente a poniente—además de los antecedentes de distinta profundidad de la napa subterránea (CORFO), la cual varía de 4 a 20 metros en Zapiga—, se estableció un muestreo del tipo sistemático en líneas para la evaluación del daño por insectos en la producción de frutos.
Para el estudio del control químico se planificó el ensayo con los siguientes antecedentes:
Insecticida:
Se utilizó Thiodan 50 P.M. (Hoechst).
Ingrediente activo: Endosulfan; Hexacloro-biciclohepteno — (Oximetileno) Sulfito en un 50%.
Materias inertes y humectantes en un 50%.
Razón de su uso:
Exito alcanzado en comparación con DDT polvo mojable 0,14% m.a.; SEVIN polvo mojable
0,85% m.a.; MALATHION polvo mojable 0,60% m.a. y DIPTEREX polvo mojable 0,75% m.a.;
THIODAN fue el insecticida más eficaz, con un aumento en la producción de frutos superior al
100% (FAO/BID, 1970).
THIODAN es un insecticida para el control de insectos chupadores y masticadores por acción
de contacto e ingestión. Posee cualidades selectivas al no afectar a parásitos y predatores. Además,
es bien tolerado por las abejas.
Equipo para aplicación:
Máquina moto asperjadora de 200 lt, montada sobre una camioneta.
Dosis:
La aplicación se hizo en dosis de 150 g de THIODAN por 100 litros de agua.
El gasto promedio de solución por árbol fue de 32 litros.
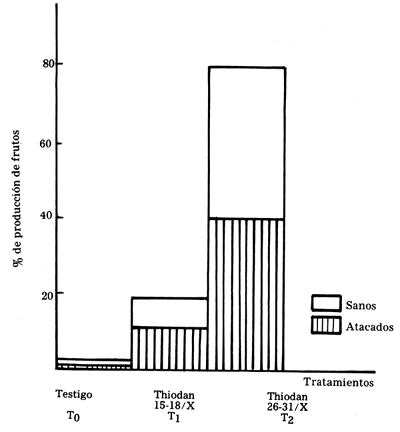
| T0 = | Producción de frutos en condiciones naturales. |
| T1 = | Producción de frutos bajo control químico. Aplicación THIODAN el 15 al 18 de octubre. |
| T2 = | Producción de frutos bajo control químico. Aplicación THIODAN el 26 al 31 de octubre. |
Fechas de aplicación se relacionan al porcentaje de flores abiertas. La bibliografía recomienda aplicar entre un 30–40% de flor abierta. En el estudio se realizó la aplicación entre un 40–50%.
Número de árboles en estudio:
T0 = 120 árboles
T1 = 45 árboles
T2 = 45 árboles
Evaluación:
Censo de la producción de frutos en kg × árbol.
4. RESULTADOS
4.1 Evaluación del daño por insectos en la producción de frutos de tamarugo
| Evaluación | Fecha | Muestra | No de Muestras | Intensidad del daño (%) | Porcentaje daño (%) |
|---|---|---|---|---|---|
| 1 | 28/IV | Racimo | 364 | 0– 25 | 66,5 |
| al 4/X | floral | 26– 50 | 17,0 | ||
| 51– 75 | 8,3 | ||||
| 76–100 | 8,2 | ||||
| 2 | 15–20/X | Racimo | 777 | 0– 25 | 6,4 |
| floral | 26– 50 | 5,4 | |||
| 51– 75 | 12,8 | ||||
| 76–100 | 75,4 | ||||
| 3 | 24–30/XI | Racimo | 811 | 76–100 | 92,0 |
| floral | |||||
| Frutos | 138 | 3 orif. x fruto | 22,2 | ||
| 4 | 7–12/XII | Frutos | 1410 | 5 orif. x fruto | 65,8 |
| 5 | 10–15/I | Frutos | 5936 | 3 orif. x fruto | 59,2 |
| 6 | 10–15/II | Arboles | 400 | 336 árb. s/fruto | 84,0 |
| 64 árb.c/fruto | 46,0 | ||||
| 7 | 10–15/III | Arboles | 365 | Todos con frutos | |
| Frutos | 2248 | 3 orif. x fruto | 70,0 | ||
| Racimo | |||||
| Floral | 323 | 0– 25 | 75,8 | ||
| 26– 50 | 9,6 | ||||
| 51– 75 | 6,5 | ||||
| 76–100 | 8,1 |
4.2 Evaluación de la producción de frutos de tamarugo en condiciones naturales y bajo control químico
| Evaluación | Fecha | Muestra | No de Muestras | Intensidad del daño (%) | Porcentaje daño (%) | |
|---|---|---|---|---|---|---|
| 8 T0 | 10–15/III | Arboles | 120 | 116 árb. s/fruto | 96,6 | |
| 4 árb. c/fruto | ||||||
| Frutos | 42 | 3 orif. x fruto | 52,4 | |||
| 8 T1 | Arboles | 45 | 32 árb. s/fruto | 71,1 | ||
| 13 árb. c/fruto | ||||||
| Frutos | 318 | 2 orif. x fruto | 59,2 | |||
| 8 T2 | Arboles | 45 | 15 árb. s/fruto | 33,3 | ||
| 30 árb. c/fruto | ||||||
| Frutos | 1343 | 1 orif. x fruto | 51,1 | |||
| Evaluación | Fecha | No de árb. en estudio | Arboles con frutos | Produc. media x árbol | Aumento de producción | |
| No | (%) | (kg) | (%) | |||
| 9 T0 | 10–15/IV | 120 | 4 | 3,33 | 0,87 | |
| 9 T1 | 45 | 13 | 28,88 | 2,38 | 273,56 | |
| 9 T2 | 45 | 30 | 66,66 | 4,03 | 463,21 | |
T0 = Producción de frutos en condiciones naturales
T1 = Producción de frutos bajo control químico, Thiodan, 15–18/X
T2 = Producción de frutos bajo control químico, Thiodan, 26–31/X
La altura promedio de los árboles en estudio es de 6,7 m, DAP 10,6 cm y diámetro de copa 5,6 m.
4.3 Resultados de la producción de frutos de tamarugo en condiciones naturales y bajo control químico
| Tratamiento | Muestra | No muestras | Producción de frutos | Daño | |
|---|---|---|---|---|---|
| No | (%) | (%) | |||
| T0 | Arboles | 45 | 16 | 0,96 | 52,4 |
| T1 | Arboles | 45 | 318 | 18,96 | 59,2 |
| T3 | Arboles | 45 | 1343 | 80,08 | 51,1 |
GRAFICO 3
Producción de frutos en Prosopis tamarugo Phil. bajo tratamiento químico
5. CONCLUSIONES
6. RECOMENDACIONES
En España se realiza un tratamiento químico mediante espolvoreo terrestre sobre bosques de encina (Quercus ilex) a bajo costo y con buenos resultados. La situación sanitaria es similar a la del tamarugo.
REFERENCIAS
ALAMOS F., PERALTA F. 1980. Evolución de los niveles del agua subterránea en el sector reforestado del Salar de Zapiga. CORFO. Santiago.
BELLINHURST A.G. 1983. La irrigación en Tarapacá. Imprenta y Librería Ercilla, Santiago, Chile.
CADAHIA D. 1970. Informe sobre el Plan Forestal Ganadero Pampa del Tamarugal, Depto. Tarapacá, CORFO, Estudio FAO para el BID, Chile. (Mimeografiado). 42 p.
CORPORACION DE FOMENTO DE LA PRODUCCION. 1973. Archivo de documentación sobre el Programa Forestal Ganadero de la Pampa del Tamarugal desde 1969–1973. (Informes internos), CORFO-Iquique, Chile.
CORPORACION DE FOMENTO DE LA PRODUCCION. 1975. Resumen de la investigación entomológica realizada en el Programa Forestal Ganadero de la Pampa del Tamarugal. Archivo de documentación. (Dactilografiado). 7 p.
ELGUETA H., CALDERON S. 1971. Estudio del tamarugo como productor de alimento del ganado lanar en la Pampa del Tamarugal. Instituto Forestal, Informe No 38, Santiago, Chile. 36 p.
FAO/BID. 1970. Informe sobre el proyecto de plantaciones de tamarugo y explotación ganadera en el Norte Grande, Chile, Washington D.C. (Programa Cooperative FAO/BID). 264 p.
FORNO H., PINO M. 1978. Evaluación Económica Programa Ganadero Forestal Pampa del Tamarugal Santiago, CORFO, Gerencia de Desarrollo Iquique. 69 p.
HABIT M. 1980. Contribución al conocimiento del árbol forrajero de desierto Prosopis tamarugo Phil., FAO Santiago Chile. 124 p.
INGENIEROS CONSULTORES ASOCIADOS. 1975. Estudio de Prefactibilidad de Explotación Ganadera basada en tamarugo. Pampa del Tamarugal, Iquique. (Dactilografiado). 105 p.
KLEIN K.C., CAMPOS L. 1977. Biocenosis del tamarugo Prosopis tamarugo Phil., con especial referencia de los artrópodos y fitófagos y sus enemigos naturales. Zeitschrift für angewandte Entomologie Sanderdruck ans Bol. 85: 86–108.
LAMAGDELAINE L. 1972. Programa Forestal Ganadero Pampa del Tamarugal y Programa Altiplano de Tarapacá. Universidad de Chile CORFO-Iquique, Centro de Documentación. Depto. de Ciencias Sociales Publicación No 2. (Mimeografiado). 49 p.
SUDZUKI F. 1969. Absorción foliar de humedad atmosférica en tamarugo Prosopis tamarugo Phil. Boletín Técnico No 30, Fac. de Agronomía, Universidad de Chile. 23 p.
SUDZUKI F., BOTTI C., ACEVEDO E. 1973. Relaciones hídricas del tamarugo Prosopis tamarugo Phil. en la localidad de Canchones. Boletín Técnico No 37, Facultad de Agronomía, Universidad de Chile. 23 p.
LEON H. 1974. Estudio comparativo de espolvoreo y pulverizaciones para el control de insectos de tamarugo Prosopis tamarugo Phil. Tesis de Grado, Fac. de Agronomía, Universidad de Chile.
TORO J.M. 1967. Evaporación de distintos tipos de suelos de la Pampa del Tamarugal. (Inédito) CORFO.