1. L'aquaculture interagit avec l'environnement: elle utilise ses ressources et lui cause des changements. De nombreuses interactions ont des effets bénéfiques. Dans ce chapitre, on passe rapidement en revue les effets bénéfiques de l'aquaculture côtière et ceux qui sont potentiellement négatifs (voir 3.1 et 3.2). Les implications de la pollution sur l'aquaculture côtière sont ensuite examinées (3.3). Enfin, les implications sociales du développement aquacole côtier sont soulignées (3.4).
3.1 Avantages de l'aquaculture côtière
2. Généralement, l'expansion de l'aquaculture a les effets socio-économiques bénéfiques suivants: approvisionnements en aliment qui contribuent à améliorer la nutrition et la santé; création de revenus et d'emplois; diversification de la production primaire; enfin, chose toujours plus importante pour les pays en développement, augmentation des recettes en devises grâce à l'exportation de produits à valeur élevée (PNUD/Norvège/FAO, 1987; Schmidt, 1982).
3. L'aquaculture est également encouragée parce qu'elle permet compenser le faible taux de croissance des pêches de capture. Le repeuplement des eaux continentales et côtières par des organismes en provenance d'écloserie peut aider les pêcheries fondées sur l'aquaculture (Larkin, 1991).
4. Le développement durable de l'aquaculture peut contribuer à la prévention et à la réduction de la pollution aquatique car il se base essentiellement sur des ressources en eau de bonne qualité.
5. L'élevage de mollusques et d'algues peut, dans certain cas, compenser les processus d'enrichissement en éléments nutritifs et organiques des eaux eutrophysées. Réciproquement, la production des eaux oligotrophes peut être améliorée par les éléments nutritifs et les déchets organiques en provenance des installations aquacoles.
6. L'aquaculture peut contribuer à la réhabilitation des zones rurales grâce à la réutilisation des terres dégradées.
3.2 Effets négatifs potentiels de l'aquaculture côtière
7. Après une courte description des zones écologiques clefs (GESAMP, 1991c; Weston, 1991; Gowen et al., 1990; PNUE, 1990a; Pullin, 1989; Rosenthal et al., 1988), les principaux effets négatifs sur l'élevage des algues, des mollusques et poissons sont étudiées (Braaten et Hektoen, 1991; Pillay, 1990; Chua et al., 1989; Baluyut, 1989; Iwama, 1991).
3.2.1 Zones écologiques clefs
Enrichissement en éléments nutritifs et organiques
8. De nombreuses activités aquacoles aboutissent à rejeter régulièrement dans le milieu des déchets métaboliques (matières fécales ou pseudo-fécales et excrétions) et des aliments non consommés. En général, les déchets solubles se retrouvent dans la colonne d'eau et les déchets organiques dans les sédiments.
9. Les matières inorganiques solubles (azote et phosphore) peuvent entraîner l'enrichissement en éléments nutritifs (hyperalimentation) du plan d'eau qui peut être suivi d'une eutrophysation (augmentation de la production primaire). Les changements de l'écologie du phytoplancton peuvent provoquer un bloom algal qui peut être dangereux pour les organismes sauvages et pour ceux d'élevage. Quoi qu'il en soit, il en existe aucune preuve que de tels blooms aient été provoqués par l'aquaculture côtière.
10. La plus grande partie des déchets solides, qui se compose principalement de carbone organique et d'azote, se dépose sur le fond aux abords immédiats de la ferme. L'enrichissement organique de l'écosystème benthique peut provoquer un accroissement de la consommation d'oxygène par les sédiments et les rendre donc anoxiques; dans des cas extrêmes, un dégagement de dioxyde de carbone, de méthane et d'hydrogène sulfuré augmente la minéralisation de l'azote organique et réduit la biomasse de la macrofaune, l'abondance et la variété des espèces.
11. II existe un effet très localisé de réduction de la concentration en oxygène dissous de l'eau aussi bien sur le fond qu'en surface aux abords de la ferme, qui est dû à l'énorme demande en oxygène biochimique des déchets organiques et des besoins respiratoire du stock en élevage.
Dégradation des habitats des zones marécageuses
12. Les terres côtières marécageuses comme les mangroves figurent parmi les écosystèmes les plus productifs; de plus, elles contribuent à maintenir l'intégrité écologique et la productivité des eaux côtières adjacentes et sont également des lieux privilégiés de reproduction et de nurserie pour de multiples espèces commerciales de poissons, mollusques et crustacés. De nombreux pays tropicaux ont perdu d'énormes superficies de mangroves qui ont été converties en étangs pour poissons ou crevettes, conversion souvent accompagnée de la salinisation et de l'acidification des sols et des aquifères.
Utilisation de produits chimiques
13. De nombreux produits chimiques sont utilisés en aquaculture, à savoir: les produits thérapeutiques, les désinfectants, les anesthésiques, les biocides, les hormones et les facteurs de croissance afin d'éliminer les prédateurs, de prévenir et d'enrayer les maladies et parasites, de modifier le sexe, la viabilité productive et la croissance des organismes élevés. On se préoccupe actuellement de la durée de vie des composants actifs dans les tissus des animaux, du sort et des effets de ces composants et de leurs résidus dans l'environnement aquatique (par exemple, toxicité pour des organismes non visés) et de la stimulation de la résistance des communautés microbiennes aux antibiotiques.
Interactions biologiques
14. L'introduction et le transfert d'espèces pour les besoins de l'aquaculture peuvent altérer ou appauvrir la diversité biologique et les ressources génétiques de l'écosystème marin par reproduction croisée, prédation, compétition, destruction de l'habitat et peut- être transmission de parasites et de maladies.
15. L'élevage à grande échelle de bivalves dans les baies côtières peut interagir avec l'alimentation marine d'une part, en éliminant une partie importante du plancton et des détritus organiques et, d'autre part, en entrant en compétition avec d'autres organismes planctophages.
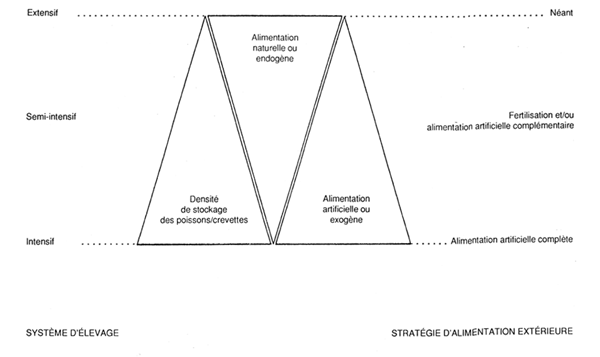
Figura 1 - Contribution relative des aliments naturels et artificiels à la satisfaction des besoins nutritionnels des poissons et crevettes en élevage extensif, semi-intensif et intensif (Tacon, sous presse). 16. Des maladies peuvent apparaître à cause du stress causé aux animaux en élevage par de nombreuses pratiques aquacoles et à cause des conditions entourant l'élevage. En effet, le stress augmente la sensibilité et la prédisposition aux maladies infectieuses. Certaines qualités d'eau accroissent la virulence des organismes pathogènes potentiels. La concomitance du stress et d'organismes pathogènes peut provoquer l'apparition de maladies. Toutefois, il a été particulièrement difficile de démontrer clairement que des maladies ont été transmises par des animaux en élevage aux animaux sauvages (Iwama, 1991; Baluyut, 1991).
3.2.2 Effets potentiels des systèmes d'élevage sur l'environnement
17. Lorsque l'on considère les effets sur l'environnement d'élevages particuliers, il est important de faire la distinction entre élevage extensif, semi-intensif et intensif. En système extensif, la densité des organismes en élevage reste faible et une alimentation additionnelle peut éventuellement être fournie par la fertilisation. En élevage semi-intensif, les animaux sont maintenus à une densité supérieure; le milieu de culture est souvent fertilisé et une alimentation supplémentaire peut être distribuée. En aquaculture intensive, la densité en animaux est encore supérieure et l'alimentation est régulière, souvent fournie sous forme d'aliment spécial préparé/manufacturé. La figure 1 présente la contribution relative de l'alimentation naturelle et artificielle dans la balance nutritionnelle des poissons et crevettes en système d'élevage extensif, semi-intensif et intensif (Tacon, sous presse).
Cultures d'algues
18. Les algues, organismes autotrophes, se situent au niveau le plus bas de la chaîne trophique de l'écosystème aquatique; elles utilisent les éléments nutritifs de l'eau et produisent de l'oxygène dissous durant la journée , mais en consomment durant la nuit. Les algues sont cultivées (Tono, 1986, 1990; Wu, 1990; Llana, 1991; Santelices et Doty, 1989; Bird, 1989; Tseng, 1987) dans les eaux peu profondes du bord de la mer en utilisant des lignes, des filets qui sont soit fixés sur le fond soit attachés à des radeaux flottants ou à des bouées. De plus en plus, certaines algues sont également cultivées dans des étangs, des bassins ou des canaux.
19. Les principaux effets potentiels de l'élevage des algues en mer (tableaux 1 et 2) sont dus probablement aux grandes surfaces requises pour ce type d'élevage qui peuvent affecter les communautés benthiques et la production primaire de la colonne d'eau (Phillips, 1990). La sédimentation des matières organiques en provenance des cultures peut également provoquer des changements dans les communautés benthiques, en particulier là où le courant a été diminué.
20. Jusqu'à présent, on n'a pas publié de données démontrant l'impact écologique dû à l'utilisation de produits chimiques pour éliminer les organismes polluants et les prédateurs et lutter contre les maladies, par exemple l'acide sulfanilique, le paraquat utilisés sur les cultures de Porphyra et de Gracilaria (Chen, 1991). Des fertilisants inorganiques et parfois des engrais organiques sont appliqués pour compenser la diminution des éléments nutritifs. La fertilisation des cultures de Laminaria en Chine a provoqué l'augmentation de la production de phytoplancton et d'invertébrés dans les zones d'élevage (PNUD/FAO, 1989).
21. On se préoccupe également des effets négatifs du transport d'algues d'une région à une autre. Par inadvertance, Sargassum muticum a été introduite du Japon en Europe, où sa prolifération a causé à la navigation de réels problèmes dans certaines régions (Rueness, 1989).
| OPERATION ET CONSEQUENCES | EFFETS POSITIFS | EFFETS NEGATIFS |
|---|---|---|
| Nettoyage et préparation des zones d'élevage | Amélioration de la production et de la gestion | Perte potentielle d'espèces indigènes et de diversité d'habitat |
| * > * * | ||
| Gestion de routine (éclaircie, récolte) | Comme ci-dessus | Comme ci-dessus |
| * > * * | ||
| Protection contre la lumière par croissance des algues | Réduction de la compétition | Réduction de la colonne d'eau et de la production benthique |
| * >* * | ||
| Atténuation des vagues et des | Abri pour les espèces sensibles | Augmentation de la sédimentation |
| courants | ||
| * > * * | ||
| Conséquences esthétiques * > ** * | Productivité côtière accrue dans les écosystèmes dégradés | Conflits d'utilisation |
| Perte de valeur de ressource | ||
| Espace *> * * * | Productivité accrue des écosystèmes arides ou dégradés | Conflits d'utilisation (p. ex. avec les pêcheurs) |
| Superficie et volume du substrat * > * * * | Productivité accrue des écosystèmes arides ou dégradés | Modifications de l'écosystème |
* * = effets potentiellement significatifs
| OPERATION ET CONSEQUENCES | EFFETS POSITIFS | EFFETS NEGATIFS |
|---|---|---|
| Qualité de l'eau | Augmentation d'oxygène, | Réduction de phytoplancton côtier |
| * > * * | suppression des éléments nutritifs, | |
| production d'algues | Cycles des éléments nutritifs | |
| “Maladies” | ||
| Fertilisation et traitements chimiques | Production d'algues | Qualitè des produits |
| * > * * | ||
| Augmentation de la production en | Changements de qualité de l'eau | |
| polyculture | ||
| Benthos | Augmentation de la production en | Changements des espèces |
| * > * * | polyculture (p. ex. avec des | benthiques et de la production |
| mollusques) | ||
| Productivité de la colonne d'eau | Augmentation de la production | Prédateurs |
| * > ** * | d'invertébrés et de poissons | Changements de structure de la |
| communauté | ||
| Abri pour les alevins | ||
| Polyculture |
* * = effets potentiellement significatifs
Elevage de bivalves
22. Les bivalves, animaux sédentaires, ont besoin de substrats pour l'attachement du naissain et pour la croissance; ils se nourrissent par filtration de phytoplancton, détritus, protozoaires et bactéries. Les cultures d'huîtres, de moules, de palourdes, de clovisses et de coquilles Saint-Jacques se basent sur le phytoplancton disponible naturellement et requièrent donc une superficie considérable de zones intertidales et d'eau près des côtes. Les bivalves sont cultivés sur le fond ou dans la colonne d'eau, sur toute une gamme de substrats comme les coquillages, les tuiles, les pieux, les cordes, les plateaux, les radeaux, etc. (Nash, 1991; Dore, 1991 Perez Camacho et al., 1991; Angell, 1991; Lovatelli, 1990; Cai et Li, 1990; Chew, 1989; Sitoy, 1988).
23. La culture à grande échelle des bivalves consomme de grandes quantités de phytoplancton, surtout s'il existe de nombreuses unités d'élevage sur une vaste superficie. Il peut en résulter une diminution de la productivité primaire dans les baies côtières. Au Japon, la culture de 50.000 à 60.000 huîtres à réduit de 76 à 95 pour cent la quantité de seston (principalement phytoplancton). Il a été démontré que des cultures en suspension de moules vertes en Nouvelle-Zélande faisaient disparaître jusqu'à 60 pour cent des aliments disponibles dans l'eau. C'est ainsi que la production primaire d'une zone beaucoup plus grande que celle de la ferme peut être requise pour assurer la croissance maximum des moules d'élevage (Hiskmann,1989). Un élevage de moules sur radeaux dans les rias espagnols enlève 35 à 40 pour cent de plancton et de détritus (Figueras, 1989), parmi lesquels sont retenus 30 pour cent de carbone, 42 pour cent d'azote, et 60 pour cent de chlorophylle a de la matière organique présente dans l'eau (Perez Camacho et al., 1991). Néanmoins, on a également avancé que la production primaire pourrait être stimulée par l'accroissement du taux de cyclage des éléments nutritifs (Rosenthal et al., 1988), mais il n'existe pas de preuve directe de l'augmentation de la production primaire à proximité des fermes. Les cultures de bivalves sont en concurrence avec d'autres espèces herbivores planctoniques; cela a été démontré au ria de Arousa (Espagne) où les cultures suspendues de moules ont remplacés les copépodes comme organismes planctophages dominant.
24. Les installations utilisées pour l'élevage des bivalves modifient la rapidité du courant ainsi que la direction des mouvements de l'eau. A leur tour, ces modifications peuvent altérer les modèles d'érosion et de sédimentation des particules. Une réduction de la circulation de l'eau peut se traduire par une diminution de l'érosion naturelle due à l'action des vagues, qui peut à son tour provoquer l'envasement et l'accumulation des matières en suspension dans les zones de culture.
25. Outre ces effets physiques, les bivalves produisent des pseudofèces ou fèces (biodéposition) qui constituent des déchets riches en matières organiques sous forme de particules. Par exemple, dans la baie de Hiroshima, un radeau contenant 420.000 huîtres produit 1 6 tonnes de matières fécales sur une période de croissance de 9 mois, production qui peut, si 1.000 radeaux sont en place, avoir un impact majeur sur la sédimentation dans la baie. En France, on a calculé que les cultures d'huîtres sur tables produisent de 7, 6 à 99 g de C/m2/jour en fonction des saisons et de la production de plancton. En Suède, le dépôt des sédiments sous un élevage de 100 tonnes de moules a été estimé à 7 kg de matière sèche/m2 (équivalent à 1 kg de C/m2) durant une période d'élevage de 1,5 à 2 ans, ce qui correspond à un taux de sédimentation de 3 g de C/m2/jour (Dahlback et Gunnarson, 1981). Donc, pour une ferme qui couvre une superficie de 1.500 m2, la sédimentation de matière sèche sera d'environ 10 t et la hauteur des sédiments accumulés sous les radeaux atteindra 10 cm par saison d'élevage (Sweden, 1983). Les données sur la production de déchets, la sédimentation et l'accumulation des sédiments des élevages de moules sont résumées dans les tableaux 3 et 4 (NCC, 1 989). En France, pratiquement 30 pour cent des élevages de moules et d'huîtres doivent faire face à des problèmes de sédimentation, qui obligent parfois à changer de lieu d'élevage (Weston, 1991).
26. Le dépôt de déchets organiques peut provoquer des changements physico- chimiques du substrat, particulièrement aux abords des sites cultivés. L'enrichissement en matières organiques des sédiments stimule l'action bactérienne; cette dernière provoque une désoxygénation du substrat et de l'eau de fond due à la réduction de la concentration en oxygène de l'eau interstitielle, à l'augmentation la consommation d'oxygène, à la réduction des sulphates, à la dénitrification, et à l'accroissement des éléments nutritifs organiques tels que les nitrates, les nitrites, l'ammoniaque, les silicates et phosphates libérées par les moules (Smaal, 1991). La régénération des éléments nutritifs potentiellement limitants peut accroître la production primaire.
27. Les communanutés benthiques situées sous les cultures suspendues peuvent être affectées de différentes façons (Kaspar et al., 1985). La macrofaune peut être totalement absente directement sous les cultures. Aux alentours des sites d'élevage, la richesse en espèces est réduite et les plus tolérantes à cet enrichissement deviennent dominantes. Dans le nord-ouest de l'Espagne (Freire et al., 1991), les crabes ont changé de régime alimentaire et sont devenus plus nombreux, en raison de la culture des moules, là où le transport de matériel organique en provenance des fermes augmentait la biomasse de la macrofaune benthique au-delà de la zone côtière des baies. Gowen et al. (1988), ayant examiné la documentation, ont résumé les effets écologiques possibles de l'élevage des moules sur radeaux (voir figure 2).
28. L'introduction de bivalves peut avoir des effets négatifs sur l'environnement (Chew, 1990), particulièrement quand des parasites et des maladies sont également introduits. La réintroduction en Europe de l'huître plate européenne (Ostrea edulis) en provenance de l'Amérique du Nord a entraîné la diffusion de Bonomia ostreae, parasite des globules de l'huître, qui a dévasté le secteur européen de l'huître plate. Deux prédateurs des bivalves, le Ceratoderma inornatum de l'huître japonaise et le vers plat de l'huître (Pseudostylochus ostreophagus) ainsi que le copépode parasite Mytilicola orientalis, qui peuvent affecter fortement diverses espèces de bivalves, ont été introduits en même temps que l'huître du Pacifique (Crassostrea gigas) du Japon en Amérique du Nord. De même, l'introduction et le transfert d'espèces de moules peuvent favoriser la diffusion de maladies infectieuses et de parasites qui sont dangereux pour les moules elles-mêmes et pour d'autres bivalves (Bower et Figueras, 1989).
Elevage de crevettes
29. La plupart des crevettes sont élevées dans des étangs en terre, bien que des enclos et des cages soient utilisés dans certain cas (Tookwinas, 1990; Walford et Lam, 1987). Ces étangs peuvent couvrir de vastes superficies côtières, souvent obtenues par reconversion de rizières, de salines, de plantations de cocotiers ou de canne à sucre, de terres abandonnées et de mangroves (Chong, 1990a; Aitken, 1990).
30. Il est certain que de vastes marais à mangroves ont été défrichés pour permettre la construction d'étangs à crevettes (Terchunian et al., 1986; Kapetsky, 1987a), mais il est important de reconnaître que les mangroves ont été également utilisées à d'autres fins, comme la sylviculture, l'agriculture et la construction d'étangs de pisciculture (Andriawan et Jhamtani, 1989; Soemodihardjo et Soerianegara, 1989; Zamora, 1989; FAO, 1985a; Neal, 1984).
| Espèces et systèmes | Production fécale | Références |
|---|---|---|
| Mytilus | 14,3–149,3 | Arakawa et al. |
| galloprovincialis | mg Ps/individu/24h | (1971) |
| M. edulis | 1,76 gPs/gPs moule/an | Kautsky et Evans (1987) |
| côtes naturelles population | 0,13 gC " | |
| 0,001 7 gN " | ||
| 0,00026 gP " | ||
| M. edulis | 9,5 kg carbone/m2/an | Rodhouse et al. (1985) |
| radeaux | 1 ,1 kg azote/m2/an | |
| M. edulis | 0,88 kg carbone/m2/an | Rosenberg et Loo (1983) |
| palangres | ||
| M. edulis | 27 g carbone/m2/24h | Cabanas et al. |
| balsas | (1979) | |
| M. edulis | 2,4–3,3 g carbone/m2/24h | Dahlback et Gunnarsson |
| palangres | 1,7 (station de réf.) | (1981) |
| M. edulis | 0,5–2,5 g carbone/m2/24h | Tenore et al.(1982) |
| radeaux |
| Espèces et systèmes | Profondeur | Vitesse du courant | Accumulation des sédiments | Références |
|---|---|---|---|---|
| M. edulis | 11–13 m | “très faible” | 7–30 cm | Weston (1986a) |
| M. edulis | 8–13 m | ~3 cm/s | 10–15 cm | Dahlback et |
| palangres | Gunnarsson | |||
| (1981) | ||||
| M. edulis | pas de données | > 1 cm/an | Misdorp et al. | |
| (1984) | ||||
| M. edulis | > 15 m | jusqu'à | biodépositions | Rodhouse et al. |
| radeaux | 200 cm/s | non sig. | (1985) | |
| coquilles de | ||||
| moules | ||||
| présentes | ||||
| M. edulis | “courants forts” | biodépositions | Earll et al. | |
| non sig. | (1984) | |||
| 2 palangres | coquilles de | |||
| 3 palangres | moules | |||
| présentes |
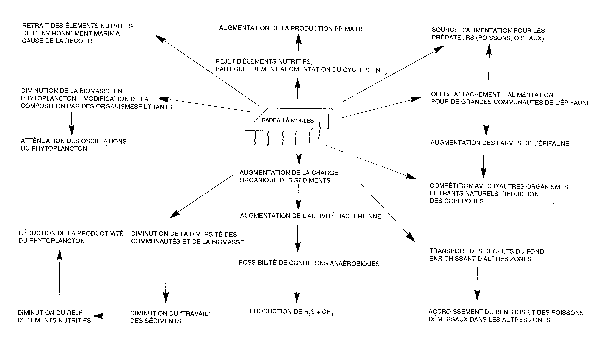
Figure 2 - Résumé des effets écologiques possibles de l'élevage de moules sur radeaux. Note: certains effets sont contradictoires, et tous ne sont pas observés sur un même site (d'après Gowen et al., 1988).
31. La destruction des mangroves en vue de la construction d'étangs peut affecter d'une façon significative la configuration des côtes et les modes d'érosion côtière, la production et les cycles des éléments nutritifs dans les zones côtières, de même que l'habitat de nombreuses espèces commercialement importantes qui utilisent la zone intertidale pour la reproduction, la nurserie et l'alimentation (Honculada Primavera, 1991; Saclauso, 1989; Matthes et Kapetsky, 1988). En fonction de la superficie de mangroves détruite et du stade de dégradation, la base de la production aquatique peut passer d'une alimentation par les détritus à l'alimentation par le plancton (Kapetsky, 1987b).
32. Les étangs construits sur des mangroves ont généralement des sols sulfatés acides (Pedini, 1981; Simpson et Pedini, 1985, 1987). L'oxydation des pyrites (FeS2) se produit durant le séchage du fond des bassins et conduit à la libération d'acide sulfurique dans l'eau de l'étang et dans toute les eaux adjacentes, d'où l'acidification et la production de phosphate d'aluminium soluble hautement toxique (Chua et al., 1989) et d'hydroxyde de fer, responsable du colmatage des branchies (Singh, 1987). De sérieux problèmes de sédimentation et d'envasement sont prévisibles lorsque le fond des étangs construits dans les zones à mangroves est remplacé par de la terre provenant de zones plus élevées qui est déchargée dans les mangroves voisines, comme cela se fait parfois en Thaïlande (Chantadisai, 1989). L'application régulière de chaux pour neutraliser les sols acides et la fertilisation sur une longue période peuvent provoquer le durcissement des sols, qui sont alors moins adaptés à l'élevage de la crevette.
33. La zone intertidale à mangroves ne se prête bien qu'aux méthodes d'élevage assez extensif puisque l'apport et le renouvellement de l'eau se font seulement grâce aux marées. L'élevage intensif exige normalement plus d'1 m de profondeur d'eau, ce qui, dans la zone intertidale, impose aussi un pompage pour sécher complètement les étangs durant leur préparation. Poernomo (1990) compare, du point de vue de l'économie et de l'environnement, l'utilisation des zones intertidales ou supratidales pour les différents types d'élevage (voir figure 3 et tableaux 5 et 6).
34. La construction de canaux pour l'apport d'eau et le drainage ainsi que le pompage d'eau saumâtre à terre provoquent des changements hydrologiques, l'envasement et l'entrée d'eau salée (Mahmood, 1987; Cholik et Poernomo, 1987). Le pompage et le transport par camion citerne de l'eau salée aux petites écloseries peut affecter la qualité des sols (Yap, 1990). La prise d'eau douce en provenance des nappes phréatiques pour élevage intensif en étang, peut également provoquer la salinisation des nappes épuisées et a certainement entraîné de graves effondrements de terrain à Taiwan (Liao, 1989).
35. Il est probable que l'utilisation de fertilisants et d'aliments (déchets de poissons, chair de moules, têtes de crevettes et aliments composés) pour augmenter la production, (Kontara, 1988) peut altérer la qualité de l'eau et des sédiments dans les étangs et dans les eaux adjacentes. Leur utilisation excessive risque de provoquer l'accroissement de la charge en éléments nutritifs et en matière organique (Akiyama et Chwang, 1989).
36. Des fertilisants, comme les superphosphates triples, l'urée, le fumier de vaches et de poules, le son de riz (Apud et al., 1983; Chamberlain, 1991: Sin et al., 1989) qui sont utilisés pour favoriser la croissance des organismes servant d'aliments aux crevettes peuvent contribuer à augmenter la charge d'éléments nutritifs et de matière organique. L'apport d'aliments provoque également des charges d'éléments nutritifs et de matières organiques sous forme de métabolites dissous (ammoniaque, urée et dioxyde de carbone) et de particules (aliments non mangés et fèces), qui peuvent entraîner la formation de sédiments anoxiques et la prolifération excessive d'algues dans les étangs. Dans un système d'élevage semi-intensif ou intensif, 30 à 40 pour cent du volume total d'eau de l'étang est pompé-et drainé journalièrement pour apporter l'oxygène nécessaire et rejeter les excédents d'éléments nutritifs et de déchets organiques. Les besoins en eau sont donc considérables; par exemple, à Taiwan, 11 000 à 21 430 m3/t de production sont nécessaires pour l'élevage semi-intensif et 29 000 à 43 000 m3/t pour l'élevage intensif (Chien et al., 1988; Wickins, 1986; cités tous deux dans Phillips et al., 1991).
37. Les effluents déchargés reflètent la qualité de l'eau dans les étangs. De fortes variations des paramètres de qualité de l'eau des effluents ont été enregistrées (Phillips et al., sous presse) sur une période de croissance de 5 mois dans un élevage intensif de crevettes en Thaïlande (tableau 7). Une charge très élevée en matières organiques et en éléments nutritifs est prévisible durant la récolte, le drainage et le nettoyage des étangs en raison de la décharge additionnelle de matériel qui était préalablement lié au sédiment. Malheureusement, il existe très peu de données sur la quantité et la qualité des effluents en provenance d'étangs de crevetticulture ainsi que sur les effets sur les eaux qui reçoivent ces effluents. Cependant, le rejet de ces effluents riches en éléments nutritifs et en matière organique peut avoir pour effets négatifs la sédimentation et l'envasement, l'anoxie, l'hyperalimentation et l'altération de la productivité et des structures des communautés benthiques.
38. De nombreux produits chimiques sont utilisés dans l'élevage de la crevette (Sunaryanto, 1988; Baticados et al., 1990; Liu, 1989). Des antibiotiques comme le chloramphénicol, l'oxytétracycline, le furazolidone, la streptomycine ou le nitrofurazone sont utilisés aussi bien dans les écloseries que dans les bassins d'élevage afin de traiter et de prévenir les maladies. L'utilisation excessive d'antibiotiques (Brown, 1989) peut être extrêment dangereuse car elle risque d'entraîner l'apparition de pathogènes résistants (p.ex. Vibrio) et ensuite le transfert de cette résistance aux pathogènes de l'homme. La diffusion de souches résistant aux médicaments est à prévoir dans les zones d'élevage de crevettes à haute densité de fermes. L'abus des antibiotiques dans les écloseries taiwanaises a provoqué une résistance et un très faible taux de survie de ces crevettes élevées dans les étangs (Lin, 1989). On sait que l'abus de formaline et de vert de malachite est dangereux non seulement pour les algues mais également pour le zooplancton, y compris les nauplii de penaeide. Les espèces indésirables sont éradiquées par l'utilisation de sulphate de cuivre pour les algues, de dérivés de plantes comme pesticides biodégradables tels les cendres de tabac (nicotine), les tourteaux de graines de thé (saponine), l'extrait de racines de Derris (rotenone), de même que les pesticides organiques pour les mollusques comme les hydrocarbures chlorés (DDT, endrine, aldrine, thiodane) et les composés organiques à base d'étain (brestan et aquatin). Ces pesticides organiques sont particulièrement importants à cause de leur toxicité, de leur persistance, et de leurs effets potentiels sur la qualité des produits et la santé humaine. Aucun effet écologique n'a encore été signalé en ce qui concerne les désinfectants et les produits chimiques utilisés pour le traitement de l'eau et des sols comme l'hypochlorite de sodium, le chlorure de benzalkonium, le carbure de calcium, le Na-EDTA, et les zéolites.
39. Il est de plus en plus évident que certains pathogènes de la crevette comme le virus responsable de la nécrose infectieuse hypodermique et hémapoïétique et le bacilovirus de la crevette monodon ont été diffusés par l'introduction et le transfert d'espèces commerciales. L'apparition de maladies des crevettes a également été imputée à l'intensification excessive de l'élevage et à la détérioration de la qualité de l'eau et des sédiments dans les étangs et dans les eaux adjacentes due à la surcharge en déchets. Le syndrome de la carapace molle, la maladie rouge et les crevettes bleues semblent liés au problème des sols sulfatés acides (Baticados et al., 1990; Brock, 1991), bien qu'aucune preuve définitive n'ait pu être présentée. Les pertes de production dues aux maladies et aux problèmes de gestion des étangs ont provoqués l'abandon des fermes et leur déplacement. A cet égard, Lin (1989) a résumé les causes de l'écroulement de l'élevage de la crevette à Taiwan (voir annexe 1).
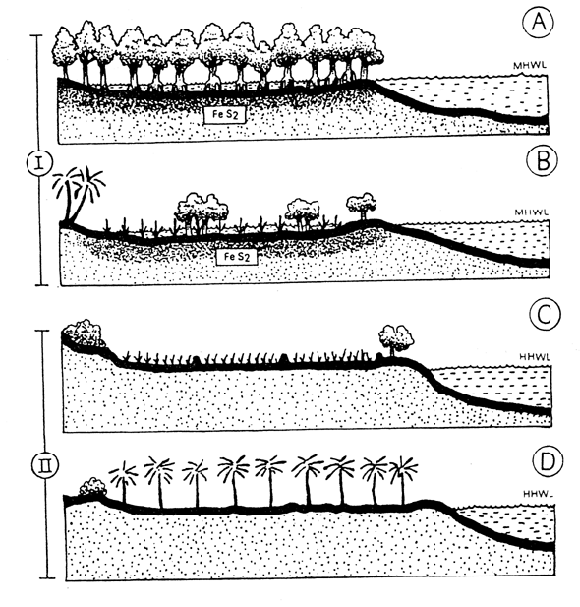
Figure 3 - Zones côtières pour l'élevage de la crevette. I. zone intertidale: mangrove vierge (A); forêt secondaire (B). II. Zone supratidale: rizière (C); plantation de cocotiers (d); (Poernomo, 1990).
| Zone côtière | Etendue de la marée | Propriété | Travail de | Productivité des étangs | Traitement des sols | Type de technologie appliquée | |
|---|---|---|---|---|---|---|---|
| Type/texture | pH* | contruction et coût** | |||||
| ZONES INTERTIDALES | |||||||
| Mangroves vierges | submergé à laisse de haute mer basse (PMM) | tourbe/pyrite | 2,5–3,5 | + + + + | très faible initialement | bonification (assèchement et lessivage) avant l'utilisation | extensive |
| Mangovres secondaires (arbustes) | submergé à laisse de haute mer basse | pyrite/tourbe | 2,4–4,0 | + + + | très faible initialement | bonification avant l'utilisation | extensive à semiintensive |
| Zones submergées herbeuses | submergé à laisse de haute mer moyenne (PMI) | pyrite/limon argileux | 3,5–5,0 6,5–7,0 | + + | faible initialement | bonification avant l'utilisation | extensive à semiintensive |
| Plantation de cocotiers | submergé à laisse de haute mer moyenne le long des fossés PMI | pyrite/limon argileux | 3,5–5,0 6,5–7,0 | + + | relativament faible initialement | bonification avant l'utilisation | extensive à semiintensive |
| ZONES SUPRATIDALES | |||||||
| Rizières/récoltes terres sèches | au-dessus de laisse de haute mer haute(PMV) | limon argileux à limon | 7,0 | + | élevée dès le début | pas de traitement spécifique | seulement intensive |
| Plantation de cocotiers | au-dessus de laisse de haute mer haute (PMV) | limon argileux sableux | 7,0 | + | élevée dès le début | pas de traitement spécifique | seulement intensive |
| Herbe et autres | au-dessus de laisse de haute mer haute | sable mélangé à argile, limon et sable | 7,0–8,0 | + | élevée dès le début | pas de traitement spécifique | seulement intensive |
| sableux | 7,0–8,0 | poreux, pas valable pour tambak | |||||
** + très aisé, coût le plus bas
+ + + + très difficile, coût très élevé
| Paramètres et étapes de mise en valeur | Zone intertidale | Zone supratidale |
|---|---|---|
| Type de terrain | Mangroves et zones submergées herbeuses | Terrains plats irrigués et secs |
| Hauteur par rapport à la mer | Intertidal, entre moyenne basse mer et moyenne haute mer | Au-dessus de la haute mer, moins de 2 m au-dessus de la moyenne des eaux hautes |
| Type de sols | Surtout potentiellement sulphatés acides (contenu élevé en pyrite et moins en tourbe) | Ne contient généralement pas de sols sulphates acides |
| Coût des terrains | Les zones non mises en valeur appartiennent à l'Etat et peuvent être louées à un prix très bas | Les terres appartiennent surtout au secteur privé et sont cultivées, coûts élevés à très élevés |
| Défrichement du terrain | Très coûteux pour les zones boisées | Très peu |
| Coût de construction | Faibles pour les élevages extensifs à grands bassins peu profonds. Très élevés pour élevage intensifs | Seulement pour les bassins d'élevage intensif. Faibles pour bassins à digues en terres; élevés pour bassins à digues en ciment |
| Réalisation | Principalement travail manuel, mécanisation limitée, travaux longs | Largement mécanisée. Travail manuel seulement pour petites finitions. Construction peut se terminer rapidement |
| Conditionnement des bassins avant la production | Bonification. Plusieurs mois sont nécessaires si les sols sont sulphatés acides | Les opérations de production peuvent commencer dès la fin de la construction |
| Préparation des bassins | L'assèchement du fond des bassins est un problème chronique. qui s'aggrave si la qualité des digues est mauvaise | Assèchement complet facile. Temps de préparation beaucoup plus court |
| Remplissage des bassins | Par gravité á marée haute. Un peu de pompage en élevage semi-intensif | Basé sur les pompes quelles que soient la technologie et la densité d'empoissonnement |
| Lutte contre les ravageurs | Difficultés pour contrôler l'entrée d'organismes extérieurs nuisibles | Entrées bien moins importantes d'organismes extérieurs indésirables, lutte plus facile |
| Récolte | Opération longue dépendant largement des marées. Peut affecter la qualité des produits | Rapide, possible à n'importe quel moment |
| Impact sur l'environnement | Destruction des mangroves si l'opération n'est pas rigoureusement contrôlée | Introduction d'eau salée, salinisation des terres et des nappes phréatiques |
40. La crevetticulture a aussi une incidence biologique liée à l'apport de post-larves et d'aliments. Bien que le peuplement au moyen de post-larves produites en écloseries se développe constamment, les post-larves sauvages sont souvent préférées (Hirono et Van Eys, 1990), ce qui peut conduire à une pêche excessive et au rejet de 10 kg de larves et d'alevins d'autres espèces pour chaque kilogramme de larves de crevette récolté (Silas, 1987).
| Dimensions des bassins (ha) | 0,48 – 0,56 |
| Profondeur des bassins (m) | 1,5 – 1,8 |
| Salinité (ppt) | 10 – 35 |
| Température (°C) | 22 – 31 |
| pH | 7,5 – 8,9 |
| Phosphore total (mg/l) | 0,05 – 0,4 |
| Azote total (mg/l) | 0,50 – 3,4 |
| Ammoniac total (mg/l) | 0,05 – 0,65 |
| Oxygène dissous (mg/l) | 4,0 – 7,5 |
| Chlorophylle a (μgl/l) | 20 – 250 |
| Solides en suspension totaux (mg/l) | 30 – 190 |
| Renouvellement d'eau (%/jour) | 5 – 40 |
41. En 1988, l'élevage de crevettes en Asie a consommé 180 000 t de farine de poisson utilisée pour la fabrication d'aliments composés et on a estimé que 1,1 million environ de tonnes d'aliment pour crevettes seront nécessaires en l'an 2000. Cette demande croissante pourrait éventuellement entrer en concurrence avec les espèces pêchées pour la consommation humaine et avec leurs juvéniles (New et Wijkstrom, 1990).
Elevage de poissons
42. L'élevage de poissons côtiers se fait surtout en étangs, en enclos, en cages ou en bassins (Chua, 1982; Padlan, 1982; Beveridge, 1987).
43. Avant même l'expansion de la crevetticulture, de vastes zones, spécialement de mangroves, ont été dégradées, à cause de l'élevage de poissons herbivores ou détritivores comme les sérioles et les muges en étangs d'eau saumâtre. L'élevage de ces espèces en eau saumâtre pose également des problèmes écologiques potentiels liés aux sols sulfatés acides, à la dégradation de la qualité de l'eau et des sédiments, à la sur-fertilisation et à l'utilisation des produits chimiques (organotines employées comme molluscicides), qui peuvent affecter sérieusement les écosystèmes proches des mangroves (Poernomo et Singh, 1982; Ti et al., 1982; Kapetsky, 1982).
44. Toutefois, les problèmes écologiques potentiels liés à l'enrichissement en éléments nutritifs et en matières organiques dans l'unité d'élevage et à l' extérieur apparaissent plus fréquemment dans les élevages semi-intensifs et surtout dans les élevages intensifs de poissons carnivores qui ont besoin d' un apport de nourriture (Mok, 1982). Les éléments nutritifs et les déchets organiques, dissous dans l'eau ou sous forme de particules, provenant des aliments non consommés et des excrétions, provoquent généralement un accroissement des solides en suspension, de la demande biochimique en oxygène (DBO), de la demande chimique en oxygène (DCO), et de la teneur en carbone, azote et phosphore. Malheureusement, la plupart des informations disponibles à ce sujet concernent les espèces des zones tempérées.
45. On donne ci-après quelques exemples concernant la charge d'effluents en provenance d' installations aquacoles basées à terre. La demande annuelle en oxygène et les éléments nutritifs rejetés par tonne de truites arc-en-ciel produite en étang dans une installation danoise ont été estimés à 300 kg de DBO5/t/an, et à 10 kg de P-total/t/an et à 81 kg N-total/t/an (Suède, 1 983). Quant aux bassins contenant des saumons adultes de l'Atlantique (Bergheim et Forsberg, 1992), une fourchette de valeurs (exprimées en g/kg de poisson/24 h), a été enregistrée pour ce qui est de la charge d'effluents: 0,5 – 1,4 g de matières sèches en suspension, 0,01 – 0,05 g de phosphore total, 0,15 – 0,30 d'azote total et 0,1 – 0,2 g d'azote ammoniacal total, avec un taux de conversion de 1,0 – 1,2 d'aliment sec par kg de poisson produit. Les résultats de cette étude sont présentés à la figure 4, dans laquelle la charge d'effluents est indiquée par rapport à la quantité d' aliments distribuée.
46. Rosenthal et al. (1988) ont constaté de grandes différences de charges lorqu'ils ont regroupé les estimations des effluents de différents élevages intensifs de truites utilisant soit des étangs soit des bassins (tableau 8). Des analyses comparées plus récentes (Beveridge et al., 1991) sur la qualité des effluents de la pisciculture en eau douce de saumons ont confirmé la grande variabilité des données sur la charge des effluents. On peut donc conclure que de nombreuses variables influent sur la qualité des effluents, comme les espèces élevées, la taille, le type et l' intensité de l' élevage, la gestion, la température, la méthode de décharge et la dilution ou le traitement plus ou moins poussé avant le rejet.
47. En ce qui concerne les déchets en provenance des élevages en cages flottantes, l'estimation de la production de déchets solides pour les élevages de salmonidés varie de 0,3 à 0,7 de matière sèche par kg de poisson produit (Weston, 1991). Une pisciculture norvégienne typique en cages, avec une production annuelle de saumon de 200 t et des techniques d' alimentation bien organisées, produirait approximativement 2 t de phosphore, 1 8 t d'azote et consommerait 100 t d'oxygène sous forme de DBO7 (Seymour et Bergheim, 1991). Gowen et Bradbury (1987) ont estimé qu'un élevage de salmonidés, produisant 50 t/an et utilisant 100 t d'aliment/an, produit 19,4 t de carbone organique, 2,2 t d'azote organique et 4,0 t de déchets solubles azotés (voir figures 5 et 6). Une étude de terrain a montré que jusqu' à 76 pour cent du carbone et 76 pour cent de l' azote utilisés pour l' alimentation de saumons en cages sont relâchés dans le milieu marin sous forme de déchets solubles et solides et que les facteurs principaux qui déterminent le niveau d'enrichissement du benthos et de la colonne d'eau sont la dimension de la ferme, les méthodes d'élevage et l' hydrographie du site (Gowen et al., 1988).
48. Il est évident qu'un taux élevé d'échange d'eau est nécessaire pour l'élimination des déchets et l'oxygénation des élevages situés tant sur terre qu'en mer. La dilution/dispersion et l' aire de distribution et de sédimentation des déchets et leurs effets potentiels sur l' environnement autour des fermes sont déterminés par la rapidité des courants et la profondeur des eaux qui recoivent les déchets en provenance des effluents des étangs/bassins ou des cages.
49. Certains ont avancé que la charge, en provenance d'élevages, en azote inorganique dissous (ammoniaque, nitrate et nitrite) et, dans le cas d'eaux saumâtres, en phosphore, peut affecter le stock existant, la composition par espèces ou la productivité du phytoplancton et des macroalgues. Toutefois, Weston (1991), ne prévoit d'effets localisés et mesurables sur les communautés de microalgues que dans le cas d'un élevage exceptionnellement dense et dans des baies à faible renouvellement d'eau (voir également Aure et Stigebrandt, 1990; Frid et Mercer, 1989; Turrel et Munro, 1989).
50. Les particules de matière organique se déposent aux abords de la ferme si leur vitesse de sédimentation est supérieure à la vitesse du courant. Les solides qui se déposent sur le fond de la mer sont enrichis en carbone, azote et phosphore par rapport aux sédiments naturels (Holmer, 1991) et ils causent probablement des changements physico- chimiques des sédiments sous les installations ou aux environs, notamment l'augmentation du contenu en carbone organique, suivi par un accroissement du taux de consommation d'oxygène des sédiments et une diminution du potentiel rédox des sédiments (Brown et al., 1987), par la production d'hydrogène sulfuré et de méthane (Lumb, 1989), et l'accroissement de l'azote organique et inorganique (Kaspar et al., 1988) du phosphore, du silicium, du calcium, du cuivre et du zinc (Rosenthal et al., 1 988). Cependant, il semble que ces effets physico-chimiques sont limités aux abords immédiats des fermes.
51. La zone d'extension des effets écologiques subséquents sur la communauté macrobenthique sous-jacente et aux alentours des cages peut être décrite (NCC, 1989) comme suit (voir également tableau 10): a) absence de macrobenthos (la zone azoïque, si elle existe, n'est généralement présente que sous les cages); b) dominance d'espèces tolérant l' enrichissement (la zone opportuniste, qui peut s'étendre jusqu'à 30 m du site), c) retour graduel aux conditions historiques, qui se fait généralement à 30 m de distance de la ferme au maximum, bien que les effets puissent parfois se prolonger jusqu'à 100 m du site. En ce qui concerne les installations piscicoles à terre, des effets similaires peuvent être prévus bien qu'il n'existe pas de données spécifiques.
52. L'intensité et l'étendue dans l'espace de ces effets d'enrichissement dépendent généralement de divers facteurs comme les caractéristiques de production de la ferme, la profondeur, la topographie du fond, la vitesse du courant et l'exposition à l'augmentation des mouvements de l'eau (p. ex. tempêtes) qui déterminent la dispersion latérale des particules en suspension, la production de matières organiques par unité de surface, l' affouillement et la redistribution des sédiments (voir également Hakanson et al., 1988; Lauren-Maatta et al., 1991; Kupka Hansen et al., 1991). La capacité des communautés indigènes d' assimiler et de minéraliser ces déchets organiques peut également présenter de l'importance.
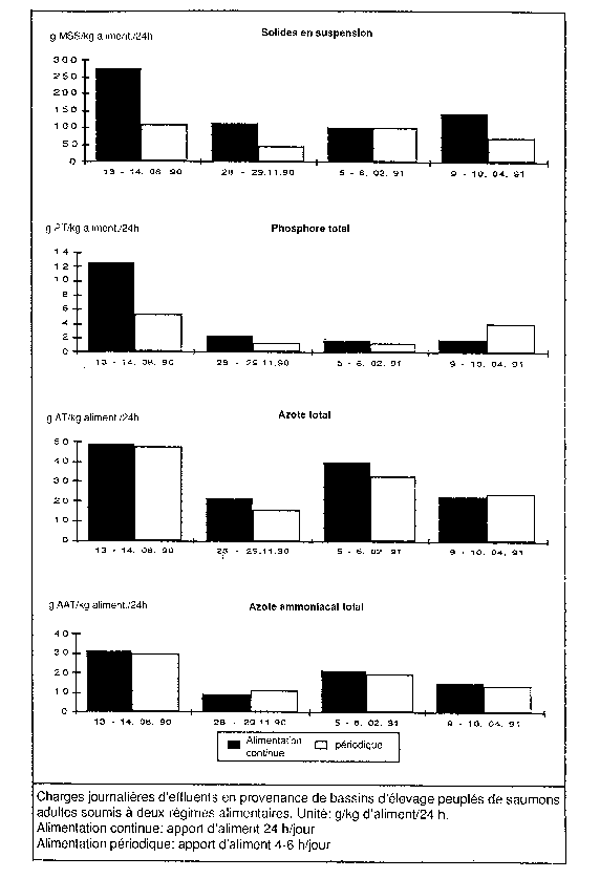
Figure 4 - Exemples de charges d'effluents en provenance de bassins d'élevage de saumons adultes de l'Atlantique (Bergheim et Forsberg, 1992).
| Systèmes | Espèces | Taille | Taux d'alimentation (% poids corporel) | Type d'aliment | Charges nettes | Références |
|---|---|---|---|---|---|---|
| Bassins et étangs | Salmo trutta, (biomasse 2 260 kg) | 2,2–100 g | 17,5–1,3% | boulettes sèches, distribution manuelle + automatique | 11,5 g DCO/kg de poissons/24h 2,7 g DBO7/kg de poissons/24h 0,05 g P Total/kg de poissons/24h 0,9 g SS/kg de poissons/24h | Bergheim et al. (1982) |
| Bassins et étangs | Salmo trutta, (biomasse 7 320 kg) | 1,0–25,0 g + géniteurs | 3–6% | boulettes sèches + humides, distribution manuelle | 75,3 g DCO/kg/24h 83,3 g DBO7/kg/24h 0,43 g P Total/kg/24h 0,24 g PO4P/kg/24h 1,4–3,8 g N Total/kg/24h | Bergheim et al. (1982) |
| Etangs | Salmo trutta, truite arc-en-ciel (biomasse 2 690) | 0,2–500 g | 0,55–4,5% | boulettes sèches, distribution manuelle | 17,0 g DCO/kg/24h 7,1 g SS/kg/24h 0,45 g N Total/kg/24h 0,08 g P Total/kg/24h 0,05 g PO4P/kg/24h | Bergheim et al. (1982) |
| Bassins et étangs | Salmo trutta, (biomasse 5 970 kg) | 1–550 g | 0,5–16% | aliment sec, distribution automatique | 3,1 g DCO/kg/24h 1,6 g DBO7/kg/24h 1,2 g SS/kg/24h 0,13 g N Total/kg/24h 0,05 g P Total/kg/24h 0,03 g PO4P/kg/24h | Bergheim et al. (1982) |
| Etangs 12 700 m2 | Truite arc-en-ciel | 35–150 g 500–2 000 g | ? ? | boulettes sèches | 0,4–0,8 g N Total/kg/24h 0,05 g P Total/kg/24h 1,6–4,6 g DBO7/kg/24h | Bergheim + Selmer-Olsen (1978) |
| Etangs | Truite arc-en-ciel | 2,0–300 g | ? | boulettes sèches et aliment semi-humide | 0,5–1,4 g N Total/kg/24h 0,13–0,18 g P Total/kg/24h 1,9–5,7 g DBO5/kg/24h | Markham (1978) |
| SS | DBO | NH4-N | NO2N | NO3-N | N TOTAL | PO4 | P TOTAL | Réf. |
|---|---|---|---|---|---|---|---|---|
| (a) g kg poisson-1 jour-1 | ||||||||
| 0.0–7,1 | 1,6–2,7 | 0,1–3,8 | 0,02–0,27 | 0,01–0,43 | a | |||
| - | 1,4–8,1 | - | - | - | - | - | - | c |
| 0,8–0,9 | - | 0,3–0,8 | - | 0,13–0,21 | - | 0,07–0,17 | - | b |
| - | - | 0,03 | - | 0,05 | 0,12 | 0,033 | 0,10 | d |
| (b) kg poisson-1 an-1 | ||||||||
| 474–4 015 | 510–990 | 37–180 | - | 0–548 | - | - | 22–1 10 | e |
| 1 350 | 285 | 55, 5 | 1,81 | 10,2 | - | - | 15,7 | f |
| 350 | 45 | - | - | 83 | - | 1 1 | g | |
| (c) g kg aliment-1 | ||||||||
| - | 80–300 | - | - | - | - | - | 11 | c |
| 183 | 165 | 25 | 0,27 | 0 | - | 26 | 4,0 | h |
| 80–280 | 100–370 | - | - | - | 37–48 | - | 4,7–10,8 | i |
a Bergheim et al. (1982);
b Clark et al. (1985);
c Butz et Vens Cappell (1982);
c Korzeniewski et al. (1982);
d Alabaster (1982);
e Solbe (1982);
g Warrer-Hansen (1982);
h Butz (1988);
i Makinen (1988)
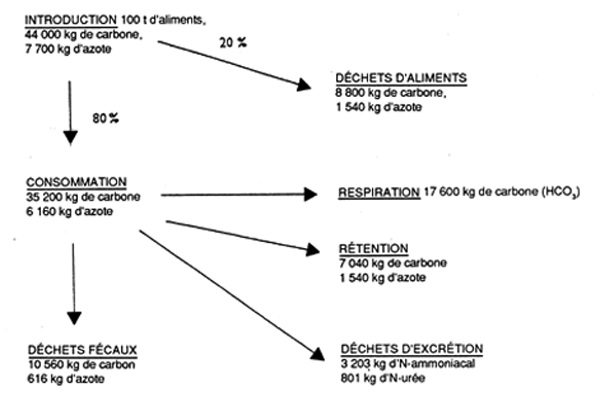
Figure 5 Estimation du flux de carbone et d'azote dans un élevage de salmonidés ayant une production annuelle de 50 t (Gowen et Bradbury, 1987).
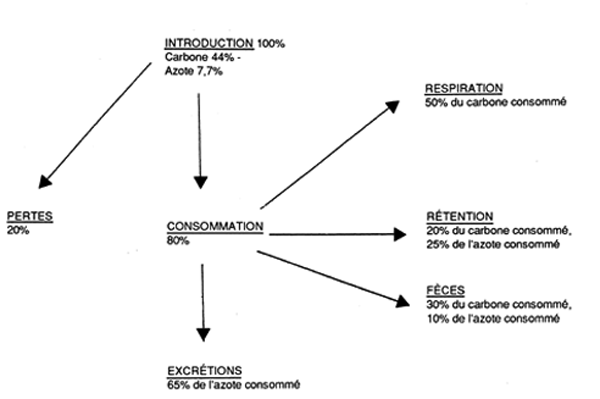
Figure 6 - Estimation du flux moyen de carbone et d'azote dans un élevage de salmonidés (Gowen et Bradbury, 1987).
53. Un grand nombre de produits chimiques sont utilisés en pisciculture: produits thérapeutiques et biocides, vaccins, hormones, vitamines, pigments pour la chair, anesthésiques, désinfectants, composés servant au traitement de l'eau ainsi que produits chimiques présents dans les matériaux utilisés pour la construction d'unités aquacoles. L'utilisation de ces produits chimiques varie grandement en fonction des espèces élevées, de l'intensité de l'élevage et de l'emplacement. Le tableau 11 montre la diversité des méthodes et des objectifs de l'utilisation de ces produits. La quantité utilisée et les modes d'application déterminent l'ampleur des effets sur le milieu.
54. En ce qui concerne les antibiotiques (Grave et al., 1990), qui sont habituellement administré dans les aliments, il semble que seulement 20 à 30 pour cent sont réellement ingérés par le poisson, et que 70 à 80 pour cent se perdent donc dans le milieu (Samuelsen, 1989), particulièrement à cause des aliments médicamenteux non mangés. L'oxytétracycline, par exemple, peut se déposer dans les sédiments, où elle peut rester à une concentration telle qu'elle peut causer des effets antibactériens durant 1 2 semaines après la fin du traitement (Jacobsen et Berglind, 1988). Les antibiotiques peuvent atteindre aussi bien la faune benthique présente que les poissons sauvages qui se nourrissent au moyen des déchets en provenance de la ferme. Des souches de bactéries aérobiques ou anaérobiques facultatives résistantes aux antibiotiques peuvent se développer, ce qui peut affecter le taux et les modes de minéralisation et de décomposition bactérienne dans les sédiments (Holmer, 1991; Bjorklund et al., 1990).
55. L'utilisation de composés organophosphorés comme le “trichlorfon” métrifonate (Neguvon) et le “dichlorvos = DDVP” (Nuvan) pour le traitement des poux de saumon a suscité des inquiétudes à cause de la toxicité possible de ces produits pour d'autres organismes comme les homards, les crabes et les moules (Egidius et Moster, 1987) et pour les larves de harengs et de homards (McHenery et al., 1991). Toutefois, afin de prévoir les effets toxiques, il serait nécessaire de posséder plus de données sur les apports, le comportement chimique, la dégradation, la persistance et la distribution du produit toxique.
56. Les produits antifouling, comme l'étain tributyl (TBT), qui ont été autrefois très largement utilisé pour traiter les installations submergées et les filets des cages et enclos, le sont beaucoup moins actuellement en raison des risques d'accumulation de composés à base d'étain d'organotin et de cuivre dans la chair des poissons d'élevage (Beveridge et al., 1991).
57. L'introduction et le transfert de poissons marins peuvent avoir des conséquences très étendues et irréversibles. Ainsi, l'introduction d'espèces de saumon du Pacifique (Oncorhynchus kisutch, O. gorbuscha et O. keta) dans l'Atlantique a suscité des préoccupations concernant, d'une part, la concurrence possible avec le saumon de l'Atlantique (Salmo salar) dans les cours d'eau de ponte et dans les zones de nurserie, et d'autre part l'importation de maladies telles que la nécrose hématopoïétique infectieuse (NHI) causée par un virus et la maladie rénale bactérienne (MRB) causée par Renibacterium salmoninarum (Sindermann, 1986). En 1987, le saumon atlantique était infesté dans une trentaine de rivières norvégiennes, par Gyrodactylus salaris, trematode ectoparasite arrivé en Norvège en provenance de la Suède à la suite de l'importation de “smolts” pendant les années 70 (Folke et Kautsky, 1989). L'introduction du “Tilapia mozambica” (Oreochromis mossambicus) est considérée comme un “véritable cauchemar” (Juliano et al., 1989) pour l'élevage en eaux saumâtres aux Philippines car cette espèce entre en compétition pour l'alimentation avec la sériole.
| Espèces et systèmes | Effets | Références |
|---|---|---|
| Saumons coho en cages, Puget Sound | Grande abondance et faible diversité directement en dessous des cages, espèce dominante: Capitella capitata | Pease (1977) |
| Yellowtail, baie de Uchiura, Japon | Accroissement des polychètes opportunistes et diminution relative des mollusques et crustacés avec augmentation de l'introduction de matière organique | Kitamori (1977) |
| Saumons de l'Atlantique en cage, Irlande | Azoïque sous les cages espèce dominante: Capitella capitata | Stewart (1984) |
| Saumons de l'Atlantique en cage, Norvège | Trois fermes étudiées: 1 . Faible diversité et communauté dominée par des espèces opportunistes. 2. Biostimulation en dessous des cages 3. Effet “minimal” sous les cages. | Ervik et al. (1985) |
| Saumons de l'Atlantique en cage, Ecosse | Zone azoïque sous les cages de certaines fermes | Earll et al. (1984) |
| Saumons de l'Atlantique en cage, Shetland | Zone azoïque sous les cages de certaines fermes. Zones situées en dessous et autour des cages dominées par Capitella capitata. Effets limités à 40 m des cages. | Dixon (1986) |
| Saumons de l'Atlantique en cage, Ecosse | Zone azoïque sous les cages, tout autour, C. capitata et Scolelepis fuliginosa jusqu'à 8 m du site. [Zone enrichie jusqu'à 25 m et “propre” à partir de > 25m] | Brown et al. (1987) |
58. Dans une étude générale, Baltz (1991) estime que plus de 120 espèces marines ou euryhalines ont été introduites avec succès dans le monde. La plupart des introductions n'ont pas abouti à former des populations, n'ont pas atteint leurs objectifs dans le cas d'importation délibérée, ou ont souvent eu des effets délétères si les espèces s'établissaient. La diversité biologique des écosystèmes côtiers peut être menacée en raison de l'extinction des espèces indigènes et du bouleversement des structures et fonctions des communautés naturelles. L'ampleur des interactions génétiques entre espèces élevées et espèces sauvages dépendra principalement des possibilités de reproduction entre les souches, les races et les espèces (par exemple, importance des fuites, barrières écologiques ou comportementales à la reproduction) et de la taille relative de la population reproductive des poissons “fugitifs” par rapport à la population reproductive sauvage.
| PRODUITS CHIMIQUES | UTILISATION | FW/SW | METHODES | REMARQUES |
|---|---|---|---|---|
| PRODUITS | ||||
| THERAPEUTIQUES | ||||
| Acide acétique | ectoparasites | FW | D | Utiliser avec CuSO4 en eaux dures |
| Formol | ectoparasites | FW/SW | D A | 165–250 ppm pendant 1 h, 20 ppm |
| pendant 4 h, utiliser en cages comme | ||||
| bain, commun | ||||
| Vert malachite | ectoparasites et | FW/SW | D F S | Oeufs et poissons, 100 ppm 30 s.; |
| champignons | B | 4 ppm 1 h commun en eau douce, | ||
| utilisé occasionnellement en cages | ||||
| comme colorant | ||||
| Acriflavine | ectoparasites, | FW | D | Surtout pour les bactéries de surface, |
| champignons et | les poissons et oeufs, utilisé | |||
| bactéries | seulement occasionnellement | |||
| Nuvan (dichlorovos) | poux des | SW | B | 1ppm pendant 1 h, dans une toile |
| saumons | autour des cages | |||
| Sel | ectoparasites | FW | D B | Occasionnellement pour remplacer le |
| formol | ||||
| Iode (iodophore) | bactéricide | FW | B | Utilisé pour désinfecter les oeufs |
| 10 min. 1 000 ppm | ||||
| Oxytétracycline | bactéricide | FW/SW | T | Antibiotique largement utilisé pour les |
| maladies en général | ||||
| Acide oxolinique | bactéricide | FW/SW | T | Antibiotique largement utilisé pour les |
| maladies en général | ||||
| Romet 30 | bactéricide | FW/SW | T | Antibiotique pour maladies en général |
| (Sulfadimétoxine- | ||||
| orthoméprime) | ||||
| Tribissen | bactéricide | FW/SW | T | 3e antibiotique par ordre d'utilisation |
| (sulfaméthoxazole/trimé- | ||||
| thoprime) | ||||
| Hayamine 3500 | agent actif en | FW | A | Ammoniums quaternaires pour le |
| superficie, | traitement des maladies bactériennes | |||
| bactéricide | des branchies | |||
| Benzalkonium | bactéricide | FW | A | Antibactérien de surface; “Roccel” |
| (similaire à ci-dessus) | ||||
| Chloramine T | bactéricide | FW | A | Comme ci-dessus, efficace également |
| sur certains protozoaires | ||||
| VACCINS | ||||
| SW | B | Peu utilisé | ||
| Vaccin pour Vibrio Anguillarum | ||||
| Vaccin pour bouche rouge | FW | B S I | Largement utilisé dans l'élevage de la | |
| truite | ||||
| Vaccin pour Aeromonas Salmonicida et | SW | I | Peu utilisé | |
| Vibrio Anguillarum | ||||
| ANESTHESIQUES | ||||
| MS222 (tricaine méthano—sulfonate) | FW/SW | B | Largement utilisé, dilution approx. | |
| 1:10 000 | ||||
| Benzocane | FW/SW | B | Largement utilisé, acétone nécessaire | |
| pour dissolution | ||||
| Anhydride carbonique | FW/SW | B | Parfois utilisé durant la récolte | |
| DESINFECTANTS | ||||
| Hypochlorite de calcium | FW/SW | S | Désinfectant général pour bassins, | |
| etc. | ||||
| Iodophore liquide p. ex. FAM 30 | FW/SW | S | Pour équipement et bains de pieds | |
| Hydroxyde de sodium | FW | S | Très largement utilisé pour les bassins | |
| en terre | ||||
| TRAITEMENT DE L'EAU | ||||
| Chaux | FW | A | Utilisé pour les bassins en terre | |
| Permanganate de potassium | FW/SW | B A | Oxydant et désintoxiquant | |
| Sulphate de cuivre | FW/SW | A | Algicide et herbicide | |
59. Aux abords des installations d'élevage l'abondance, la biomasse et la diversité des poissons et autres espèces s'accroissent car un site d'élevage offre des disponibilités plus élevées d'aliments (aliments non mangés, populations macrobenthiques denses) pour les populations de poissons sauvages.
60. L'élevage de poissons carnivores se base sur une alimentation à base de farine de poisson, et on a estimé que 5,3 t de poissons sont nécessaires pour produire 1 t de saumon élevé en cage (Folke et Kautsky, 1989; Folke, 1988). L'augmentation de la demande de farine de poisson pour la production d'aliments peut dans certains cas avoir une incidence indirecte sur les populations naturelles de poissons.
Rétroeffets négatifs
61. Il faut bien constater que c'est souvent l'aquaculture elle-même qui pâti des changements écologiques qu'elle provoque. Par exemple, les courants peuvent être réduits fortement par les installations d'élevage (cages, enclos, radeaux, etc.), d'où un accroissement du dépôt et de l'accumulation des déchets organiques en dessous ou autour des unités d'élevage, une augmentation de la sédimentation et une baisse de la qualité de l'eau (par exemple, accroissement de la turbidité due à un contenu élevé en particules en suspension). De plus, l'apport d'oxygène peut être réduit et les sédiments du fond peuvent dégager de l'hydrogène sulfuré et du méthane, ce qui entravera encore la croissance et augmentera la sensibilité aux maladies des animaux d'élevage (Lumb, 1989).
62. L'élevage en étangs, où le renouvellement de l'eau est assuré par les marées ou le pompage, peut également se trouver confronté à la détérioration de plus en plus rapide de la qualité de l'eau. Par exemple, en Indonésie, les besoins en eau d'un élevage intensif de crevettes dépassent souvent le volume des marées dans la baie qui sert de canal d'entrée et de drainage. Ainsi, au lieu de remplacer l'eau usée par de l'eau propre, ces élevages recyclent souvent l'eau sale (Chamberlain, 1991). Les systèmes d'élevage extensifs qui se basent sur la productivité naturelle des eaux peuvent réduire ou dévier le flux d'eau sous l'effet des installations ou d'une sédimentation importante, réduisant ainsi les disponibilités d'aliments et d'éléments nutritifs.
63. Les produits chimiques constituent également un risque potentiel pour les organismes en élevage (Ackefors et al., 1990) et peuvent contaminer les produits aquacoles, ce qui en réduit la qualité et compromet l'acceptation par les consommateurs. L'apparition d'organismes pathogènes résistants et résidants (et peut-être dormants) au voisinage ou à l'intérieur de l'élevage peut avoir de sérieux effets négatifs sur la productivité. L'utilisation excessive de produits chimiques en écloserie peut compromettre la santé et la croissance et abaisser le taux de survie durant la phase de grossissement. La qualité des sols des étangs peut diminuer à cause des traitements chimiques excessifs.
64. Les poissons ou oiseaux prédateurs sont attirés par les populations de poissons élevés et sauvages et par l'abondance des aliments pour poissons. Ces prédateurs peuvent donc non seulement blesser et manger les poissons mais aussi augmenter l'incidence des maladies en servant d'hôtes intermédiaires aux parasites. Les prédateurs ainsi que les organismes qui se nourrissent sur les installations de la ferme peuvent également endommager les filets ou autres matériaux utilisés pour servir d'enclos et permettre ainsi la fuite des animaux en élevage.
65. L'ampleur des effets de retour négatifs sur l'environnement de l'aquaculture côtière peut augmenter en raison de son expansion et/ou de son intensification. L'accroissement de la superficie et/ou du nombre d'unités d'élevages (étangs, radeaux, cages, etc.) et de fermes peut entraîner une dégradation de l'environnement dans la zone d'élevage et à l'extérieur.
66. L'expansion des élevages basés sur une alimentation naturelle peut provoquer l'épuisement de la productivité naturelle des eaux des zones côtières. L'énorme surface couverte et la dégradation des zones de balancement des marées; notamment des mangroves, peuvent également affecter la production d'alevins, post larves et naissain. De toute évidence, le groupement des fermes a un effet cumulatif sur les déchets et sur les besoins en oxygène. Les effets de retour négatifs de l'envasement, de la turbidité, de l'accumulation des sédiments riches en matières organiques, des fonds d'eau désoxygénés ou anoxiques, du dégagement de gaz toxiques, de la diffusion des maladies, etc., peuvent donc affecter toutes les fermes de la région, particulièrement si elles sont situées dans des baies abritées ou peu profondes à faible renouvellement d'eau. Les élevages situés à terre ont dû faire face aux mêmes problèmes; par exemple dans le cas de l'élevage intensif de la crevette à Taiwan et en Thaïlande où les fermes ont eu tendance à se regrouper sur les sites favorables, de sérieux problèmes d'autopollution se sont posés (Csavas, sous presse). Selon Csavas, “l'eau de drainage d'une ferme est souvent réutilisée par ses voisines, de sorte que le changement d'eau dans les bassins fortement peuplés, ne sert plus à rien”.
3.3 Dégradation de l'environnment côtier et effets potentiels sur l'aquaculture cotière
67. La zone côtière, en tant qu'entité économique, accueille de nombreuses activités comme l'agriculture (riz, cocotier, bananes), la foresterie (mangroves, palmier nypa), les pêches et l'aquaculture, les établissements humains, les industries manufacturières et extractives (sable, pétrole, minéraux), l'évacuation des déchets, les ports et transports maritimes, les infrastructures de transport, les projets de maîtrise et d'approvisionnement en eau, les travaux de protection des côtes, le tourisme et les loisirs. L'utilisation des ressources des zones côtières à de multiples fins peut provoquer un grand nombre de changements dans l'environnement ou les conditions socio-économiques, qui peuvent à leur tour avoir une incidence sur la société dans son ensemble. L'annexe 2 donne un aperçu des problèmes que peut poser l'utilisation multiple des ressources côtières. La figure 7 présente diverses sources de pollution des zones côtières. Les lecteurs s'intéressant à la pollution des zones côtières et des mers sont invités à se reporter aux ouvrages suivants: Phillips et Tanabe (1989); Gomez et al. (1990); Sen Gupta et al. (1990); GESAMP(1990b);PNUE(1990b); GESAMP (1990a); GESAMP (1 987); GESAMP (1980); Maclean (1989).
68. II est important de noter que, dans de nombreuses zones côtières, la pollution et la modification des habitats dues à des activités humaines autres que l'aquaculture, affectent de plus en plus la productivité de l'aquaculture et limitent les résultats et les possibilités de développement de ce secteur (Stickney, 1990; Chua et Tech, 1990; Menasveta, 1987).
69. Quelques exemples de pollution dangereuse pour l'aquaculture côtière (Chua et al. 1989) sont présentés ci-après. Un contenu élevé en matières organiques et en microbes dans les effluents d'égouts de zones urbaines ou de villégiature à population dense peuvent contaminer les mollusques et crustacés d'élevage, les rendant impropres à la consommation humaine, particulièrement s'ils sont consommés crus ou peu cuits. Par exemple, dans la baie de Manille, qui est un des centres d'élevage des moules et des huîtres les plus importants des Philippines on a dénombré plus de 1 000 coliformes par 100 ml. En 1979, une épidémie de gastro-entérite s'est produite à Singapour à la suite de l'importation de chair d'huîtres des Philippines. Après à cet incident, la demande de fruits de mer provenant des Philippines a diminué. Une pollution organique grave due aux effluents de porcheries malaises et de raffineries de sucre thaïlandaises, caractérisée par une forte demande d'oxygène biochimique, a durement frappé les élevages de clovisses et d'autres organismes. En Thaïlande des élevages de crevettes et d'huîtres ont été gravement affectés par les déchets liquides d'une distillerie.
70. Les métaux lourds présents dans les effluents industriels peuvent se retrouver dans le corps des animaux d'élevage. Dans la baie de Jakarta (Indonésie), l'analyse d'échantillons de poissons, de mollusques et de crustacés a montré que les niveaux fixés par l'OMS étaient dépassés de 76 pour cent pour le cadmium, 51 pour cent pour le cuivre, 44 pour cent pour le plomb, 38 pour cent pour le mercure et 2 pour cent pour le chrome. Le déversement de pétrole peut provoquer une mortalité élevée des poissons et a des effets évidents sur l'aquaculture, dont la contamination des installations d'élevage et l'infection des organismes élevés.
71. Les niveaux élevés de pesticides en provenance de l'agriculture peuvent détruire les organismes en élevage, mais des doses plus faibles peuvent avoir des effets sublétaux comme des changements pathologiques dans différents organes.
72. Le rejet d'éléments nutritifs organiques et inorganiques dans l'écosystème marin peut causer une hyperalimentation, ou des proliférations (blooms) d'algues. Les poissons d'élevage peuvent être tués par des proliférations d'algues par une brusque dégradation de la qualité de l'eau (asphyxie par endommagement des branchies et/ou par épuisement de l'oxygène) après l'écroulement et la décomposition de la population d'algues. En particulier, les cultures de bivalves doivent faire face à de sérieux problèmes en raison des “blooms” toxiques toujours plus fréquent; ceux-ci sont dûs à un nombre limité d'espèces produisant des toxines, qui peuvent provoquer la mort du stock en élevage ainsi que des maladies chez les êtres humains et même leur mort après la consommation de bivalves contaminés (Shumway, 1990, 1989).
3.4 Incidences sociales du développement de l'aquaculture côtière
73. L'impact de l'environnement sur l'aquaculture côtière et de celle-ci sur l'environnement peut avoir de sérieuses répercussions négatives dans les domaines socio- économique et sanitaire (Huss, 1991; Bernoth, 1991a).
74. On craint que la conversion de nombreuses mangroves à l'élevage des crevettes et des poissons en Amérique latine et en Asie ait affecté les communautés rurales qui vivaient traditionnellement des ressources des mangroves (Chua, sous presse; Mena Millar, 1989; Nath Roy, 1984). Selon Bailey (1988), “l'expansion de l'élevage de la crevette dans les mangroves provoque généralement le passage des ressources côtières de la multi- utilisation (multi-utilisateurs) à l'utilisation à une seule fin en propriété privée. De plus, le coût de cette destruction de l'écosystème côtier pour la société peut inclure également l'érosion des côtes, l'intrusion de l'eau salée dans les nappes phréatiques et dans les champs cultivables, et la diminution des disponibilités de multiples biens et services de valeur tirés des mangroves ou d'autres zones côtières marécageuses”.
75. De plus, selon Smith et Pestano-Smith (1985), les grandes entreprises aquacoles évincent fréquemment les petits pêcheurs et aquaculteurs. Malheureusement, la concurrence dont font l'objet les ressources en terre et en eau entraîne aussi des conflits d'utilisation (Shang, 1990; Stansell, 1992), qui peuvent dégénérer en violence comme cela s'est produit en Thaïlande entre les cultivateurs de riz et les éleveurs de crevettes (New, 1991).
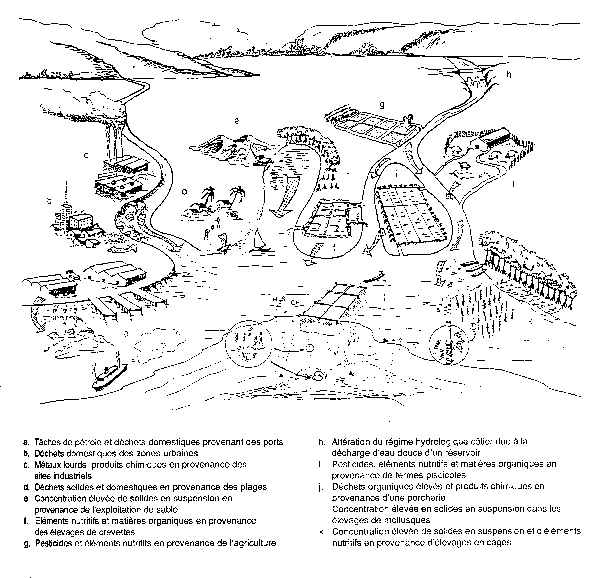
Figure 7 - Diverses sources de pollution des zones côtiéres (Chua et al., 1989).
76. Divers désastres économiques dus à des pertes significatives de production aquacole ont été attribués à l'autopollution ainsi qu'à la pollution croissante des eaux côtières qui déclenche l'apparition de maladies et de “blooms” de phytoplancton dangereux (Rosenberry, 1990; Chua, sous presse; New, 1990a; Okaichi, 1991; Maclean, 1991).
77. La consommation de mollusques et crustacés crus ou peu cuits en provenance de zones qui reçoivent des effluents urbains chargés en matières organiques et en microbes peut avoir de graves conséquences pour la santé humaine, notamment les troubles gastro- intestinaux, la gastroentérite, l'hépatite infectieuse, le choléra et le typhus (Shuval, 1986). La présence de métaux lourds, provenant principalement des décharges industrielles, peut provoquer la contamination des fruits de mer et l'empoisonnement des personnes comme dans la baie de Minamata au Japon, où les effluents industriels contenaient des méthyl-mercures (Piotrowskii et Inskip,1981; Huss, 1988). Différentes formes d'empoisonnement humain se produisent dans le monde après la consommation de fruits de mer qui ont accumulé des phytotoxines à la suite de “blooms” d'algues toxiques, par exemple PSP (paralytic shellfish poisoning = empoisonnement par crustacés et mollusques provoquant la paralysie), NSP (neurotoxic shellfish poisoning = empoisonnement neurotoxique par crustacés et mollusques), DSP (diarrhoeic shellfish poisoning = empoisonnement par crustacés et mollusques provoquant diarrhées), ASP (amnesic shellfish poisoning = empoisonnement par crustacés et mollusques provoquant l'amnésie). Les empoisonnements entraînent des troubles gastro-intestinaux, la paralysie de la respiration, des pertes de mémoire et la mort (OMS, 1984).
78. En résumé, les implications potentiellement négatives de la dégradation écologique qui affectent directement ou indirectement la situation socio-économique dans l'environnement de l'aquaculture côtière sont les suivantes:
- déclin de la qualité et du volume des poissons comestibles élevés et pêchés,
- accroissement des risques pour la santé humaine et diminution de la valeur nutritionnelle,
- baisse de la confiance du consommateur et difficultés accrues de commercialisation du poisson aux niveaux local, national et international,
- augmentation des conflits entre utilisateurs des ressources et concurrence croissante pour obtenir des marchés et du crédit,
- déclin et échec des entreprises aquacoles et/ou d'autres activités de pêche (par exemple pêche artisanale), y compris le secteur après-récolte,
- désorganisation de la société rurale à la suite:
- de la disparition des activités traditionnelles d'agriculture, de foresterie et de pêche à base communautaire;
- de la diminution des possibilités d'emploi; évolution en faveur d'une main- d'oeuvre non spécialisée et saisonnière;
- marginalisation des habitants locaux, qu'ils soient ou non utilisateurs des ressources, due aux changements de répartition des revenus;
- migration vers les centres urbains.