B.J. HILL
QUE SONT LES VIRUS ?
Les virus sont des unités infectieuses (particules) non-vivantes, constituées d'un génome, soit d'ADN (Acide Désoxyribonucléique), soit d'ARN (Acide Ribonucléique) entouré d'une capsule protectrice. Contrairement aux bactéries et autres cellules vivantes, ils ne contiennent pas d'organites cellulaires, de ribosomes fonctionnels ou de systèmes enzymatiques producteurs d'énergie. Ils ne peuvent grandir en taille, mais leur génome (ADN et ARN) contient l'information nécessaire à leur réplication au sein d'une cellule-hôte vivante sensible. Les cellules-hôtes fournissent certains des enzymes essentiels à la réplication du virus et sont généralement, mais pas toujours, tuées au cours du processus de réplication et de libération du virus. Une seule particule virale infectant une cellule-hôte peut se répliquer pour produire et libérer des milliers de particules virales.
Les virus animaux se classent selon leur taille, de c.18 nm à c.450 nm, mais certains produisent aussi des formes filamenteuses atteignant plusieurs μm de long (mais seulement 10–20 nm de diamètre). Seules les particules virales aux diamètres les plus grands (“pox virus” et quelques iridovirus) peuvent s'observer directement au microscope optique après coloration. La grande majorité ne peut être observée de cette manière et exige la puissance de grossissement et de résolution du microscope électronique. On peut les examiner, soit dans des coupes fines de tissus infectés, soit comme particules séparées sous forme purifiée ou semi-purifiée après extraction des tissus.
La classification des virus est basée sur un certain nombre de propriétés physiques et biochimiques, mais au niveau des “familles”, il s'agit principalement :
de
ADN ou ARN comme génome,
Génome à chaîne d'acide nucléique double ou simple
Morphologie des particules virales
Taille moyenne des particules virales,
Présence ou absence de lipide dans la capsule protéique
Pour avoir tous les détails sur la classification et la nomenclature des virus, voir MATTHEWS (1982).
Les virus apparaissent chez la majorité des formes vivantes : vertébrés, invertébrés, plantes et aussi organismes unicellulaires comme les algues, les champignons, les bactéries, etc…
VIRUS DES POISSONS
Plus de 70 virus et supposés virus ont été isolés et/ou observés en microscopie électronique, à partir de poissons ou de coquillages. La majorité des plus ou moins 50 virus trouvés chez les poissons apparaissent chez des espèces d'eau douce. Ceux pour lesquels l'information est la plus abondante causent des maladies dans les conditions d'aquaculture et sont peu connus chez les populations sauvages. L'importance de cette information reflète le grand intérêt réservé à ce domaine en raison de son importance économique. Bizarrement, les virus détectés chez les poissons d'espèces marines l'ont été généralement chez des individus sauvages plutôt que chez des poissons en conditions d'aquaculture. De toute façon, le développement croissant de l'élevage de poissons marins et avec lui, l'intérêt accordé aux problèmes des maladies, vont sans aucun doute, provoquer un retournement de la situation.
Discuter de toutes les infections virales connues chez les poissons n'entre pas dans le cadre de cet exposé, nous n'aborderons que les infections apparaissant en conditions marines et citerons plus particulièrement les exemples de maladies virales des poissons retenus en captivité. Nous recommandons plusieurs publications récentes reprenant la plupart de l'information concernant les virus de poissons d'eau douce et d'eau salée (HILL, 1981, 1982; WOLF, 1984; HETRICK, 1984 ; AHNE, 1985 ; MOLLER & ANDERS, 1986 ; ROBERTS & SCHLOTFELDT, 1985 ; DE KINKELIN, MICHEL & GHITTINO, 1985).
Une liste résumée de la plupart des maladies virales, connues et soupçonnées chez les poissons marins, ainsi que chez les espèces anadromes et catadromes, est donnée dans le Tableau I. Pour le moment, nous attirons votre attention sur les types de virus et les exemples spécifiques de maladies en situation d'aquaculture marine.
a) Virus de l'herpes
i) Maladie de l'herpes viral chez le turbot
Cette maladie fut observée chez de jeunes turbots, dans une ferme de poissons en Ecosse (BUCHANAN, RICHARDS & MADELEY, 1978). La population de poissons affectée commença à montrer des mortalités croissantes après avoir été transférée è l'âge de 4–5 mois, de l'écloserie aux eaux réchauffées du site de grossissement, qui utilise les effluents chauds d'une station génératrice d'électricité. Les poissons malades étaient léthargiques, n'avaient pas d'appêtit et montraient peu de résistance à la capture. Souvent, les poissons se couchaient dans une position caractéristique, la tête et la queue dressés, lorsqu'ils s'étendaient sur le fond du bac. Il n'y avait ni lésions branchiales ou épithéliales apparentes, ni anomalies pigmentaires.
Le taux de mortalité a fluctué considérablement sur une période de six mois. Les décès ont eu lieu dans les 5 jours qui ont suivi le transfert des poissons et ont augmenté aux époques de fluctuations de températures ou de hautes teneurs en chlore dans les effluents en provenance de la station électrique. Le total des pertes a atteint 30 %, mais elles n'ont pas été entièrement attribuées à l'infection par le virus de l'herpès.
Une description détaillée de l'histopathologiede ces conditions fut donnée a été donnée par RICHARDS et BUCHANAN (1978). La peau montrait un épiderme contenant de nombreuses sellules géantes. Dans les branchies, il y avait des hyperplasies lamellaires secondaires et des cellules géantes qui paraîssaient provoquer une légère réponse de l'hôte. L'examen des cellules infectées, au microscope électronique a révélé des particules virales herpétiques à l'intérieur du noyau et des particules liées à la membrane dans le cytoplasme. Des échantillons des tissus cellulaires infectés, après examen au microscope électronique, ont montré des particules virales à morphologie typique de l'Herpesvirus.
Cette maladie n'a été observée que peu de fois, depuis sa première détection, dans cette même ferme piscicole et elle a été observée aussi chez des turbots juvéniles sauvages, mais à un faible taux. IL n'a pas été mis en évidence qu'elle est la cause directe des mortalités en situations aquacoles, mais nous sommes portés à croire qu'elle affaiblit le poisson et le rend vulnérable aux conditions défavorables ou aux autres maladies. Cette situation n'a été signalée nulle part ailleurs.
ii) Dermatite virale de l'Emissole
Une maladie cutanée a été observée sur des groupes d'émissoles (Mustelus canis) en milieu sauvage, en laboratoire et en aquarium, dans l'état du Massachusetts, U.S.A. (LEIBOVITZ & LEIBOVITZ, 1985). La maladie est caractérisée par le développement progressif de zones de lésions cutanées ovales, légèrement surélévées, blanc-grisâtres, d'un diamètre allant de 1 Mm à 1 cm. La microscopie électronique de sections fines de matériel de lésions, révèle la présence de morphologie et de morphogénèse typiques de l'herpesvirus. La portée de la maladie sur la survie des poissons en captivité ou des poissons sauvages n'est pas encore connue.
b) Iridovirus
i) “Maladie lymphokystique”
Cette maladie apparaît chez un grand nombre d'espèces de poissons (plus de 100) en eaux douce, saumâtre et marine. La maladie est identifiable par le développement de petits nodules sur la peau du poisson, en nodules individuels ou en forme de grappes de raisin. Chaque nodule est une seule cellule-hôte infectée qui a été fortement gonflée par l'infection du virus jusqu'à ce qu'elle atteigne un diamètre de 1 mm ou plus, et soit visible à l'oeil nu.
Des sections hystologiques à travers les cellules infectées révèlent des inclusions qui, au microscope électronique, ressemblent à des particules virales de la morphologie de l'Iridovirus.
Bien que cette maladie apparaîsse largement dans les stocks naturels de poissons, les cas enregistrés, chez les poissons marins d'élevage sont très limités. Le rapport le plus détaillé d'un cas, en aquaculture, vient d'Israel, où PAPERNA et coll. (1982) rapportent un début de maladie chez la daurade (Sparus aurata), en élevage, dans le golfe d'Aqaba. Des cellules lymphocystiques ont été également détectées sur des poissons âgés de 8 mois, élevés dans des cages en mer, à une profondeur de 5 – 6 m. L'apparition était faible et l'infection très légère. Cependant, quand les poissons ont été transférés dans des bacs situés en bord de mer, l'infection s'est étendue à tous les poissons, en une semaine, et de nombreux individus ont été sévèrement infectés, en particulier aux endroits où la peau portait des égratignures ou des éraflures. La maladie a régressé après deux semaines et les poissons paraissaient avoir complètement récupéré après 1 mois. Aucune mortalité significative ne fut enregistrée. Généralement, on admet que la “lymphocystis” est une maladie qui apparaît le plus souvent sous sa forme bénigne, avec peu ou pas de léthalité. L'épanouissement soudain de la maladie dans des conditions d'aquaculture était presque certainement dû aux éraflures des poissons, lors du transfert, des cages en mer vers les bacs à terre, ajoutées au stress de la manipulation, etc …
Il n'y a eu que deux autres rapports sur le“lymphocystis” apparaissant chez des poissons d'élevage, l'un, au Japon, concernant le flétan, ou “Hirami” (Paralichthys olivaceus) et l'autre, aux USA sur le flétan et le cardeau, en bassins d'élevage (Paralichthys lethostigma et P. dentatus). Bien que les signes de maladie aient persisté plusieurs semaines il n'était pas évident que la maladie fut la cause des mortalités et, parfois, le nombre de poissons apparemment malades, est allé en diminuant. Il paraît y avoir, avec le virus de la "lymphocystis, une forte spécificité de l'hôte impliqué. La maladie peut se transmettre passablement bien parmi les membres d'une même espèce, mais la transmission entre poissons de différentes familles et difficile et habituellement impossible. On suppose que la transmission du virus se fait par l'introduction dans l'eau de cellules épithéliales infectées, issues de poissons infectés et que l'infection d'un nouvel hôte se fait probablement au travers des éraflures ou des dommages de la peau et/ou des nageoires. Cependant, l'infection peut aussi apparaître chez un poisson se nourrissant de poissons infectés et dans ces circonstances, l'infection apparaît au niveau des organes internes. Il existe certaines explications concernant la variation saisonnière de la “lymphocystis” chez les populations de poissons sauvages, mais il reste beaucoup à comprendre à propos des facteurs provoquant le démarrage de cette maladie, aux effets normalement modérés mais très contagieuse.
ii) Nécrose érythrocytaire virale
Il s'agit d'une infection par Iridovirus, des érythrocytes. Elle est caractérisée par une nécrose nucléaire et des inclusions dans le cytoplasme des cellules infectées. De nombreuses espèces différentes de poissons marins furent découvertes porteuses de cette infection avec des taux de prédominance chez les poissons sauvages montant s'élevant jusqu'à 60 %. Des taux de prédominance plus élevés ont été observés chez le saumon du Pacifique élevé en cage (jusqu'à 80 %), probablement dû à la densité et au stress. Les circonstances suggèrent que le stress, comme la ponte, augmente l'apparition et l'intensité de l'infection chez les poissons sauvages. il y a aussi certains arguments démontrant que la fréquence diminue quand le poisson vieillit, c'est à dire que les poissons les plus jeunes paraîssent avoir le taux le plus élevé.
L'effet pathologique varie selon l'intensité de l'infection. Dans le cas d'une infection légère, la plupart des érythrocytes infectés sont matures, mais quand l'infection est importante, les érythrocytes immatures sont aussi atteints. Les valeurs moyennes d'hématocrite déclinent rapidement dans les infections importantes, passant de 40 % à 10 %, après une période de 4 semaines; il en résulte une anémie sévère.
D'autres effets physiologiques observés chez le juvénile le plus vulnérable des espèces de Saumon du Pacifique comprennent une plus haute sensibilité à la Vibriose, une capacité décroissante à réguler le sodium et le potassium du sérum en eau de mer, et une tolérance décroissante significative au manque d'oxygène. Cependant, on sait encore peu de choses sur l'effet du “VEN” (Virus Erythrocytic Necrosis) chez les espèces marines sauvages ou d'élevage, au niveau de la population.
c) Birnavirus
Les Birnavirus sont tous étroitements reliés aux souches originales isolées à partir de la truite et connues sous le nom de virus de la nécrose pancréatique infectieuse (IPNV, en anglais) à cause de la nature de la maladie qu'ils produisent chez les truites élevées en écloserie. Cependant, dans la vaste majorité des cas, il est probablement incorrect de se référer au Birnavirus en temps qu'IPVN, sans la preuve qu'il puisse effectivement cette maladie chez la truite ou chez toute autre espèce. La grande majorité des souches isolées de Birnavirus viennent de poissons d'espèces dulcicoles, avec une prédominance de salmonidés chez lesquels la maladue est apparue en conditions d'écloserie. Cependant, le virus fut isolé à partir de nombreuses espèces de poissons marins et d'eau douce, non-salmonidés, comme nous le montre le tableau ll, ainsi que de plusieurs espèces marines de mollusques et de crustacés.
Malgrè plusieurs détections de Birnavirus chez des poissons marins, peu documents démontrent, jusqu'à présent, cause un état pathologique, sans parler d'un état morbide. Un seul cas a donné des preuves convaincantes et c'est chez l'alevin de Sériole (Seriola quiqueradiata), au Japon.
1) Alevin de Sériole
En 1983, un grand nombre de décès survint parmi les alevins de Sériole en écloserie, dans la mer intérieure de Séto, au Japon (SORIMACHI & HARA, 1985). De nombreux poissons montrèrent des signes marqués d'axites. Un virus fut isolé d'extraits de poissons mourants, inoculé dans des cultures de cellules de salmonidés et sembla être un Birnavirus lié sérologiquement au groupe des IPNV. Lors d'infections expérimentales en laboratoire, des alevins de Sériole développèrent, après 3 jours, des abdomens gonflés, en se nourissant peu, et 24 heures plus tard, il y eut une soudaine apparition de poissons porteurs d'axites marquées et les mortalités commencèrent. Huit jours après, les mortalités cumulées avaient atteint 62 %. Durant les premiers stades, les poissons mourants développèrent une coloration jaune et des déjections fécales. Beaucoup de poissons morts avaient une accumulation de fluide dans l'abdomen et des hémorragies dans le foie. le virus fut réisolé à de hautes concentrations, à partir des poissons malades.
Ceci est le premier cas confirmé d'un Birnavirus causant des mortalités chez une espèce de poisson marin, en conditions d'aquaculture, mais il nous prédit que de prochains cas émergeront probablement chez d'autres espèces de poissons, dans les années à venir, causés par l'expansion de l'aquaculture marine et par une connaissance plus générale quant à l'étendue de la distribution de ce groupe de virus dans l'environnement marin.
2) Larves de loups (bars)
Un état morbide, chez des larves de loup (Dicentrarchus labrax) a été associé à une infection au Birnavirus par BONAMI et al. (1983). Des pertes de 85 à 95 % se déclaraient régulièrement, aux stades larvaires et aux stades de frai, chez des loups, pendant l'élevage en écloserie. Souvent, le signes cliniques d'état morbide sont apparus environ 20 jours après l'éclosion à 19° C, et le choc mortel a eu lieu soudainement 12 à 24 heures plus tard. Deux pics de mortalité ont été atteints : le premier à environ 25 jours post-éclosion et le second à environ 50 jours post-éclosion.
Les larves mourantes décrivent en nageant un déplacement en spirale, ont une vessie natatoire et une vésicule biliaire distendues, des déjections fécales blanches et une exophtalmie. Histologiquement, il s'opère une exfoliation de l'épithélium intestinal, une hypertrophie de la vessie natatoire et de la vésicule biliaire, mais aucune preuve de réponse inflammatoire.
Des extraits de larves malades ont été inoculés dans des cultures de tissu de poisson et un virus a été isolé ; il a été caractérisé comme appartenant au sérotype Sp de l'IPNV qui apparaît largement chez les poissons et ches les coquillages d'Europe. Des preuves concluantes montrant que le virus est la cause de la maladie et des mortalités, manquent toujours.
3) Autres espèces de poisson
Une infection au Birnavirus a été aussi associée à des mortalités chez des “Striped bass” ou Bars d'Amérique (Morone saxatilis) dans la “CHESAPEAKE Bay”, sur la côte Est des Etats Unis, mais la preuve que le virus cause des mortalités est toujours attendue.
D'autres Birnavirus ont été détectés chez la sole (Solea solea) et le turbot (Scophthalmus maximus) dans l'écloserie expérimentale de CNEXO à BREST, France, mais aucune preuve n'a été publiée pour confirmer que ces virus sont bien la cause de maladies ou de mortalités spécifiques.
Pour terminer, il existe un rapport concernant un Birnavirus comme cause possible de la “spinning disease” (maladie fileuse) chez des populations sauvages de Menhaden atlantique (Brevoortia tyrannus).. Des décès de poissons y compris de Menhaden atlantique se sont produits annuellement, depuis 25 ans, dans la CHESAPEAKE Bay, l'Anse de New York et le Détroit de Long Island Ouest. Les poissons mourants sont appelés des fileuses en raison de leur comportement nageur et un grand nombre de poissons morts sont rejetés sur la plage. Un Birnavirus a été isolé à partir de cultures de tissus et on a affirmé que le virus transmettait bien la maladie aux Menhadens nains, à la suite de l'injection de culture de tissus infectés, mais des preuves concluantes que le Birnavirus isolé est la cause première de la maladie n'ont toujours pas été publiées.
d) Rhabdovirus
Bien que les Rhabdovirus soient la causede nombreuses et sévères maladies chez des poissons d'eau douce, en milieu aquacole, ils sont relativement inconnus chez les poissons marins. Il n'existe que deux exemples de Rhabdovirus, causes de maladie en milieu aquacole marin et un seul rapport d'infection par Rhabdovirus (d'importance inconnue) chez la morue sauvage.
1) Septicémie Hémorragique Virale (VHS)
La VHS (Viral Haemorrhagic Septicaemia) est une maladie sévère chez la truite arc-en-ciel d'élevage et cause d'énormes pertes, chaque année, dans plusieurs Pays Européens. On n'en a pas trouvé chez les poissons sauvages et les seuls cas, en environnement marin ont été associés à des truites arc-en-ciel, transférées dans des cages en mer. Sans doute la truite arc-en-ciel avait-elle déjà été infectée pendant sa vie en eau douce, précédant le transfert sur le site marin. D'importantes mortalités sont apparues, en cas isolés, au large des côtes du DANEMARK et de FRANCE, mais ce problème ne s'est pas encore généralisé. Le facteur le plus inquiétant, pourtant, est que la recherche, en France, a montré que des espèces marines d'élevage, comme le turbot et le bar sont sensibles à l'infection, indiquant qu'il existe un sérieux risque de transmission de la maladie, d'unités de truites arc-en-ciel élevées en mer, aux unités d'élevage de poissons marins situées à proximité. cependant, aucun cas n'a été rapporté jusqu'à présent.
2) Maladie de Rhabdovirus du Flétan(HRV : Halibut Rhabdovirus disease)
Un début de maladie hémorragique sévère chez le Flétan batard ou Flet japonais (Paralichthys divaceus) au Japon, a récemment fait l'objet de recherches par KIMURA et al., (Communication personnelle) et la cause s'est avérée être un nouveau Rhabdovirus. Des détails publiés sur ce cas et les caractéristiques de la maladie n'ont pas encore été distribués mais devraient l'être dans un proche avenir.
Ce sont les seuls cas bien documentés de maladies virales chez des poissons élevés en milieux marin et saumâtre. Il existe plusieurs comptes-rendus d'isolation de virus à partir d'anguilles, au cours de leur passage en eau douce, mais aucune preuve n'a été publiée jusque-là, pour démontrer que ces cas sont significatifs chez les anguilles, en eau douce comme en eau de mer.
DIAGNOSTIC DES MALADIES VIRALES
Il existe principalement trois approches de détection et d'identification des infections virales chez les poissons :
Mise en évidence de particules virales dans des tissus infectés, observés au microscope électronique,
Mise en évidence d'antigènes viraux dans des tissus malades,
Isolation du virus à partir de cultures de tissus sensibles suivie de l'identification en microscopie électronique ou par tests sérologiques.
La microscopie électronique prend du temps, est coûteuse et n'est pas vraiment praticable pour des diagnostics de routine. Cependant, elle reste essentielle, dans la recherche, lorsque des maladies nouve'les sont suspectées être virales surtout si le virus présumé ne peut être isolé en cultures de tissus et, aussi, parfois, s'il peut pousser sur culture tissulaire. Elle est au virologue ce que la microscopie optique est à l'histopathologiste et au microbiologiste, utilisée soit pour observer directement les particules virales au sein du foyer de la maladie dans le tissu atteint, soit pour observer la morphologie et la taille du virus (pour en étudier le type) après extraction hors des tissus malades ou après isolement et croissance en culture tissulaire.
De nombreuses infections virales connues chez les poissons marins ont été détectées et sont encore diagnostiquées avec certitude par la seule microscopie électronique de coupes fines de tissus malades. Ceci, simplement, parce que les cultures de tissus sensibles faites pour l'isolement et la croissance des virus impliqués ne sont pas encore disponibles. Parmi les maladies décrites dans le texte, ceci concerne les maladies de l'herpesvirus chez le turbot et l'émissole, toutes sauf une des maladies lymphocystiques (chez les poissons d'eau douce) et la nécrose érythrocytaire virale. Au cours des dernières années, l'effort fut apporté dans le développement de lignées cellulaires permanentes issues de poissons marins, et en Europe des succès furent obtenus par le turbot, le loup, (bar) et la morue, (cabillaud). La poursuite de cette tendance à développer des cultures de tissus provenant d'espèces marines d'élevage est essentielle si des procédures diagnostiques similaires à celles effectuées pour les maladies virales de poissons d'eau douce doivent devenir systématiques. D'autres “nouvelles” (c'est à dire : jamais observées) infections virales seront sans aucun doute découvertes quand de telles cultures tissulaires deviendront couramment disponibles.
La démonstration de l'antigène viral spécifique dans les tissus de malades peut être faite de la même manière que la détection de l'antigène bactérien, comme décrite dans un exposé antécédent. Les méthodes sont les suivantes :
Test d'anticorps fluorescents (FAT, sur des coupes de tissu,
Test de co-agglutination (KIMURA et al., 1984)
ELISA (DIXON & HILL, 1983 et 1984)
Cependant, un approvisionnement en antisérum ou une préparation d'anticorps qui réagit spécifiquement avec le virus testé, est essentiel et une telle préparation ne peut être faite que pour les virus qui ont été isolés et déjà cultivés en cultures cellulaires (par exemple, les virus “VHS”, Birnavirus), ou quand les virus (par exemple, les virus de la“lymphocystis”) peuvent être extraits et purifiés en quantité suffisante, directement à partir du tissu malade. Des méthodes sérologiques directes comme celles-ci ne sont pas encore utilisées couramment mais le deviendront progressivement, spécialement grâce aux “kits” de diagnostics commerciaux qui seront inévitablement développés.
Finalement, la méthode de diagnostic la plus fréquemment utilisée pour les maladies virales est l'isolement de virus en culture tissulaire (c'est à dire des virus pour lesquels c'est possible) suivi de tests sérologiques qui identifient la souche isolée. Des antisérums spécifiques contre des souches de référence du virus sont utilisés pour :
Neutralisation du pouvoir infectieux (neutralisation du sérum),
“FAT” et coloration à l'immunopéroxidase de cellules de culture tissulaire infectées,
Co-agglutination,
ELISA.
Il n'est pas nécessaire de recourir à la microscopie électronique pour les virus qui peuvent être isolés et identifiés de cette manière. La procédure de base pour l'isolement de virus en culture tissulaire est décrite dans l'appendice I. Cette approche est la seule suffisamment sensible pour la détection des porteurs de virus(par exemple des poissons), qui sont chroniquement infectés par de petits nombres de virus sur une longue période sans développer de maladie, et est nécessaire pour le contrôle des infections virales dans les stocks de poissons qui est normalement inclus dans le certificat sanitaire. Pour les poissons élevés en eau douce, un tel certificat sanitaire prouvant l'absence de virus spécifiques est une affaire de routine, mais il n'a pas encore été développé pour les poissons élevés en milieu marin.
APPENDICE I
Procédures pour isoler les virus de poisson, en culture tissulaire
Examen de stocks de poissons porteurs d'une maladie clinique
Echantillonnage
Quand on examine des poissons provenant d'une épidémie (signes cliniques) il est habituellement nécessaire d'échantillonner un minimum de 10 poissons mourants montrant ces signes cliniques. Là, où plusieurs groupes d'âge sont affectés, l'échnatillonnage devrait être constitué de poissons de différents groupes.
Procédures de laboratoire
i) Tests virologiques des IPN, IHN, VHS, SVC et autres virus
1) Collecte des échantillons
Des échantillons de foie, reins, rate, et caeca pyloriques de poisson doivent être mélangés et groupés en cinq pools à tester et devraient être traités dans un délai minimum. Les échantillons devraient être testés dans les quelques heures qui suivent leur collecte, et, dans la plupart des cas, dans les 24 heures; pendant ce laps de temps, ils devront être conservés à 4° C.
2) Procédure d'extraction
Les échantillons viscéraux rassemblés doivent être écrasés avec un mortier et un pilon suffisamment stériles jusqu'à obtention d'une pâte. Un milieu de culture de tissus (MM) contenant 1000 U.I. (Unité internationale) de pénicilline, 1 000 ug/ml de streptomycine et 50 U.I./ml de mystatine doit être ajouté au ratio 1 : 1 w/v, à l'échantillon viscéral original. Les extraits viscéraux sont alors centrifugés à 1 400 g, pendant 15 min. et le surnageant est collecté.
Le surnageant doit encore être dilué à 1 : 25 dans du MM. Le matériel d'échantillonnage doit être gardé à une température aussi basse que possible, pendant toute la procédure.
3) Elimination des contaminations bactériennes et fongiques
Normalement, la pénicilline, la streptomycine et la mystatine sont incorporées dans le MM pour atteindre des concentrations respectives de 1 000 U.I./ml, 1 000 g/ml et 50 U.I./ml, dans le surnageant dilué. Cette culture doit alors être incubée pendant 3 heures à 20° C. La filtration des échantillons est à éviter sauf si elle est absolument nécessaire et, dans ce cas, il ne faut utiliser que des filtres de 0,22 um à membrane liant faiblement les protéines.
4) Inoculation aux cultures cellulaires
Des éprouvettes et flacons de cultures dédoublées de cellules ERM et BF ou d'autres lignées cellulaires acceptables doivent être inoculées avec chacun des extraits traîtés aux antibiotiques à un taux d'un dixiène du volume MM normal. Nous aurons donc des cultures cellulaires inoculées pour chacun des échantillons viscéraux regroupant un pool de 5 poissons à tester. Un temps d'absorption d'une heure doit être donné avant d'ajouter, ensuite le volume normal de MM. Les cultures doivent alors être incubées à 15° C (les doubles, de 15 à 20° C, si un SVC estsuspecté) et examinées quotidiennement pour détecter les signes éventuels d'effets cytopathiques (CPE). Si aucun CPE ne se développe après 7 jours, les cultures doivent être récoltées par congélation et décongélation et ensuite, passées, en utilisant une dilution 1 : 10 dans du MM, sur des cultures cellulaires fraîches pour une deuxième période d'incubation de 7 jours à 15° C (mais toujours de 15 à 20°C si un SVC est suspecté). Si un CPE de type viral se développe, les cultures doivent être récoltées par congélation-décongélation, diluées 1 : 100 et inoculées à des cultures tissulaires fraîches. Si aucun CPE ne se développe pendant la deuxième incubation, le test peut être déclaré négatif ; mais dans le cas contraire, le virus doit être identifié.
5) Cultures cellulaires
Seules des cultures jeunes et en pleine croissance c'est à dire âgées de 1 à 3 jours, formant un tapis cellulaire complet entre 75 et 95 %, devraient être utilisées pour les tests d'isolement. Les cellules BF doivent être cultivées à 20 – 25°C et les cellules FHM à 25 – 30° C.
6) Contrôles positifs
Plusieurs laboratoires ont signalé que plusieurs lignées cellulaires chez les poissons, paraîssent perdre périodiquement leur réceptivité à certains virus de poissons. C'est pourquoi, au moment du test, les sensibilités des cultures cellulaires aux virus VHS, IHN et IPN doivent être confirmées. Ceci peut être fait en inoculant des répliques de cultures cellulaires avec de faibles doses infectantes de virus.
TABLE 1 : VIRUS INFECTIONS IN MARINE FISH
TABLEAU 1 : INFECTIONS VIRALES DES POISSONS MARINS
| A. MARINE SPECIES - ESPECES MARINES | |||
| GEOGRAPHICAL LOCATION | VIRUS TYPE | ||
| DISEASE - MALADIE | HOSTS - HOTES | DISTRIBUTION GEOGRAPHIQUE | TYPE DE VIRUS |
1. HERPESVIRUS DISEASE MALADIE DES HERPESVIRUS | Turbot - Turbot | U.K. - Royaume Uni | HERPESVIRUS |
| Smouth dogfish - Emincle | |||
2. LYMPHOCYSTIS | Gilthead sea-bream - Daurade royale | U.S.A. - Etats Unis | IRIDOVIRUS |
| Israel - Israël | |||
| Striped bass - Bar d'Amérique | U.S.A. - Etats Unis | ||
Japanese flounder - Flétan japonais ou Hirami | Japan - Japon | ||
| Dover sole - Sole de Douvre | U.K. - Royaume Uni | ||
| Flounder, Plaice, Dab - Flétan, Carrelet, Limande | |||
| Baltic herring (& many more) | |||
| Hareng de la Baltique ( et d'autres) | |||
3. BIRNAVIRUS INFECTION INFECTION PAR BIRNAVIRUS | Sea-bass - Loup (bar) | France | BIRNAVIRUS |
| (Turbot - Turbot | France | ||
| A. MARINE SPECIES | (Dover sole - Sole de Douvre) | France | |
| “Striped bass” - Bar d'Amérique | U.S.A. - Etats Unis | ||
| (Atlantic menhaden - Menhaden atlantique) | |||
| (Southern flounder - Flétan) | |||
| (and others - et autres) | |||
| (Yellowtail - Sériole) | Japan - Japon | ||
4. VIRAL ERYTHROCYTIC NECROSIS NECROSE VIRALE ERYTHROCYTAIRENECROSIS | Pacific herring - Hareng du Pacifique | Pacific coast of U.S.A | IRIDOVIRUS |
| Côte pacifique des Etats Unis | |||
| Atlantic herring - Hareng d'Atlantique | Atlantic coast of U.S.A. | ||
| Côte atlantique des Etats Unis | |||
| Atlantic cod - Morue fraîche (Cabillaud atlantique) and U.K. coast et la côte du Royaume Uni | |||
| (and 30 others - et plus de 30 autres) | |||
5. ULCUS SYNDROME SYNDROME ULCUS | Atlantic cod - Morue fraîche | Denmark - Danemark | IRIDOVIRUS |
6. ULCUS SYNDROME | Atlantic cod - Morue fraîche | Denmark - Danemark | RHABDOVIRUS |
7. | “Opaleye” - Girella nigricans | California - U.S.A | CALICIVIRUS |
| Californie - Etats Unis | |||
8. SPAWNING PAPILLOMA PAPILLOME DU FRAI | Smelt - Eperlan | Germany - Allemagne | HERPESVIRUS |
| Putative virus infections - Infections soupçonnées virales | |||
9. EPIDERMAL HYPERPLASIA HYPERPLASIE EPIDERMIQUE | Atlantic cod - Morue fraîche | Denmark - Danemark | ADENOVIRUS |
10. - | Puffer fish - Orbe étoilé | Japan - Japon | REOVIRUS ? |
11. EPIDERMAL PAPILLOMA PAPILLOME EPIDERMIQUE | Gilthead sea-bream - Daurade royale | Spain - Espagne | ? |
| B. SALMONIDS : (1) IN SEAWATER - SALMONIDES : EN EAU DE MER | |||
* VIRAL ERYTHROCYTIC NECROSIS (VEN) NECROSE ERYTHROCYTAIRE VIRALE (VEN) | |||
| Chum salmon - Saumon keta | Pacific and Atlantic coasts of North America ; N. E. Atlantic | IRIDOVIRUS | |
| Pink salmon - Saumon rose | Côtes du Pacifique et de l'Atlantique en Amérique du Nord ; Atlantique N.E. | ||
| Chinook salmon - Saumon royal | |||
| Coho salmon - Saumon argenté (Pacifique) | |||
| “Steelhead trout” (Truite arc-en-ciel) | |||
* VIRAL HAEMORRHAGIC SEPTICAEMIA (VHS) SEPTICEMIE HEMORRAGIQUE VIRALE (VHS) | |||
| Rainbow trout - Truite arc-en-ciel | France - Denmark | RHABDOVIRUS | |
| France - Danemark | |||
| Turbot - Turbot | (Laboratory infections) | ||
| (Infections de laboratoire) | |||
| Sea-bass - Loup (Bar) | (Laboratory infections) | ||
| (Infections de laboratoire) | |||
| Putative virus infections - Infections présumées virales | |||
SWIMBLADDER FIBROSARCOMA FIBROSARCOME DE LA VESSIE NATATOIRE | |||
| Atlantic salmon - Saumon atlantique | U.K. - Royaume Uni | RETROVIRUS ? | |
LYMPHOSARCOMA LYMPHOSARCOME | Atlantic salmon - Saumon atlantique | Norway - Norvège | RETROVIRUS ? |
* EPIDERMAL PAPILLOMA PAPILLOME EPIDERMIQUE | Atlantic salmon - Saumon atlantique | U.K. ; Sweden ; Norway ; U.S.A Royaume Uni ; Suède ; Norvège ; Etats Unis | ? |
* INFECTIOUS PANCREATIC NECROSIS NECROSE PANCREATIQUE INFECTIEUSE | Atlantic salmon - Saumon atlantique | U.K. North America | BIRNAVIRUS |
| Royaume Uni - Amérique du Nord | |||
| Pacific salmon spp. - Saumon du Pacifique spp. | Japan - Japon | ||
| “Steelhead trout” - Truite arc-en ciel | |||
INFECTIOUS HAEMATOPOIETIC NECROSIS NECROSE HEMATOPOIETIQUE INFECTIEUSE | Sockeye salmon - Saumon rouge | Pacific coast of North America | RHABDOVIRUS |
| Chinook salmon - Saumon royal | Japan | ||
| Côte pacifique d'Amérique du | |||
| Chum salmon - Saumon keta | Nord ; Japon | ||
| “Steelhead trout” - Truite arc-en-ciel | |||
CHUM REOVIRUS INFECTION INFECTION REOVIRUS KETA | Chum salmon - Saumon Keta | Japan - Japon | REOVIRUS |
CHINOOK PARAMYXOVIRUS INFECTION INFECTION PARAMYXOVIRUS “ROYAL” | Chinook salmon - Saumon royal | U.S.A. - Etats Unis | PARAMYXOVIRUS |
| C. EELS - ANGUILLES | |||
EUROPEAN EEL ANGUILLE EUROPEENNE | Stomatopapilloma - Stomatopapillome | Germany ; Denmark ; Holland ; England | (1) BIRNAVIRUS (EV-Berlin) |
| Allemagne ; Danemark ; | (2) (EV-1) | ||
| Hollande ; Angleterre | (3) ORTHOMYXOVIRUS (EV-2) | ||
| " | Glomerulonephritis - Glomerulonephrite (“Branchionephritis” - “Brianchionephrite”) | Japan - Japon | BIRNAVIRUS (EVE) |
| " | - - | France ; England France ; Angleterre | BIRNAVIRUS |
| " | - - | France ; Germany ; Denmark ; England ; Japan France ; Allemagne ; Danemark ; Angleterre ; Japon | RHABDOVIRUS (EVEX) |
AMERICAN EEL ANGUILLE AMERICAINE | Haemorrhagic septicaemia Septicémie hémorragique | Japan - Japon | RHABDOVIRUS (EVA) |
| " | - | U.S.A. - Etats Unis | (ORTHOMYXOVIRUS ?) |
JAPANESE EEL ANGUILLE JAPONAISE | Glomerulonephritis - Glomerulonephrite (“Branchionephritis - Branchionephrite”) | Japan - Japon | BIRNAVIRUS |
Underlined - Souligné = Under aquaculture conditions - En conditions d'aquaculture
Dotted underlined - Trait discontinu = held in captivity - Maintenus en captivité
* = Also occurs in freshwater phase of host - Apparaît aussi pendant la phase “eau douce” de l'hôte
TABLE 2
TABLEAU 2
SALMONIDES, HOTES DE L'IPNV
SALMONID HOST OF IPNV
| Salvelinus fontinalis | Brook trout | Omble de fontaine |
| Salvelinus alpinas | Arctic char | Omble chevalier |
| Salvelinus namaycush | Lake trout | Truite de lac (Touladi) |
| Salvelinus leucomaenis | Japanese char | Omble “japonais” |
| Salmo gairdneri | Rainbow trout | Truite arc-en-ciel |
| Salmo clarkii | Cutthroat trout | Truite d'Amérique du Nord |
| Salmo salar | Atlantic salmon | Saumon atlantique |
| Salmo trutta | Brown trout | Truite de mer ou Truite brune |
| Oncorhynchus kisutch | Coho salmon | Saumon argenté |
| Oncorhynchus rhodurus macrostomus | Amago trout | “Amago trout” |
| Oncorhynchus nerka | Sockeye salmon | Saumon rouge |
| Oncorhynchus tschawytscha | Chinook salmon | Saumon royal |
| Oncorhynchus masou | Masu salmon, Yamame | Saumon japonais, Masou, Yamame |
| Oncorhynchus keta | Chum salmon | Saumon keta |
| Prosopium williamsoni | Mountain whitefish | “Mountain whitefish” |
| Hucho hucho | Hutchen, Danube salmon | Saumon du Danube |
| Thymallus thymallus | Grayling | Ombre |
| NON-SALMONID HOSTS OF IPNV - FRESHWATER | ||
| HOTES DE L'IPNV, NON SALMONIDES - EAU DOUCE | ||
| Lampetra fluviatilis | Lamprey | Lamproie |
| Catostomus commersoni | White sucker | Cyprin - sucet |
| Cyprinus carpio | Carp | Carpe |
| Perea fluviatilis | Perch | Perche |
| Rutilus rutilus | Roach | Gardon |
| Abramis brama | Bream | Brème |
| Esox lucius | Chain pickerel | Brochet maillé |
| Phoxinus phoxinus | Minnow | Vairon |
| Barbus barbus | Barbel | Barbeau |
| * Tilapia mossambica | Mozambique mouth brooder | Tilapia (incubateur buccal) |
| Carassius auratus | Goldfish | Cyprin doré |
| Carassius carassius | Crucian carp | Cyprin |
| Scardinus erythrophthalmus | Rudd | Rotengle (Gardon rouge) |
| Xiphophorus xiphidium | “Swordtail platy” | Platy porte épée |
| Barbodis schwanenfeldi | “Schwanenfeld's barb” | |
| Blicca bjoernka | Silverbream | Sar |
| Symphysodon discus | “Discus fish” | |
| Chondrostoma nasua | “Nase” | |
| Brachydanio rerio | “Zebra danio” | |
| Gobio gobio | Gudgeon | Goujon |
| Leuciscus souffia | “Blageon” | |
| Misgurmus anguillicaudatus | Oriental weatherfish | Loche orientale |
| Anguilla anguilla | European eel | Anguille européenne |
| * Anguilla japonica | Japanese eel | Anguille japonaise |
| Stizostedion vitreum vitreum | Walleye (experimental) | Doré jaune |
| Sarotherodon niloticus | Nile tilapia (experimental) | Tilapia du Nil |
| NON-SALMONID HOSTS OF IPNV - MARINE | ||
| HOTES DE L'IPNV NON SALMONIDES - MARINS | ||
| * Brevoortia tyrannus | Atlantic menhaden | Menhaden atlantique |
| * Paralichthys lethostigma | Southern flounder | Fletan de Californie |
| * Dicentrarchus labrax | Sea bass | Loup (Bar) |
| Alosa sapidissima | Shad (experimental) | Alose canadienne (expérimentale) |
| * Scophthalmus maximus | Turbot | Turbot |
| Solea solea | Dover sole | Sole de Douvre |
| * Trinectes maculatus | “Hogchoker” | |
| * Menidia menidia | Atlantic silverside | Capucette |
| * Leiostomus xanthurus | “Spot” | |
| Alosa aestivalis | Blueback herring | Alose d'été |
| * Seriola quinqueradiata | Yellowtail | Seriole (Japon & Corée) |
| * Seriola aureovittata | Amber jack | Seriole Cosmopolite) |
| * Morone saxatilis | “Striped bass” | (Bar d'Amérique) |
| Limanda limanda | Dab | Limande |
| Oxeleotris marmoratus | Sand goby | Gobie commun |
| SHELLFISH HOSTS OF IPNV | ||
| HOTES INVERTEBRES DE L'IPNV | ||
| MOLLUSCS - MOLLUSQUES | ||
Ostrea edulis | Flat oyster | Huître plate |
Crassostrea virginica | American oyster | Huître américaine (Atlant.) |
Crassostrea gigas | Pacific oyster | Huître du Pacifique |
Mercenaria mercenaria | Hard clam | Praire |
Mytilus edulis | Common mussel | Moule commune |
Tellina tenuis | Tellina | Telline |
Illex illecebrosus | Squid | Calmar, encornet |
| CRUSTACEA - CRUSTACES | ||
Carcinus maenas | Shore crab | Crabe vert |
* Penaeus japonicus | Kuruma shrimp | Crevette “Kuruma” |
(Daphnia pulex | Water flea | Daphnie) |
* = Disease associated
Maladie associée
LES FAMILLES DE VIRUS INFECTANT LES VERTEBRES
| SANS ENVELOPPE | AVEC ENVELOPPE | |||||
| ADN db | ADN db | |||||
 Iridoviridae (Tipula iridescent) |  Papovaviridae (Forme papillome) |  Adenoviridae (Adeno humain 2) |  Poxviridae (Vaccinia) |  Herpesviridae (Herpes simplex) | ||
| ARN sb | ||||||
| ARN db | ||||||
 Reoviridae (Reo type 1) |  Paramyxoviridae (Rougeole) |  Orthomyxoviridae (Influenza) |  Rhabdoviridae (Stomatite vésiculaire) |  Retroviridae (Sarcome de Rous) | ||
| ARN sb | ADN sb | |||||
 Caliciviridae Exanthème vésiculaire du porc) |  Picornaviridae (Polio humain) |  Parvoviridae (Rat xilham) |  Arenaviridae (Chorioméningite lymphocystique) |  Coronaviridae (Bronchite infectieuse avaire) |  Bunyaviridae (Bunyam wera) |  Togaviridae (Sindbis) 100 nm |
D'après : MATTEWS R.F. (1982) Classification and Nomenclature of viruses Intervirology, 17, 119 pp.
LES FAMILLES DE VIRUS INFECTANT LES INVERTEBRES
| SANS ENVELOPPE | AVEC ENVELOPPE | ||
| ADN db | ARN db | ADN db | |
 |  |  |  |
| Iridoviridae (Virus Tipula iridescent) | Reoviridae (Bluetongue orbivirus) | Poxviridae (Melalontha entomopoxvirus) | Baculoviridae ("Autographe nuclear polyhedrosis virus) |
| ADN sb | ARN sb | ||
 | 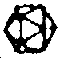 | ARN sb | |
 | |||
| Parvoviridae (Densavirus des Galleria) | Nodaviridae (Nodamura virus) | Rhabdoviridae (Lyssavirus de la rage) | |
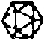 | |||
| Picornaviridae (Cricker paralysis virus) Group Nadouralis virus |  | 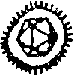 | |
| Bunyaviridae (Bunyamwera virus) | Togaviridae (Alphavirus du Sindbis) 100 nm | ||
D'après : MATTEWS R.F. (1982) Classification and Nomenclature of viruses - Intervirology, 17, 119 pp.
REFERENCES
AHNE, W (1985) Virusinfektionen bei Fischen : Ä etiologie, diagnose and Bekampfung. Zentralblatt für Veterinarmedizin B., 32, 237 – 264.
BONAMI, J.R., COUSSERANS, F., WEPPE, M. and HILL? B.J. (1983). Mortalities in hatchery-reared sea-bass associated with a birnavirus. Bulletin of the EAFP, 3, 41 – 42.
BUCHANAN, J.S., RICHARDS, R.H., MADELEY, C.R. and SOMMERVILLE C.S. (1978) A herpesvirus from the turbot, Scophthalmus maximus. Veterinary Record, 102, 527 – 528
DIXON P.F. and HILL B.J. (1983) rapid detection of infectious pancreatic necrosis virus (IPNV) by the enzyme-linked immunosorbent assay (ELISA). Journal of General Virology, 64, 321 – 330.
DIXON P.F. and HILL B.J. (1984). Rapid detection of fish rhabdoviruses by the enzyme-linked immunosorbent assay (ELISA). Aquaculture, 42, 1 – 12.
HETRICK F.M. (1984). DNA viruses associated with diseases of marine and anadromous fish. Helgoländer Meeresuntersuchungen, 37, 287 – 307.
HILL B.J. (1981). Virus diseases of fish. In: Virus Diseases of food Animals, pp 231 – 261. Ed. by E.P.J. Gibbs. Academic Press. LONDON.
HILL B.J. (1982) Infectious pancreatic necrosis virus and its virulence. In : Microbial Diseases of Fish, pp 91 – 114. Ed. by R.J. ROBERTS. Academic Press : LONDON.
KIMURA T, YOSHIMIZU M. and YASUKA H. (1984) Rapid, simple serological diagnosis of infectious pancreatic necrosis by coagglutination test using antibody-sensitized staphylococci. fish Pathology, 19, 25 – 33.
DE KINKELIN P., MICHEL C. and GHITTINO P. (1985) Précis de pathologie des poissons. Institut National de la Recherche Agronomique - OIE, PARIS - 348 pp.
MOLLER H and ANDERS K. (1986). Diseases and parasites of marine fishes. Verlag Heino Möller, KIEL. 365 pp.
PAPERNA I, SABNAI I. and COLORNI A. (1982). An outbreak of lymphocystis in Sparus aurata L. in the Gulf of Akaba, Red Sea. Journal of Fish diseases, 5, 433 – 437.
RICHARDS R.H. and BUCHANAN J.S. (1978). Studies on Herpesvirus scophthalmi, infection of turbot, Scophthalmus maximum (L) : Histological observations. Journal of Fish Diseases, 1, 251 – 258.
ROBERTS R.J. and SCHLOTFELDT H.J. (1985). Grundlagen der Fischpathologue. Verlag Paul, Parey, Hamburg. 425 pp.
SORIMACHI M. and HARA T. (1985). Characteristics and pathogenicity of a virus isolated from yellowtail fingerlings showing ascites. Fish Pathology, 19, 231 – 238.
WOLF K. (1984). Agents : virales. In: Diseases of Marine Animals. Vol. IV, Part I, pp 17 – 47. Ed. by O; KINNE. Biologische Anstalt Helgoland, Hamburg.