Mr. Amedeo FREDDI
Le terme “contrôle” peut avoir deux significations différentes :
Le maintien des valeurs voulues des paramètres de l'environnement.
Le contrôle de ces valeurs qui inclut les problèmes relatifs à la précision (méthode d'échantillonnage, équipement employé, etc… )
Le contrôle des paramètres de l'environnement se pratique différemment si le but est la recherche ou la production. Pour cette dernière, la nécessité d'une méthodologie simplifiée va restreindre le contrôle aux paramètres les plus représentatifs et, normalement, de plus vastes seuils d'acceptation seront admis, en évitant l'utilisation des équipements les plus sophistiqués.
Plus encore, nous devons nous rappeler que, fréquemment, dans l'activité
productive, ce qu'on appelle “l'intervalle de tolérance” (acceptable range) ne correspond
pas au seuil optimal pour les espèces élevées. En fait, des conditions
anormales seront souvent imposées aux animaux pour améliorer la production. Ceci est
particulièrement vrai pour les systèmes d'élevage intensif (Par exemple, la température
élevée, la forte densité d'élevage, etc… ), mais peut s'appliquer aussi
aux élevages extensifs danslesquels même une simple modification dans la proportion
naturelle des espèces (ex.
Quand une activité productive est programmée, le contrôle de l'environnement revêt différents aspects :
La définition des conditions d'élevage qui dépendent de la biologie des espèces élevées.
L'analyse des conditions d'environnement du site où la structure d'élevage sera implantée.
La sélection des paramètres que nous voulons contrôler durant l'activité productive.
Les méthodes pour assurer la stabilité des paramètres sélectionnés.
Les méthodes de contrôles appliquées.
Les points a et b sont ceux qui vont établir, dans un projet d'aquaculture, la relation entre le modèle d'élevage choisi et le site sélectionné. Les points c, d et e caractérisent les méthodes d'élevage appliquées.
Durant la première phase d'activité (projet préliminaire, points a et b), les paramètres de l'environnement doivent être vérifiés minutieusement. Durant cette période, l'analyse du site couvrira différents aspects (eau, sol et climat, aspects socio-économiques, risques de pollution, etc… ), assurant le maximum d'information afin d'aboutir à la meilleure liaison entre le modèle d'élevage choisi et les conditions de l'environnement existantes.
Pendant la seconde phase (projet final, implantation et démarrage), le plan de travail doit être défini en détails (points c, d, e).
Le contrôle des conditions de l'environnement doit être restreint aux seuls paramètres représentatifs de telle sorte qu'un “check-up” de routine peut être garanti. Cette simplification de la méthodologie assurera que :
Le contrôle de l'environnement va être continu,
Les valeurs des paramètres de base vont être constantes.
Cette plate-forme stable limitera la possibilités des accidents pouvant survenir et aidera à l'analyse des conditions anormales éventuelles.
Quand on travaille avec des animaux poïchylothermes (ectothermes) comme les poissons, le seuil de la température optimale (Annexe 1), qui peut varier en fonction des espèces, doit être respecté. La température adaptée à l'élevage sera la plus élevée à l'intérieur du seuil optimal afin de maintenir la meilleure vitesse de croissance.
Des effets négatifs sur le métabolisme du poisson peuvent être provoqués non seulement par de fausses valeurs absolues de la température, mais aussi par leurs variations (intensité et vitesse), qui dépendent de la température dans laquelle les poissons sont acclimatés (Annexe 2). Ces effets négatifs sont plus accentués quand la différence est éloignée du seuil optimal.
La température peut aussi influencer d'autres paramètres de l'environnement, directement (tel l'oxygène dissous) ou indirectement (augmentation de la production de l'ammoniaque).
Généralement, des températures élevées augmentent les risques pathologiques (Ex. augmentation de la vitesse d'expansion de maladies bactériennes). Plus encore, et particulièrement dans un élevage extensif, beaucoup d'effets négatifs peuvent être induits par des stratifications thermiques dans l'eau.
La stabilité thermique peut être obtenue dans des fermes d'aquaculture fermées (telles que les écloseries) par différents systèmes de chauffages : électrique, à mazout, pompe à chaleur, énergie solaire. Dans les structures plus vastes (grossissement intensif ou élevage extensif), elle est toujours soumise au renouvellement de l'eau et aux radiations solaires. Fréquemment, les serres sont employées dans des structures d'élevage intensif, pour limiter le refroidissement de l'eau pendant la saison froide. L'eau phréatique est souvent utilisée dans l'aquaculture pour ses températures stables, durant toute l'année.
Les systèmes de refroidissement sont rarement employés mais ils peuvent être utilisés, par exemple, pour le décalage de la saison de reproduction.
Les élevages intensifs sont souvent abrités (toujours par l'emploi de filets) pour éviter les radiations solaires excessives et des températures trop élevées penóant la saison chaude.
Le contrôle est effectué à l'aide de thermomètres (précision : 0,5 ou 0,1 °C; thermomètres mini-maxi). Des thermographes avec un contrôle continu de température, sont aussi souvent employés.
La salinité de l'eau pousse le poisson à l'osmorégulation pour que la concentration de sel dans les fluides du corps reste constante. L'osmorégulation demande une consommation d'énergie et son coüt énergétique dépend de la différence entre la salinité de l'eau et la salinité des fluides du corps.
Pour cette raison, quand on élève des espèces euryhalines (telles que loups, daurades, muges, etc… ) des avantages peuvent être obtenus par le maintien des valeurs de la salinité au dessous de la salinité normale de l'eau de mer.
Cet aspect positif peut être aussi remarqué dans l'élevage des larves marines (Annexe 3).
Des valeurs stables de la salinité peuvent être maintenues essentiellement par le renouvellement de l'eau, ou par l'addition d'eau douce pour compenser l'augmentation de la salinité due à l'évaporation. Le contrôle peut être effectué chimiquement, mais, normalement, des densimètres ou réfractomètres optiques sont employés.
L'oxygène dissous doit être considéré comme l'un des facteurs les plus importants pour l'élevage des poissons. Sa quantité dans l'eau est influencée par plusieurs facteurs (température, salinité, matières organiques en suspension, présence d'algues, etc… ) et les différentes espèces de poissons ont des seuils optimaux différents. La quantité d'oxygène dissous est généralement exprimée en mg/l (p.p.m) mais, comme elle dépend de la température et de la salinité, le concept de pourcentage de saturation fournira une meilleure indication. Ce pourcentage, quand il est trop bas provoque de forts taux de mortalité et, même quand les conditions hypoxiques permettent encore la survie des poissons, une grande réduction dans l'efficacité de la conversion alimentaire devient évidente. pour cette raison, les conditions optimales de l'élevage doivent être maintenues avec un pourcentage élevé de saturation (généralement, 70 – 90 %).
Plus encore, la consommation d'oxygène est variable au long de la journée (Annexe 4) et dépend principalement de l'activité alimentaire des poissons. Une distribution rationnelle d'aliments (rationnement) pendant le jour réduira la consommation instantanée de l'oxygène.
Des conditions de sursaturation de l'oxygène sont souvent présentes dans les élevages extensifs (présence d'algues) et dans les élevages intensifs (mauvais fonctionnement des pompes) avec le risque consécutif de la “maladie des bulles de gaz”.
La teneur en oxygène dissous peut être régularisée par des écumeurs (soufflants, aérateurs mécaniques, tubes U, etc… ) et fréquemment, dans le grossissement intensif, par insufflation d'oxygène.
La mesure chimique est pratiquée par la méthode de Winkler, mais les sondes d'oxygène automatiques qui donnent des réponses immédiates sont de plus en plus utilisées.
La présence d'ammoniaque dans une structure d'élevage est principalement due au catabolisme des protéines animales. La quantité est mesurée en “ammoniaque totale” qui comprend l'ammoniaque sous ses deux formes, ionisée (NH4 - N) et non ionisée (NH3 - N). La dernière forme est la plus toxique. Elle est largement diffusée à travers la membrane branchiale (particulièrement dans l'eau douce) et ses concentrations élevées paraîssent inhiber l'excrétion de l'organisme, d'où son accumulation de plus en plus importante dans le sang.
La présence de la forme non ionisée (NH3) augmente avec un pH et une température élevée et diminue quand la salinité augmente (Annexe 5).
L'ammoniaque peut entraîner une mortalité aigüe (concentrations léthales) et des dommages sérieux peuvent être induits par sa présence à une concentration toxique subléthale.
Dans les bassins d'élevage intensif, sa concentration varie quotidiennement à cause de l'excrétion du poisson qui augmente avec l'alimentation. Si le renouvellement d'eau n'est pas correct, les poissons élevés peuvent être exposés à des concentrations d'ammoniaque toxiques, produisant des effets chroniques.
L'ammoniaque oxydée produit des nitrates (N - NO2) et des nitrites (N - NO3). La toxicité des nitrites diminue quand le pH et la salinité augmentent. Ainsi, dans la mariculture, ils ne sont pas un danger sérieux (une concentration de 5 – 10 mg/l n'est pas dangereuse). Les nitrates ne sont pas considérés comme toxiques mais leur concentration doit être gardée au dessous de 50 – 100 mg/l. L'accumulation des nitrites et des nitrates est évitée par le renouvellement de l'eau (et une bonne oxygénation du lit du filtre pour oxyder les nitrites qui se transforment en nitrates). On les mesure particulièrement, quand la filtration biologique est employée, comme indicateur de l'activité bactérienne oxydative dans le lit du filtre.
De grandes quantités d'ammoniaque peuvent être éliminées grâce à des écumeurs qui sont souvent utilisés dans un circuit d'eau fermé, combiné avec une filtration biologique.
Les échangeurs d'ions ont été utilisés dans des structures d'aquaculture d'eau douce pour éliminer l'ammoniaque mais on ne peut les employer dans l'eau de mer où il existe une grande force ionique.
Le spectrophotomètre est normalement employé pour les mesures quantitatives de l'ammoniaque, des nitrites et des nitrates avec un grand degré de précision Néanmoins dans un système productif, l'utilisation d'équipements d'analyse peu chers peut être programmée ; une précision dans les résultats de 0,05 – 0,1 mg/l du total de l'ammoniaque (bleu d'indophénol pour l'eau de mer) suffit, en fait, pour les objectifs d'un élevage.
Les changements des valeurs normales du pH sont utilisées comme indicateurs des variations qui peuvent survenir dans un système d'élevage. D'autre part, le pH a une influence directe sur les conditions de l'environnement. Par exemple, le pH peut être augmenté par l'activité photo-synthétique (élevage extensif) et peut diminuer lors d'une trop faible oxygénation (élevage intensif) et en conséquence, une accumulation de CO2 se produit. En même temps, le pH influence la toxicité de l'ammoniaque et des nitrites.
Dans une structure d'élevage, une valeur correcte du pH (par exemple, 7,9 – 8,3 dans l'eau de mer) doit être maintenue pour deux raisons :
Comme indicateur général des bonnes conditions de l'environnement.
Pour éviter les interférences négatives avec d'autres paramètres de l'environnement.
Les mesures colorimétriques du pH sont sujettes à des interférences dans l'eau de mer.
Des mesures potentiométriques sont normalement utilisées et de petits pH-mètres portatifs sont fréquemment employés du fait qu'ils sont pratiques et conviennent bien aux besoins.
Les variations des valeurs du pH peuvent être tamponnées par addition de cailloux calcaires, par exemple, ou de coquillages, dans un circuit fermé, mais, ici encore, les variations sont normalement évitées par l'augmentation du renouvellement de l'eau.
Néanmoins, comme ces variations indiquent un changement des conditions du milieu, les causes de ce changement doivent être recherchées et, quand c'est possible, éliminées.
Le suivi doit avoir, comme finalités la surveillance des conditions de l'élevage, le contrôle de leurs variations et l'analyse de la productivité de la méthode appliquée.
Les informations récoltées peuvent avoir deux significations.
Information instantanée, qui mène au contrôle ponctuel du système de l'élevage et permet une intervention rapide dans le cas où de mauvaises conditions peuvent exister.
Informations historiques (données d'un long suivi) qui peuvent être obtenues par l'évaluation de la modification des valeurs des paramètres sur une longue durée ; elles peuvent permettre une approche progressive des conditions d'élevage, les mieux adaptées.
Les objectifs pourraient être atteints, si un plan de suivi correctement établi était employé, sa validité dépendant de l'efficacité et de la continuité dans l'obtention des informations.
Un plan est normalement basé sur :
la détermination des secteurs et des unités formant la structure de l'élevage entier.
Le choix des paramètres qui doivent être controlés dans chaque unité.
La détermination du site où l'échantillonnage est le plus efficace, dans chaque unité.
La fréquence et le temps de l'échantillonnage.
La précision exigée
Une structure d'élevage est toujours compliquée, mais ses différentes activités caractérisent les différents secteurs. Par exemple, une ferme d'élevage intensif de poissons marins, combine :
un réservoir d'eau externe,
un secteur pour le stock des géniteurs,
un secteur pour le pré-grossissement (juvéniles),
un secteur pour le grossissement,
des secteurs techniques et des unités de service.
si on prend en considération le secteur d'élevage larvaire, différentes unités peuvent être distinguées :
bassins de stockage des géniteurs et bassins de ponte,
unités pour phyto et zoo-planctons,
unités pour élevage larvaire,
unités de services et unités techniques
Enfin, par exemple, l'unité pour l'élevage larvaire peut être divisée en deux parties :
Bassins pour l'élevage larvaire,
circuit d'eau (circuit externe et circuit fermé d'eau utilisant souvent une filtration biologique).
Dans une unité d'élevage larvaire, par conséquent, le contrôle des conditions de l'environnement doit être effectué dans deux sections différentes : les bassins d'élevage larvaire et le circuit d'eau. L'unité d'élevage larvaire est une section modulaire (plusieurs bassins soumis au même schéma d'aménagement) et ceci facilitera leur contrôle. L'application du plan de suivi prendra en compte l'importance relative de chaque paramètre dans cette unité.
- Température
Les variations des températures pourraient être très dangereuses. Un contrôle doit être fait dans le circuit de l'eau (qui normalement est la seule source de chaleur pour les bassins). La température doit être aussi vérifiée dans chaque bassin, car les différences dans le renouvellement d'eau peuvent induire des différences de température significatives dans les différents bassins, particulièrement quand la 'empérature dans l'écloserie est très basse.
- Salinité
C'est un paramètre très stable, sa valeur est normalement la même que celle notée dans le réservoir d'eau externe.
- Oxygène dissous
Dans las bassins d'élevage larvaire, la biomasse totale (larves et aliment vivant) est basse.
En outre, le renouvellement d'eau est augmenté proportionnellement suivant l'âge larvaire (jusqu'à un échange total/heure) et l'aération est fournie dans chaque bassin. Il est conseillé de vérifier la valeur de l'oxygène dissous dans les plus “vieux bassins” où la biomasse totale et la quantité de nourriture distribuée sont au maximum. L'oxygène dissous doit être mesuré dans le filtre biologique afin de maintenir des conditions correctes pour les populations bactériennes et leurs activités oxydatives.
- Ammoniaque, nitrites, nitrates
On doit les mesurer pour vérifier l'efficacité du filtre biologique. ll doit être rappelé que les valeurs mesurées dans le circuit d'eau ne reflètent pas la situation véritable dans le bassin. Il est nécessaire de vérifier ces valeurs dans les plus “vieux bassins” pour contrôler l'intensité des points les plus élevés (300 – 500 μg/l) en relation avec l'activité alimentaire. (Annexe 4)
- pH
Normalement, c'est un paramètre très stable dans un système bien aménagé. Il est utile de le vérifier pour une évaluation générale des conditions d'élevage.
D'autres analyses, telles que celle de la charge bactérienne totale ou des matières en suspension, etc… peuvent être programmées mais elles ne sont pas typiques des vérifications journalières de l'unité.
Les échantillons doivent être récoltés dans le site le plus approprié, afin qu'un nombre limité d'analyses puisse fournir des renseignements valables sur la structure d'élevage.
- Les bassins d'élevage
La circulation de l'eau, déterminée par l'aération et l'apport d'eau, rend presque uniformes les caractéristiques de l'environnement dans les bassins. Tous les paramètres peuvent être vérifiés à la surface de l'eau (Sur le côté opposé à l'arrivée de l'eau). La concentration de l'ammoniaque peut être mesurée à l'arrivée et à la sortie de l'eau afin d'estimer la quantité d'ammoniaque produite par les larves. Dans tous les cas, un troisième échantillonnage, dans le bassin, est nécessaire pour vérifier la concentration réelle de l'ammoniaque à laquelle les larves sont exposées.
- Circuit d'eau
Un contrôle des caractéristiques de l'eau à travers le circuit d'eau doit être effectué. La température, la salinité et le pH sont vérifiés à l'arrivée de l'eau dans le bassin (la fin du circuit d'eau).
L'oxygène dissous est mesuré après le filtre biologique et ceci permet de vérifier la teneur de l'oxygène dissous à la fois dans le filtre biologique et dans l'eau fournie aux bassins. L'ammoniaque est mesuréeà l'entrée et à la sortie du filtre biologique pour vérifier son efficacité. Toutes ces analyses doivent être aussi effectuées à l'arrivée de l'eau en provenance de l'extérieur.
La réponse que donne le suivi est influencée par la fréquence d'échantillonage, et, dans certains cas par le moment auquel les échantillons ont été collectés. En outre, dans une activité productive, un inutile excès d'analyses doit être évité. Dans une unité d'élevage larvaire, où un circuit fermé contrôlé est employé, le contrôle est normalement inclus dans les activités de routine, c'est à dire dans les heures normales de travail.
- Température
A contrôler chaque jour, au début et à la fin des heures de travail, pour vérifier sa stabilité.
- Salinité
A contrôler une fois par jour.
- Oxygène dissous
Deux fois par semaine, pour vérifier si la valeur optimale est maintenue.
- Ammoniaque, nitrites, nitrates
Deux fois par semaine, dans les bassins d'élevage. On doit les mesurer tard dans l'après-midi. En effet, pendant les premières heures de travail, avant la première distribution de nourriture, l'ammoniaque présente sa concentration minimale, qui va augmenter, le long de la journée par l'activité nutritionnelle des larves (Annexe 4)
- pH
Deux fois par semaine, pour vérifier sa stabilité.
Dans une activité d'élevage, le contrôle continu pendant la période de production est exigé. D'autre part, une grande précision dans les mesures des paramètres de l'environnement n'est pas exigée, car leurs valeurs optimales sont incluses dans un intervalle assez large. Le contrôle est nécessaire pour éviter des variations trop amples et trop rapides.
- Température
Unité de mesure : degre Celsius (ou 0,5° C)
- Salinité
Unité de mesure : 1‰ S
- Oxygène dissous
Calculé à 0,1 mg/l d'exactitude (il est préférable de l'exprimer en pourcentage de saturation.
- Ammoniaque, nitrites, nitrates
A une centaine de microgrammes (0,1 mg/l) pour l'ammoniaque totale. La même unité est toujours adoptée, même si ce n'est pas nécessaire, pour les nitrites et les nitrates.
- pH
Précision : Première décimale
L'exemple développé dans les paragraphes précédents présente le contrôle d'une unité d'élevage larvaire. Il est évident que, dans un autre secteur d'une ferme d'élevage intensif de poisson (Par. 2.2.1.), beaucoup de considérations seraient différentes. Par exemple, dans un secteur de grossissement intensif, où une circulation d'eau ouverte est employée, les variations dans les paramètres de l'environnement sont plus larges et les effets induits par une grande biomasse deviennent plus évidents. Dans un élevage extensif, le plan de contrôle devrait être choisi en fonction des variations saisonnières de l'environnement ; ainsi le contrôle doit être intensifié lors des périodes à grands risques (telles que la période d'hiver ou la période d'été). Chaque secteur aura son propre plan caractéristique de contrôle, mais comme pour l'unité larvaire, il devra être mis au point pour équilibrer l'efficacité du contrôle et les efforts à faire. On doit aussi établir une proportion adaptée entre la dimension de la structure d'élevage et l'équipement employé pour le contrôle. Dans des structures importantes, des instruments automatiques de contrôle doivent être utilisés. Leurs prix élevés sont cependant normalement acceptés parce qu'ils facilitent les vérifications, permettant leur continuité, et que pour cette raison, ils augmentent la sécurité dans les activités productives.
Toutes les informations, collectées dans les différents secteurs, doivent être inscrites dans de simples fiches appropriées à cet usage. (Annexe 6).
En dehors de l'importance de l'information pour un contrôle véritable des structures d'élevage, ces fiches sont utilisées pour élaborer une information globale sur l'activité productive et les techniques appliquées, rendant ainsi possibles des changements justifiés et des prévisions de production.
2.3. Autres paramètres
La stabilité des structures d'élevage et leur contrôle peuvent être basés sur les paramètres fondamentaux suggérés. Néanmoins, plusieurs autres facteurs de l'environnement jouent un rôle important dans la détermination du succès de l'activité d'élevage.
L'importance et les valeurs du seuil optimal d'une partie de ces paramètres ont été individualisées de façon précise lors de travaux de recherche et elles doivent être contrôlées au moyen de paramètres objectifs, tels que le taux de survie et le taux de croissance, l'indice de conversion, l'indice hépato- et gonado-somatique, etc… Dans d'autres cas, la variabilité acceptable des mêmes facteurs n'a pas de limites bien définies et l'expérience de l'opérateur devient très importante.
Par exemple, la densité des proies est l'un des facteurs limitants de l'élevage larvaire des daurades, pendant la première période de l'alimentation (QUILLET et CAMARET, 1982). Son importance est liée à la fréquence de la rencontre proie-prédateurs. La densité correcte des proies peut être facilement contrôlée dans les bassins de l'élevage larvaire et l'efficacité d'élevage rapidement vérifiée à travers les observations du contenu stomacal. Dans l'élevage extensif, la densité des proies caractérise la productivité de la structure d'élevage sous forme de quantité et de qualité de l'aliment à disposition, mais fréquemment, le rapport entre proies et prédateurs est décidé par l'opérateur, en fonction des analyses de la production annuelle, de la qualité des poissons produits ou d'après sa propre capacité à faire des analyses biologiques et écologiques.
Dans une structure de grossissement où la proie est représentée par un aliment artificiel inerte, on induit l'effet “densité de proie” par la façon selon laquelle l'aliment est distribué dans le bassin, et, ici encore, une grande importance est donnée à l'expérience de l'opérateur (équipement employé et temps à disposition), pour limiter les effets stressants relatifs au comportement hiérarchique et territorial (C.B. SCHRECK, 1981).
En ce qui concerne l'activité de prédation larvaire, elle est influencée par plusieurs facteurs, surtout pendant la période critique de la première alimentation. L'acceptation d'une proie dépend, en fait, de sa dimension, de sa vitesse et de son type de mouvement (régulier ou irrégulier), de sa couleur, de son épaisseur et de son goût.
En même temps, l'action du prédateur est influencée par l'intensité et la qualité de la lumière, comme cela a été démontré pour les larves de daurades ; la photo-période apparaît comme importante car dans le cas de prédation visuelle, un prolongement excessif de la période obscure (jeune) provoque des taux de mortalité élevés.
L'activité de prédation normale est affectée aussi par la turbulence de l'eau, qui quand elle est excessive aussi, empêche les larves d'avoir une nage normale. L'incidence de ce facteur diminue avec la croissance larvaire et l'augmentation de la capacité de nage. Un bon exemple est donné par la larve de loup qui, à une longueur de 4,4 mm est capable de nager contre un courant de 0,2 cm/sec. et d'explorer un volume de 1,96 l/h et à une longueur de 5,3mm, nage déjà contre des courants de 0,5 cm/sec. et explore 4,91 l/h (BARNABE, 1980).
D'autres faaceurs de l'environnement interviennent dans la détermination du succès de l'activité de l'élevage, tels que les pollutions organique ou chimique, qui peuvent affecter la structure de l'élevage depuis l'extérieur (eau de renouvellement polluée) ou peuvent provenir de la structure elle-même, par exemple, par l'utilisation de matériau inadéquat (cuivre, fer, etc… )
La pollution peut prendre beaucoup d'aspects particuliers, comme l'aspec acoustique “noise disease”. Le bruit ambiant et les vibrations (pompes, aérateurs, etc… ) peuvent provoquer des dommages aux oeufs et aux larves (BERCYAND BORDEAU, 1985), et réduisent le taux de croissance dans la structure de grossissement. Finalement, on doit rappeler qu'un stress instantané important peut être produit par les procédés habituels de l'élevage, tels que les manipulations (Annexe 4), le triage et le transport qui viennent s'ajouter au stress continu lié au confinement et à la surpopulation ; lls réduisent les performances des poissons, même s'ils doivent être considérés comme des caractéristiques typiques de l'environnement dans une structure d'élevage ; un certain temps est nécessaire pour se rétablir du stress produit qui impose une première (hormonale), une seconde (physiologique) puis une troisième (comportementale) altération.
Ainsi, l'existence de situations de stress continu peut produire des maladies dont les causes ne peuvent pas être aisément déterminées. Par exemple, ceci paraît être le cas de la maladie de la vessie natatoire qui affecte l'élevage larvaire des poissons marins (GIAVENNI et DOIMI, 1983 ; JOHNSON et KATAVIC, 1984, BAGARINAO et KUNGVANKIJ, 1986), et la même hypothèse a été récemment adoptée pour les juvéniles d'ombles chevalier (Salvelinus alpinus) (KOLBEINSHAVN et WALLACE, 1985).
Le contrôle effectif des paramètres du milieu dans une structure d'élevage peut être accompli par simplification de la méthodologie. Il pourrait être réduit à la plupart des paramètres représentatifs (température, salinité, oxygène dissous, ammoniaque et pH) et le suivi de routine de leurs valeurs devra être effectué. Cette simplification permettra le contrôle continu des conditions du milieu, ainsi, il y aura peu de possibilités d'avoir des accidents et les anomalies éventuelles seront plus faciles à analyser.
Un plan correct de contrôle doit être formulé pour chaque partie de la structure d'élevage ; un excès inutile d'analyses peut être évité par l'évaluation des meilleurs sites pour un échantillonnage efficace et par la fréquence du contrôle.
A côté du contrôle de ces paramètres fondamentaux, l'expérience de l'opérateur jouera un rôle important dans le suivi des conditions d'élevage. En effet, l'évaluation de l'état de santé des animaux élevés est souvent basée sur l'expérience de travail plus que sur les résultats de travaux de recherche spécifiques. La capacité à limiter le stress imposé par l'ensemble des activités normales d'élevage ainsi que l'utilisation de paramètres objectifs (taux de survivance, taux de croissance, facteur de conversion, etc… ) utiles pour juger les techniques appliquées, sont des facteurs importants pour la bonne conduite de l'activité productive.
De toutes façons, une collaboration stricte avec un institut de recherches paraît obligatoire afin d'assurer une amélioration continuelle des résultats. Beaucoup des conditions particulières de l'environnement, caractérisant l'élevage, ont été analysées à fond durant les dernières années et les résultats obtenus ont donné une connaissance meilleure des facteurs limitants qui existent dans les systèmes d'élevage.
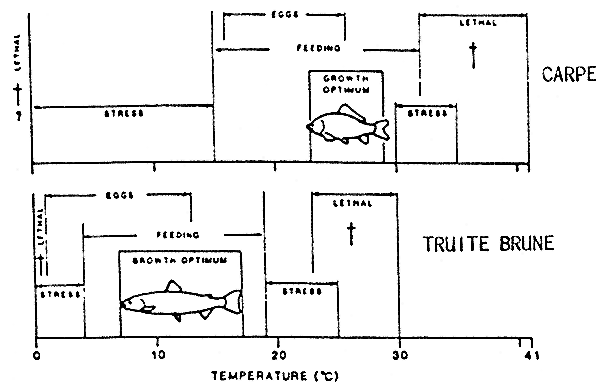
Exemple d'exigences thermiques de deux espèces :
Salmotrutta (Truite brune, sténotherme) et
Ciprinus carpio (carpe, eurytherme) par M. ELLIOT, 1981.
La zone de résistance, où les valeurs de la température ne sont pas favorables, est localisée en dehors du seuil optimal et avant le seuil léthal. L'intensité du stress augmente en approchant du seuil léthal.
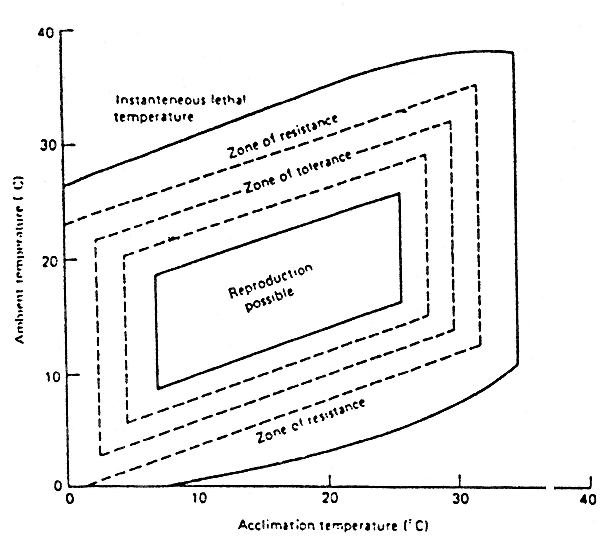
Température de l'environnement tolérée en fonction de la température d'acclimatation.
La température d'acclimatation influencera l'adaptation aux changements de la température ambiante.
Reproduction possible : pas de stress pour l'organisme
Zone de résistance : différents niveaux de stress, limitant l'efficacité de la conversion alimentaire et le taux de croissance
D'après WEATON (1977)
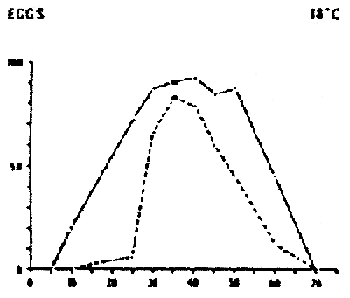 | 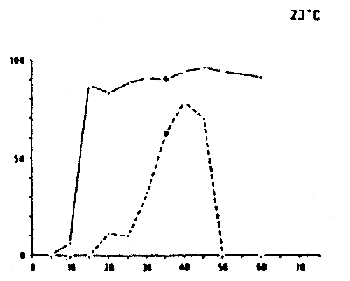 |  |
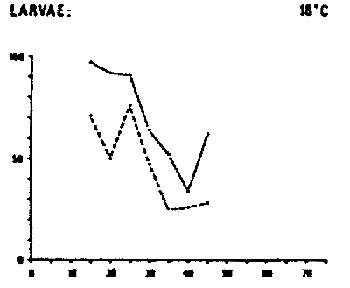 | 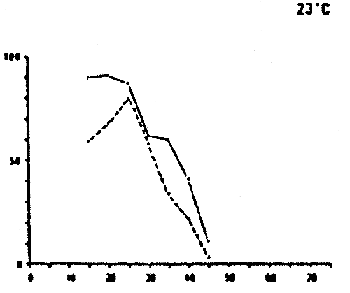 | 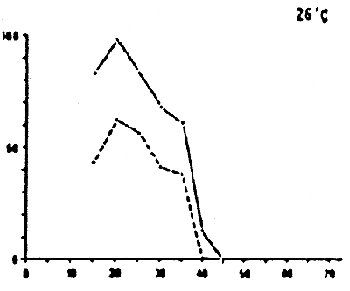 |
DAURADE (Sparus aurata)
Survie et développement normal des oeufs et des larves à différentes combinaisons de salinités et de températures.
Temps de détermination : de l'éclosion (oeufs) et de la fin du stade de l'absorption du sac vitellin (stade larvaire) d'après FREDDI ET AL (1981)
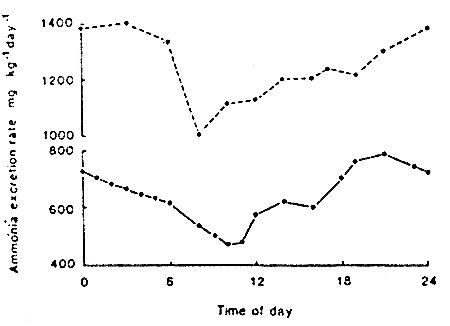
Excrétion typique quotidienne d'ammoniaque de la truite are en ciel dans un élevage intensif (2,4tonnes dans 25 m3, T 9° C)
 Contrôle
Contrôle
 Taux d'ammoniaque des mêmes poissons, un jour après leur mise
en bassin d'élevage, après triage
Taux d'ammoniaque des mêmes poissons, un jour après leur mise
en bassin d'élevage, après triage
L'excrétion de l'ammoniaque est augmentée par la procédure stressante effectuée précedemment. D'après SMART (1981)
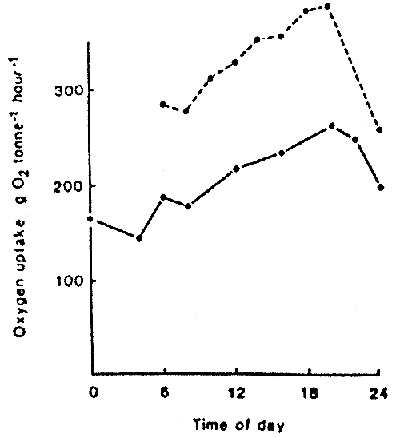
Consommation typique quotidienne d'oxygène de la truite
are en ciel dans un élevage intensif (1,75 tonnes dans 25 m3, T 9° C)
______ Contrôle
--- Taux d'oxygène un jour après la mise des poissons en bassin
d'élevage
Pourcentage d'ammoniaque non ionisée, dans l'eau de mer, à différentes températures et pH.
18 – 22 ‰ S
| pH | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Temp (°C) | pK.′ | 7.5 | 7.6 | 7.7 | 7.8 | 7.9 | 8.0 | 8.1 | 8.2 | 8.3 | 8.4 | 8.5 |
| 0 | 10.10 | 0.251 | 0.315 | 0.397 | 0.499 | 0.627 | 0.788 | 0.990 | 1.24 | 1.56 | 1.96 | 2.45 |
| 1 | 10.07 | 0.270 | 0.340 | 0.427 | 0.537 | 0.675 | 0.849 | 1.07 | 1.34 | 1.68 | 2.11 | 2.64 |
| 2 | 10.04 | 0.291 | 0.366 | 0.460 | 0.578 | 0.727 | 0.914 | 1.15 | 1.44 | 1.81 | 2.26 | 2.83 |
| 3 | 10.00 | 0.313 | 0.394 | 0.495 | 0.623 | 0.783 | 0.984 | 1.24 | 1.55 | 1.94 | 2.44 | 3.05 |
| 4 | 9.97 | 0.337 | 0.424 | 0.534 | 0.671 | 0.843 | 1.06 | 1.33 | 1.67 | 2.09 | 2.62 | 3.27 |
| 5 | 9.94 | 0.363 | 0.457 | 0.575 | 0.723 | 0.908 | 1.14 | 1.43 | 1.80 | 2.25 | 2.82 | 3.52 |
| 6 | 9.91 | 0.391 | 0.492 | 0.619 | 0.778 | 0.978 | 1.23 | 1.54 | 1.93 | 2.42 | 3.03 | 3.78 |
| 7 | 9.87 | 0.422 | 0.530 | 0.667 | 0.838 | 1.05 | 1.32 | 1.66 | 2.08 | 2.60 | 3.25 | 4.06 |
| 8 | 9.84 | 0.454 | 0.571 | 0.718 | 0.902 | 1.13 | 1.42 | 1.78 | 2.24 | 2.80 | 3.50 | 4.36 |
| 9 | 9.81 | 0.489 | 0.615 | 0.773 | 0.971 | 1.22 | 1.53 | 1.92 | 2.41 | 3.01 | 3.76 | 4.69 |
| 10 | 9.78 | 0.527 | 0.662 | 0.832 | 1.05 | 1.31 | 1.65 | 2.07 | 2.59 | 3.23 | 4.04 | 5.03 |
| 11 | 9.74 | 0.567 | 0.713 | 0.896 | 1.13 | 1.41 | 1.77 | 2.22 | 2.78 | 3.48 | 4.34 | 5.40 |
| 12 | 9.71 | 0.611 | 0.768 | 0.965 | 1.21 | 1.52 | 1.91 | 2.39 | 2.99 | 3.74 | 4.66 | 5.79 |
| 13 | 9.68 | 0.658 | 0.827 | 1.04 | 1.31 | 1.64 | 2.05 | 2.57 | 3.21 | 4.01 | 5.00 | 6.21 |
| 14 | 9.65 | 0.709 | 0.891 | 1.12 | 1.40 | 1.76 | 2.21 | 2.76 | 3.45 | 4.31 | 5.37 | 6.66 |
| 15 | 9.61 | 0.763 | 0.959 | 1.20 | 1.51 | 1.90 | 2.37 | 2.97 | 3.71 | 4.63 | 5.76 | 7.14 |
| 16 | 9.58 | 0.822 | 1.03 | 1.30 | 1.63 | 2.04 | 2.55 | 3.19 | 3.99 | 4.97 | 6.18 | 7.65 |
| 17 | 9.55 | 0.885 | 1.11 | 1.40 | 1.75 | 2.19 | 2.75 | 3.43 | 4.28 | 5.33 | 6.62 | 8.20 |
| 18 | 9.52 | 0.953 | 1.20 | 1.50 | 1.88 | 2.36 | 2.95 | 3.69 | 4.60 | 5.72 | 7.10 | 8.78 |
| 19 | 9.48 | 1.03 | 1.29 | 1.62 | 2.03 | 2.54 | 3.17 | 3.96 | 4.94 | 6.14 | 7.61 | 9.39 |
| 20 | 9.45 | 1.11 | 1.39 | 1.74 | 2.18 | 2.73 | 3.41 | 4.26 | 5.30 | 6.58 | 8.15 | 10.0 |
| 21 | 9.42 | 1.19 | 1.49 | 1.87 | 2.35 | 2.93 | 3.67 | 4.57 | 5.69 | 7.06 | 8.73 | 10.7 |
| 22 | 9.39 | 1.28 | 1.61 | 2.01 | 2.52 | 3.15 | 3.94 | 4.91 | 6.10 | 7.56 | 9.34 | 11.5 |
| 23 | 9.35 | 1.38 | 1.73 | 2.17 | 2.71 | 3.39 | 4.23 | 5.27 | 6.54 | 8.10 | 9.99 | 12.3 |
| 24 | 9.32 | 1.48 | 1.86 | 2.33 | 2.92 | 3.64 | 4.54 | 5.65 | 7.02 | 8.67 | 10.7 | 13.1 |
| 25 | 9.29 | 1.60 | 2.00 | 2.51 | 3.14 | 3.91 | 4.88 | 6.07 | 7.52 | 9.28 | 11.4 | 14.0 |
23 – 27 ‰ S
| pH | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Temp (°C) | pK.′ | 7.5 | 7.6 | 7.7 | 7.8 | 7.9 | 8.0 | 8.1 | 8.2 | 8.3 | 8.4 | 8.5 |
| 0 | 10.13 | 0.234 | 0.294 | 0.370 | 0.466 | 0.585 | 0.736 | 0.925 | 1.16 | 1.46 | 1.83 | 2.29 |
| 1 | 10.10 | 0.252 | 0.317 | 0.399 | 0.501 | 0.630 | 0.792 | 0.996 | 1.25 | 1.57 | 1.97 | 2.46 |
| 2 | 10.07 | 0.271 | 0.341 | 0.429 | 0.540 | 0.679 | 0.853 | 1.07 | 1.35 | 1.69 | 2.12 | 2.65 |
| 3 | 10.03 | 0.292 | 0.368 | 0.463 | 0.582 | 0.731 | 0.919 | 1.15 | 1.45 | 1.82 | 2.28 | 2.85 |
| 4 | 10.00 | 0.315 | 0.396 | 0.498 | 0.626 | 0.787 | 0.989 | 1.24 | 1.56 | 1.95 | 2.45 | 3.06 |
| 5 | 9.97 | 0.339 | 0.427 | 0.537 | 0.675 | 0.848 | 1.07 | 1.34 | 1.68 | 2.10 | 2.63 | 3.29 |
| 6 | 9.94 | 0.365 | 0.460 | 0.578 | 0.726 | 0.913 | 1.15 | 1.44 | 1.81 | 2.26 | 2.83 | 3.54 |
| 7 | 9.90 | 0.394 | 0.495 | 0.622 | 0.782 | 0.983 | 1.23 | 1.55 | 1.94 | 2.43 | 3.04 | 3.80 |
| 8 | 9.87 | 0.424 | 0.533 | 0.670 | 0.842 | 1.06 | 1.33 | 1.67 | 2.09 | 2.62 | 3.27 | 4.08 |
| 9 | 9.84 | 0.457 | 0.574 | 0.722 | 0.907 | 1.14 | 1.43 | 1.79 | 2.25 | 2.81 | 3.52 | 4.39 |
| 10 | 9.81 | 0.492 | 0.618 | 0.777 | 0.977 | 1.23 | 1.54 | 1.93 | 2.42 | 3.03 | 3.78 | 4.71 |
| 11 | 9.77 | 0.530 | 0.666 | 0.837 | 1.05 | 1.32 | 1.66 | 2.08 | 2.60 | 3.25 | 4.06 | 5.06 |
| 12 | 9.74 | 0.571 | 0.717 | 0.901 | 1.13 | 1.42 | 1.78 | 2.23 | 2.80 | 3.49 | 4.36 | 5.43 |
| 13 | 9.71 | 0.615 | 0.772 | 0.970 | 1.22 | 1.53 | 1.92 | 2.40 | 3.01 | 3.76 | 4.68 | 5.82 |
| 14 | 9.68 | 0.662 | 0.832 | 1.05 | 1.31 | 1.65 | 2.06 | 2.58 | 3.23 | 4.03 | 5.03 | 6.25 |
| 15 | 9.64 | 0.713 | 0.896 | 1.13 | 1.41 | 1.77 | 2.22 | 2.78 | 3.47 | 4.33 | 5.39 | 6.70 |
| 16 | 9.61 | 0.767 | 0.964 | 1.21 | 1.52 | 1.91 | 2.39 | 2.99 | 3.73 | 4.65 | 5.79 | 7.18 |
| 17 | 9.58 | 0.826 | 1.04 | 1.30 | 1.64 | 2.05 | 2.57 | 3.21 | 4.01 | 5.00 | 6.21 | 7.69 |
| 18 | 9.55 | 0.890 | 1.12 | 1.40 | 1.76 | 2.21 | 2.76 | 3.45 | 4.31 | 5.36 | 6.66 | 8.24 |
| 19 | 9.51 | 0.958 | 1.20 | 1.51 | 1.89 | 2.37 | 2.97 | 3.71 | 4.62 | 5.75 | 7.14 | 8.82 |
| 20 | 9.48 | 1.03 | 1.30 | 1.63 | 2.04 | 2.55 | 3.19 | 3.98 | 4.97 | 6.17 | 7.65 | 9.44 |
| 21 | 9.45 | 1.11 | 1.39 | 1.75 | 2.19 | 2.74 | 3.43 | 4.28 | 5.33 | 6.62 | 8.19 | 10.1 |
| 22 | 9.42 | 1.20 | 1.50 | 1.88 | 2.36 | 2.95 | 3.69 | 4.60 | 5.72 | 7.09 | 8.77 | 10.8 |
| 23 | 9.38 | 1.29 | 1.62 | 2.03 | 2.54 | 3.17 | 3.96 | 4.93 | 6.13 | 7.60 | 9.38 | 11.5 |
| 24 | 9.35 | 1.39 | 1.74 | 2.18 | 2.73 | 3.41 | 4.25 | 5.30 | 6.58 | 8.14 | 10.0 | 12.3 |
| 25 | 9.32 | 1.49 | 1.87 | 2.34 | 2.93 | 3.66 | 4.57 | 5.68 | 7.05 | 8.72 | 10.7 | 13.1 |
28 – 31 ‰ S
| pH | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Temp (°C) | pK.′ | 7.5 | 7.6 | 7.7 | 7.8 | 7.9 | 8.0 | 8.1 | 8.2 | 8.3 | 8.4 | 8.5 |
| 0 | 10.14 | 0.229 | 0.288 | 0.362 | 0.455 | 0.572 | 0.719 | 0.904 | 1.14 | 1.43 | 1.79 | 2.24 |
| 1 | 10.11 | 0.246 | 0.310 | 0.390 | 0.490 | 0.616 | 0.775 | 0.973 | 1.22 | 1.53 | 1.92 | 2.41 |
| 2 | 10.06 | 0.265 | 0.334 | 0.420 | 0.528 | 0.664 | 0.834 | 1.05 | 1.32 | 1.65 | 2.07 | 2.59 |
| 3 | 10.04 | 0.286 | 0.359 | 0.452 | 0.568 | 0.715 | 0.898 | 1.13 | 1.42 | 1.78 | 2.23 | 2.79 |
| 4 | 10.01 | 0.308 | 0.387 | 0.487 | 0.612 | 0.770 | 0.967 | 1.21 | 1.52 | 1.91 | 2.39 | 3.00 |
| 5 | 9.98 | 0.332 | 0.417 | 0.524 | 0.659 | 0.829 | 1.04 | 1.31 | 1.64 | 2.06 | 2.57 | 3.22 |
| 6 | 9.95 | 0.357 | 0.449 | 0.565 | 0.710 | 0.892 | 1.12 | 1.41 | 1.77 | 2.21 | 2.77 | 3.46 |
| 7 | 9.91 | 0.385 | 0.484 | 0.608 | 0.765 | 0.961 | 1.21 | 1.51 | 1.90 | 2.38 | 2.98 | 3.72 |
| 8 | 9.88 | 0.414 | 0.521 | 0.655 | 0.823 | 1.03 | 1.30 | 1.63 | 2.04 | 2.56 | 3.20 | 4.00 |
| 9 | 9.85 | 0.446 | 0.561 | 0.706 | 0.887 | 1.11 | 1.40 | 1.75 | 2.20 | 2.75 | 3.44 | 4.29 |
| 10 | 9.82 | 0.481 | 0.604 | 0.760 | 0.955 | 1.20 | 1.51 | 1.89 | 2.36 | 2.96 | 3.70 | 4.61 |
| 11 | 9.78 | 0.518 | 0.651 | 0.818 | 1.03 | 1.29 | 1.62 | 2.03 | 2.54 | 3.18 | 3.97 | 4.95 |
| 12 | 9.75 | 0.558 | 0.701 | 0.881 | 1.11 | 1.39 | 1.74 | 2.18 | 2.73 | 3.42 | 4.27 | 5.31 |
| 13 | 9.72 | 0.601 | 0.755 | 0.949 | 1.19 | 1.50 | 1.88 | 2.35 | 2.94 | 3.67 | 4.58 | 5.70 |
| 14 | 9.69 | 0.647 | 0.813 | 1.02 | 1.28 | 1.61 | 2.02 | 2.53 | 3.16 | 3.95 | 4.92 | 6.11 |
| 15 | 9.65 | 0.697 | 0.875 | 1.10 | 1.38 | 1.73 | 2.17 | 2.72 | 3.40 | 4.24 | 5.28 | 6.56 |
| 16 | 9.62 | 0.750 | 0.943 | 1.18 | 1.49 | 1.86 | 2.33 | 2.92 | 3.65 | 4.55 | 5.66 | 7.03 |
| 17 | 9.59 | 0.808 | 1.02 | 1.27 | 1.60 | 2.01 | 2.51 | 3.14 | 3.92 | 4.89 | 6.08 | 7.53 |
| 18 | 9.56 | 0.870 | 1.06 | 1.37 | 1.72 | 2.16 | 2.70 | 3.38 | 4.21 | 5.25 | 6.52 | 8.07 |
| 19 | 9.52 | 0.937 | 1.18 | 1.48 | 1.85 | 2.32 | 2.90 | 3.63 | 4.52 | 5.63 | 6.99 | 8.64 |
| 20 | 9.49 | 1.01 | 1.27 | 1.59 | 1.99 | 2.50 | 3.12 | 3.90 | 4.86 | 6.04 | 7.49 | 9.24 |
| 21 | 9.46 | 1.09 | 1.36 | 1.71 | 2.14 | 2.68 | 3.35 | 4.19 | 5.21 | 6.48 | 8.02 | 9.89 |
| 22 | 9.43 | 1.17 | 1.47 | 1.84 | 2.31 | 2.89 | 3.61 | 4.50 | 5.60 | 6.94 | 8.59 | 10.6 |
| 23 | 9.39 | 1.26 | 1.58 | 1.98 | 2.48 | 3.10 | 3.87 | 4.83 | 6.00 | 7.44 | 9.19 | 11.3 |
| 24 | 9.36 | 1.35 | 1.70 | 2.13 | 3.67 | 3.33 | 4.16 | 5.18 | 6.44 | 7.97 | 9.83 | 12.1 |
| 25 | 9.33 | 1.46 | 1.83 | 2.29 | 2.87 | 3.58 | 4.47 | 5.56 | 6.90 | 8.54 | 10.5 | 12.9 |
32 – 40 ‰ S
| pH | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Temp (°C) | pK.′ | 7.5 | 7.6 | 7.7 | 7.8 | 7.9 | 8.0 | 8.1 | 8.2 | 8.3 | 8.4 | 8.5 |
| 0 | 10.16 | 0.218 | 0.275 | 0.346 | 0.435 | 0.547 | 0.687 | 0.863 | 1.09 | 1.36 | 1.71 | 2.14 |
| 1 | 10.13 | 0.235 | 0.296 | 0.372 | 0.463 | 0.589 | 0.740 | 0.930 | 1.17 | 1.47 | 1.84 | 2.30 |
| 2 | 10.10 | 0.253 | 0.319 | 0.401 | 0.504 | 0.634 | 0.797 | 1.00 | 1.26 | 1.58 | 1.98 | 2.48 |
| 3 | 10.06 | 0.273 | 0.343 | 0.432 | 0.543 | 0.683 | 0.858 | 1.08 | 1.35 | 1.70 | 2.13 | 2.66 |
| 4 | 10.03 | 0.294 | 0.370 | 0.465 | 0.585 | 0.735 | 0.924 | 1.16 | 1.46 | 1.83 | 2.29 | 2.86 |
| 5 | 10.00 | 0.317 | 0.398 | 0.501 | 0.630 | 0.792 | 0.995 | 1.25 | 1.57 | 1.97 | 2.46 | 3.08 |
| 6 | 9.97 | 0.341 | 0.429 | 0.540 | 0.678 | 0.852 | 1.07 | 1.34 | 1.69 | 2.11 | 2.65 | 3.31 |
| 7 | 9.93 | 0.367 | 0.462 | 0.581 | 0.730 | 0.918 | 1.15 | 1.45 | 1.82 | 2.27 | 2.85 | 3.56 |
| 8 | 9.90 | 0.396 | 0.498 | 0.626 | 0.787 | 0.988 | 1.24 | 1.56 | 1.95 | 2.45 | 3.06 | 3.82 |
| 9 | 9.87 | 0.426 | 0.536 | 0.674 | 0.847 | 1.06 | 1.34 | 1.68 | 2.10 | 2.63 | 3.29 | 4.11 |
| 10 | 9.84 | 0.459 | 0.577 | 0.726 | 0.912 | 1.15 | 1.44 | 1.80 | 2.26 | 2.83 | 3.54 | 4.41 |
| 11 | 9.80 | 0.495 | 0.622 | 0.782 | 0.982 | 1.23 | 1.55 | 1.94 | 2.43 | 3.04 | 3.80 | 4.74 |
| 12 | 9.77 | 0.533 | 0.670 | 0.842 | 1.06 | 1.33 | 1.67 | 2.09 | 2.61 | 3.27 | 4.08 | 5.04 |
| 13 | 9.74 | 0.574 | 0.721 | 0.906 | 1.14 | 1.43 | 1.79 | 2.25 | 2.81 | 3.51 | 4.38 | 5.46 |
| 14 | 9.71 | 0.618 | 0.777 | 0.976 | 1.23 | 1.54 | 1.93 | 2.42 | 3.02 | 3.78 | 4.71 | 5.85 |
| 15 | 9.67 | 0.665 | 0.836 | 1.05 | 1.32 | 1.66 | 2.07 | 2.60 | 3.25 | 4.06 | 5.05 | 6.28 |
| 16 | 9.64 | 0.717 | 0.900 | 1.13 | 1.42 | 1.78 | 2.23 | 2.70 | 3.49 | 4.36 | 5.42 | 6.73 |
| 17 | 9.61 | 0.772 | 0.970 | 1.22 | 1.53 | 1.92 | 2.40 | 3.00 | 3.75 | 4.68 | 5.82 | 7.22 |
| 18 | 9.58 | 0.831 | 1.04 | 1.31 | 1.64 | 2.06 | 2.58 | 3.23 | 4.03 | 5.02 | 6.24 | 7.73 |
| 19 | 9.54 | 0.895 | 1.12 | 1.41 | 1.77 | 2.22 | 2.78 | 3.47 | 4.33 | 5.39 | 6.69 | 8.28 |
| 20 | 9.51 | 0.963 | 1.21 | 1.52 | 1.90 | 2.39 | 2.98 | 3.73 | 4.65 | 5.78 | 7.17 | 8.87 |
| 21 | 9.48 | 1.04 | 1.30 | 1.63 | 2.05 | 2.57 | 3.21 | 4.01 | 4.99 | 6.20 | 7.69 | 9.49 |
| 22 | 9.45 | 1.12 | 1.40 | 1.76 | 2.20 | 2.76 | 3.45 | 4.30 | 5.36 | 6.65 | 8.23 | 10.1 |
| 23 | 9.41 | 1.20 | 1.51 | 1.89 | 2.37 | 2.97 | 3.71 | 4.62 | 5.75 | 7.13 | 8.81 | 10.8 |
| 24 | 9.38 | 1.29 | 1.62 | 2.04 | 2.55 | 3.19 | 3.98 | 4.96 | 6.17 | 7.64 | 9.43 | 11.6 |
| 25 | 9.35 | 1.39 | 1.75 | 2.19 | 2.74 | 3.43 | 4.28 | 5.32 | 6.61 | 8.18 | 10.1 | 12.4 |
| PERIODE DU ............... | ||
| ESPECE ............... | BASSIN No ............... | AU ............... |
| FICHE No ............... |
| DATE | ||||||||||||||||||||||||||||||
| AGE | ||||||||||||||||||||||||||||||
| T° C | ||||||||||||||||||||||||||||||
| S ‰ | ||||||||||||||||||||||||||||||
| Alimentation | Rotifères | |||||||||||||||||||||||||||||
| Artemia | ||||||||||||||||||||||||||||||
| Artificielle | ||||||||||||||||||||||||||||||
| Fraîche | ||||||||||||||||||||||||||||||
NOTES :
BAGARINAO T. and P. KUNGVANKIJ, 1986. An incidence of swimbladder stress syndrome in hatchery-reared seabass (Lates calcarifer) larvae in the Philippines. Aquaculture 51 : 181 – 188
BARNABE G. 1980. Exposé synoptique des données biologiques sur le loup ou le bar, Dicentrarchus labrax (Linné, 1758). Synop. FAO Pêches, (126) : 70 p.
BERCY C. et B. BORDEAU, 1985. Environnement sonore et aquaculture. Aqua revue No 3, Oct. – Nov. 1985.
BOWER C.E. and J.P. BIDWELL, 1978. Ionization of ammonia in sea-water : effects of temperature, pH and salinity. J. Fish. Res. Board Can. 35 : 1012 – 1016.
ELLIOT J.M., 1981. Some aspects of thermal stress on freshwater teleosts. In : A.D. PICKERING : Stress and fish. Academic Press, 367 pp.
FREDDI A., L. BERG and M. BILIO, 1981. Optimal salinity - temperature combinations for the early life stages of gilthead bream, Sparus aurata L. J. Wordld mariculture Soc. 12 (2) : 130 – 136
GIAVENNI R. e M. DOIMI, 1983. Formazione, differenziamento istologico ed aspetti patologici della vescica natatoria in larve di branzino (Dicentrarchus labrax, L. 1758). Riv. It. Piscic. Ittiop. A. XVIII No 2.
JOHNSON D.W. and I. KATAVIC, 1984. Mortality, growth and swimbladder syndrome of sea bass (Dicentrarchus labrax) larvae under varied environmental conditions. Aquaculture, 38 : 67 – 78
KOLBEINSHAVN A. and JEFF C. WALLACE, 1985. Observations on swimbladder stress syndrome in artic charr (Salvelinus alpinus), induced by inadequate water depth. Aquaculture, 46 : 259 – 261.
QUILLET E. et D. CAMERET, 1982. Elevages des daurades. Synthèse bibliographique. ADA No 9, 98 pp.
SCHRECK C.B., 1981. Stress and compensation in teleostean fish : response to social and physical factors. In : A.D. PICKERING - Stress and Fish. Academic Press, 367 pp.
SMART J.R., 1981. Aspects of water quality producing stress in intensive fish culture. In : A.D. PICKERING - Stress and Fish. Academic Press, 367 pp.
WHEATON F.W., 1977. Aquaculture engineering. John WILEY and sons. NEW YORK Pub. 708 pp.