Les mesures des paramètres limnologiques généraux ont principalement été effectuées à l'aide de la sonde HYDROLAB du projet, recalibrée avec soin pour les mesures de température, conductivité, O2 dissous; il faut signaler ici quelques points qui demandent une correction ou une remise en état du matériel:
la lecture de la conductivité doit être corrigée par l'application d'un facteur obtenu en immergeant l'électrode dans une solution de KCl de titre connu (solution 0,01 M ayant une conductivité à 25°C de 1413 μS/cm; une solution-stock 0,1 M, à diluer 10X, a été réalisée); la lecture fournit une valeur x: la valeur lue pour l'échantillon d'eau est à multiplier par 1413/x;
la mesure de pH est défectueuse: le remplacement de l'électrode de verre (et peut-être aussi de l'électrode de référence) est indispensable, puisque cette mesure est importante, notamment pour le calcul de la concentration en carbone inorganique total (CO2 + HCO3-) disponible pour la photosynthèse du phytoplancton; au cours de nos campagnes, le pH a été mesuré à l'aide d'un appareil WTW “pH95” à microprocesseur, calibré avec des tampons à pH 7 et 10. Au point de vue des solutions-tampons, la trousse HYDROLAB contient encore des sachets de poudre pour préparer 2 l de solutions à pH 7 et 10, auxquelles il faut ajouter plusieurs litres de solutions de même pH livrées récemment dans le cadre de la mission; pour des raisons de conservation, il est conseillé d'employer ces dernières pour l'étalonnage régulier de la nouvelle électrode à acquérir, avant les poudres de la trousse HYDROLAB;
le bon fonctionnement de l'électrode à oxygène a été vérifié: une calibration soigneuse avant chaque campagne est conseillée, une légère dérive ayant été constatée en quelques jours par des lectures faiblement positives dans les zones profondes en principe anoxiques (il peut cependant s'agir d'un effet dû à la pression); il est bon de rappeler que le calcul du taux de saturation demande de tenir compte de la pression normale à l'altitude de la surface du lac et de l'augmentation de pression avec la profondeur, c'est-à-dire:
Pz = Po + 0,0967 z
où Po = pression normale en atm.
et Pz = pression à la profondeur z
On obtient alors la concentration à saturation en O2 dissous par:
O2sat = (O2sat à Po) * (Pz/Po)
où O2sat = concentration à saturation à Po (voir tables de concentration de l'eau saturée en O2 en fonction de la température, avec correction éventuelle pour la salinité de l'échantillon); en guise d'exemple, si on mesure une concentration en O2 à 10 m de 8,54 mg. l-1, elle correspond à un taux de saturation de 56,3 %; en effet, si la concentration à saturation à Po est de 7, 04 mg. l-1 et la pression Pz à 10 m de 1,803 atm (Pz = 0,836 atm + 0,967 atm), la concentration de saturation à 10 m est égale à (7,04 * 1,803/0,836), soit 15,18 mg.l-1.
la mesure du potentiel Redox (ORP), bien qu'étant une mesure relative, est intéressante pour déterminer, en corrélation avec le profil d'oxygéne, la profondeur de la zone de mélange et ainsi la limite inférieure de la vie aérobie.
La mesure de l'énergie lumineuse dans la colonne d'eau a été réalisée en combinant des enregistrements de l'irradiance en surface avec la mesure de l'atténuation de la lumiére dans l'eau.
L'irradiance en surface (Io) a été mesurée avec un quantamètre LICOR LI-190SB couplé à un data logger: le senseur réalise une mesure des radiations photosynthétiquement actives (PAR, en μE.m-2.s-1), qui est échantillonnée toutes les 10 secondes par le data logger. Ce dernier met en mémoire la moyenne, le minimum et le maximum des valeurs collectées pendant 15 minutes. Comme le système est monté sur l'Isambaza et alimenté par un panneau solaire, on dispose ainsi de mesures en continu de l'irradiance en surface du lac à Gisenyi ou au niveau des points d'étude sur le lac. La capacité de la mémoire permet le stockage des données pendant une période de 45 j, mais un déchargement relativement fréquent, soit une fois par semaine, est souhaitable. Ce matériel, avec le software et son mode d'emploi, ont été laissés temporairement à la disposition du projet pêche pour assurer le suivi de ces mesures essentielles à l'évaluation de la production primaire.
D'autre part, nous avons réalisé la mesure de la pénétration de la lumiére dans l'eau par immersion, à plusieurs profondeurs réparties entre 1 m et environ 20 m, d'un photomètre dont l'élément sensible est constitué par une photopile. Le courant émis est mesuré en mV (échelle relative ajustée par un potentiomètre au début de la mesure, suivant l'intensité lumineuse en surface). La plage de sensibilité de la cellule s'étend dans la gamme des radiations photosynthétiquement actives (PAR), avec une plage de réponse maximale entre 500 et 800 nm. Un coefficient d'extinction vertical, en m-1, est obtenu par régression des valeurs en mV en fonction de la profondeur: étant donné la sensibilité de la photocellule, on peut considérer qu'il s'agit d'une bonne approximation du coefficient d'extinction minimal dans la gamme des PAR, que nous appellerons kmin. On peut estimer ainsi. l'épaisseur de la zone photique (Ze, en m), qui s'obtient par 3,7/kmin.
Par exemple, les premières mesures réalisées au large de Gisenyi, le 29/09, donnent un coefficient d'atténuation verticale de la lumière égal à 0,26 m-1 (R2 = 0,981), correspondant à une zone photique de 14,2 m.
La mesure classique de la transparence de l'eau avec le disque de Secchi (S = profondeur de disparition en m), praticable aisément dans la suite de l'étude du Lac Kivu, peut permettre une bonne approximation du coefficient d'extinction vertical de la lumière, en utilisant une conversion du type:
kmin = 1,5/S
Cette conversion a été vérifiée pour le Lac Kivu au large de Gisenyi, où la profondeur Secchi a été évaluée à 6 m.
Connaissant l'irradiance et le coefficient d'atténuation verticale k' (= 1,33 kmin), on peut déterminer l'énergie (Iz) disponible pour la photosynthèse des producteurs primaires à toute profondeur z, grâce à la formule:
Iz = I'o * e-k'z
où I'o = 0,95 Io, ce qui prend en compte l'énergie perdue en moyenne par réflexion à la surface.
Les prélèvements d'eau ont été effectués à la bouteille de Van Dorn (capacité environ 3 1), sur la zone photique pour les mesures de production primaire (à 1, 2, 3, 5, 7,5, 10, 15 et 20 m) et sur la zone de mélange, tous les 10 m jusqu'à 50 m.
2.2.1. Pour les échantillons quantitatifs de zooplancton, 15 l de chaque profondeur de la zone de mélange ont été passé sur un filtre Nytal 63 μm monté dans un dispositif constitué de cylindres en PVC emboîtés: le maillage a été choisi en fonction de la simillitude avec les prélèvements réalisés antérieurement au projet ( filet à plancton 50 μm).
Aprés passage de 15 l sur le Nytal 63 μm, le dispositif de filtration est démonté de façon à pouvoir rincer la toile avec de l'eau du lac placée dans une pissette (environ 100 ml suffisent à un bon rinçage); l'eau de rinçage est recueillie dans un pot de 100 ml et additionnée de formol pour la préservation (ajouter 3 ml de formol 40 % pour une conservation à long terme).
L'eau filtrée sur 63 μm est recueillie, pour chaque profondeur, dans un bidon de 5 1: cette eau est utilisée pour la mesure de la biomasse et de la composition élémentaire du phytoplancton (chlorophylle a, carbone, azote, phosphore), ainsi que pour les mesures de concentration en nutriments (N, P, Si) et carbone dissous.
2.2.2. Pour la mesure de la biomasse phytoplanctonique, une partie des 5 l d'eau passée sur 63 μm (voir 2.2.1) est filtrée sur des filtres Whatmann GF/C (en fibres de verre) de porosité proche de 1 μm, qui recueille dés lors tout le plancton de taille comprise entre 1 et 63 μm (de grandes colonies d'algues bleues, comme celles de Microcystis aeruginosa, peuvent avoir été retenues par le filtre 63 μm: on peut en tenir compte lors de l'examen du zooplancton). Les filtres GF/C ayant recueilli le phytoplancton sont utilisés pour la mesure de la chlorophylle a et de la composition élémentaire de la biomasse (voir plus loin). La quantité à filtrer sur des filtres GF/C de diamètre de 25 mm est de l'ordre de 1 l: on effectue au total 3 filtrations pour la même profondeur, à savoir une pour les pigments chlorophylliens et deux pour le dosage de C:N:P dans la biomasse. Le filtre destiné à la mesure des pigments chlorophylliens est traité immédiatement (addition du solvant d'extraction) ou congelé en vue d'une analyse ultérieure; ceux qui serviront à l'analyse de C:N:P sont séchés et stockés dans de petits conteneurs en polyéthylène.
N.B.- Les filtres à employer pour la filtration des échantillons ont été préalablement passé pendant 2 h au four à 550°C, afin d'éliminer toute trace de matière organique contaminante. Pour les pigments chlorophylliens, on emploie des filtres non prétraités.
- S'il Y a un délai supérieur à quelques heures entre le prélèvement et le traitement, l'eau destinée à la filtration pour les dosages de C:N:P dans la biomasse algale (2 l à différentes profondeurs dans la zone photique) doit être fixée au Lugol (environ 5 ml/l).
2.2.3. Pour les nutriments dissous, on utilise l'eau filtrée sur GF/C (voir 2.2.2); les dosages peuvent être réalisés sur place par des techniques spectrophotométriques, au laboratoire installé au projet; en cas d'un délai trop long (quelques heures) entre le prélèvement et la mesure, l'eau destinée au dosage des nutriments dissous est filtrée et conditionnée sur place dans des flacons en PVC de 100 ml: 3 flacons fixés avec 0,5 ml d'H2SO4 4N pour les formes de N et P et un flacon fixé avec 0,1 ml d'HCl concentré pour analyse pour la silice et d'autres éléments dissous.
2.2.4. Pour le carbone dissous, correspondant aux matières organiques (M.O.) dissoutes, 100 ml d'eau passée sur GF/C est additionnée de 0,1 ml d'H3PO4 concentré pour analyse et une aliquote d'environ 20 ml est placée dans un tube en verre, qui est bouché soigneusement et stocké en vue du dosage en Belgique par un analyseur de carbone Dohrmann DC-80.
A partir des prélèvements effectués sur la zone photique (voir 2.2), un échantillon moyen est réalisé par collecte de 250 ml d'eau de chaque profondeur, de façon à atteindre un volume final de 2 l. Ce volume d'eau est stocké dans un flacon et additionné de 5 à 10 ml de Lugol (solution d'iode, I2 et d'iodure de potassium, KI).
Pour obtenir un échantillon suffisamment concentré pour un examen microscopique (identification et comptage des algues): on procède par sédimentations successives, de la manière décrite ci-après. De retour au laboratoire, l'échantillon est placé dans un cylindre gradué de 2 l pour sédimentation du plancton pendant un minimum de 24 h. Ensuite, 1,5 l de surnageant sont éliminés en siphonant soigneusement et progressivement à l'aide d'un tuyau souple à extrémité rigide; les 500 ml restant sont alors mélangés et versés dans un cylindre gradué de 1 l pour une nouvelle sédimentation de 24 h. Par la suite, on élimine de nouveau le surnageant pour replacer le plancton sédimenté dans un volume de 100 ml. On peut alors placer l'échantillon dans un pot de volume adéquat, en rajoutant la quantité de Lugol nécessaire pour obtenir une coloration brune. Dans un flacon bien bouché, cet échantillon peut être conservé plusieurs semaines en vue d'un examen microscopique (qui nécessitera une nouvelle concentration par sédimentation).
Dans un intervalle de temps donné t (en jour), le développement du phytoplancton dépend du carbone qu'il assimile par sa photosynthèse, du métabolisme des cellules algales (respiration, assimilation des substances nutritives, excrétion) et de différents processus de disparition (sédimentation, prédation par le zooplancton, mortalité, …).
Ceci peut s'écrire, si l'on estime la biomasse phytoplanctonique par son contenu en carbone:
dPHY/dt = (P - (R+E) - S - G - M - L)PHY
où PHY= biomasse phytoplanctonique en mg C.m-2
dPHY/dt = variation de la biomasse exprimée en C
(mgC.m-2.j-1)
P = taux de photosynthèse brute du phytoplancton (j-1)
R = taux de respiration du phytoplancton (j-1)
E = taux d'excrétion du phytoplancton (j-1)
S = taux de sédimentation du phytoplancton (j-1)
G = taux de “grazing” ou prédation du phytoplancton par le
zooplancton (j-1)
M = taux de mortalité (naturelle, parasitisme)
du phytoplancton (j-1)
L = exportation (ex. : sortie par un exutoire) (j-1).
En d'autres termes encore, la dynamique du phytoplancton est contrôlée par l'équilibre entre un terme de production, P, et des termes de disparition liés au métabolisme des algues et aux caractéristiques biotiques et abiotiques de leur environnement. Le terme primordial de la production phytoplanctonique est donc le taux de photosynthèse P: si celui-ci est élevé, il peut excéder largement la somme des taux de disparition, ce qui permet, a priori, un taux de croissance élevé.
Pour rappel, la photosynthèse des végétaux chlorophylliens est un processus de transformation de l'énergie lumineuse en énergie chimique, qui permet la synthèse de nouvelles molécules organiques. De façon très simplifiée, le processus se résume comme suit:
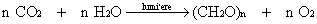
L'activité photosynthétique peut donc se mesurer soit par l'assimilation du CO2 soit par la production d'O2.
Pour estimer la production phytoplanctonique, la méthode classique consiste à recueillir des échantillons d'eau à différentes profondeurs et à les incuber dans des bouteilles “claires et sombres” à la profondeur à laquelle le prélèvement a été effectué. A la fin de l'incubation, on estime l'activité photosynthétique dans les bouteilles claires, en mesurant l'O2 produit ou le CO2 assimilé. C'est l'assimilation du C inorganique, dont la mesure est basée sur l'utilisation d'un traceur radioactif, qui a été retenue pour l'estimation de la production planctonique du Lac Kivu, vu sa grande sensibilité.
Les mesures d'activité photosynthétique obtenues permettent de tracer un profil photosynthèse-profondeur, dont on déduit, grâce à la connaissance de la relation lumière-profondeur, une relation photosynthèse-lumière. Cette dernière, outre des informations qu'elle fournit sur la physiologie du phytoplancton, permettra un calcul de la production primaire journalière à partir des données provenant de l'incubation, dont la durée est limitée afin de minimiser les effets de l'isolement du phytoplancton dans un milieu clos.
Dans chaque bouteille contenant un échantillon d'eau collecté à une profondeur donnée de la zone photique, on injecte en début d'incubation une quantité connue de bicarbonate radioactif (NaH14CO3). Ce C inorganique marqué (14C) est assimilé par les algues de la même façon que le C inorganique non marqué (12C) dissous initialement dans l'eau, ce qui peut s'écrire:
12C assimilé/12C total = 14C assimilé/14C total
On en déduit:
12C assimilé = (14C assimilé/14C total) * 12C total
où - 12C total est calculé à partir des mesures de pH et
d'alcalinité de l'eau
- 14C total correspond à la radioactivité introduite
initialement dans les bouteilles
- 14C assimilé est la radioactivité des algues,
recueillies sur un filtre de porosité
adéquate.
On prélève tout d'abord de l'eau du lac à diverses profondeurs de la zone photique, déterminées en fonction de la transparence de l'eau: des prélèvements à 1, 2, 3, 5, 7, 5, 10 et 15 m assurent une exposition à des intensités relatives comprises entre 77 et 2 % environ de I'o. Deux bouteilles en verre à bouchon rodé d'une capacité approximative de 100 ml sont remplies pour chaque profondeur de prélèvement. Deux bouteilles supplémentaires sont remplies: elles sont occultées par une feuille d'aluminium et seront incubées à 20 m pour l'estimation de la fixation hétérotrophe de C.
Le 14C est conditionné dans des ampoules en verre contenant une activité de 250 μCi; leur conservation à long terme nécessite une congélation.
Avant l'injection dans les bouteilles de 100 ml contenant l'eau à incuber, le contenu d'une ampoule est dilué dans 8 ml d'H2O distillée; 0,5 ml de cette solution sont ajoutés à chaque bouteille, qui reçoit ainsi environ 15 μCi de 14C.
Les bouteilles sont alors mises à incuber rapidement à leur profondeur de prélèvement respective. A la fin de l'incubation, d'une durée d'environ 2h, 1 ml de formol est ajouté dans chaque bouteille afin de “stopper” l'activité métabolique des algues.
Au laboratoire, on mélange dans un même récipient le contenu des deux bouteilles incubées à la même profondeur. On en prélève d'abord 0,5 ml qui sont placés dans une fiole à scintillation contenant 0,25 ml de phényléthylamine: cet échantillon servira à la mesure de l'activité totale (14C total).
On passe ensuite le reste de l'échantillon, soit un peu plus de 200 ml, sur un filtre Millipore 0,45 μm (filtration sous vide et collecte de l'eau filtrée radioactive dans une fiole à vide). Après rinçages à l'eau distillée et séchage, le filtre supportant les algues radioactives est placée dans une fiole à scintillation.
La mesure de radioactivité se fera ultérieurement par scintillation liquide. Il est à noter que ce protocole est proche de celui utilisé par Hecky et al. (1978) au lac Tanganyika, sauf pour la technique d'incubation (dans un incubateur donnant une intensité constante au Tanganyika) et le temps d'incubation (ici, 2 h contre 4 à 8 h au Tanganyika, des temps courts étant préférables pour éviter les “bottle effects”). Enfin, l'estimation de la production journalière a été réalisée par la méthode de Talling (1957), qui a largement fait ses preuves pour les lacs africains (Talling, 1965). Cette méthode permet une bonne aproximation de la production journalière intégrée sur la colonne d'eau (SSP), par le calcul suivant:
SSP (mgC.m-2.j-1) = (nPmax/k').(ln 2(I'o/Ik).DT.0,9 (1)
où nPmax est le taux maximal d'activité photosynthétique
mesuré, en mgC.m-3.h-1
k'est le coefficient d'atténuation verticale, en m-1
I'o est l'irradiance moyenne en surface pendant la
journée, en μE.m-2.s-1
Ik est le paramètre de saturation de la relation
photosynthèse - lumière, déduit du profil
photosynthèse-profondeur, en μE.m-2.s-1
DT est la durée du jour en h.
Il est également possible, à partir de ces mesures, de calculer la “profondeur critique”, Zc, sous laquelle le taux net de production devient négatif: si la profondeur de la zone de mélange, Zm, excède Zc, tout développement du phytoplancton est impossible. La formule de calcul de Zc est la suivante (Kirk, 1986):
Zc = (DT/24.k'.r).(ln 2(I'o/Ik) (2)
où r = rapport entre respiration et taux de photosynthèse en lumière saturante, habituellement de l'ordre de 0,1.
Afin d'évaluer correctement les potentialités de croissance des algues dans un milieu naturel, la connaissance des teneurs en nutriments essentiels est indispensable. Pour cette raison, diverses méthodes de mesure de ces nutriments ont été mises au point et calibrées avec le matériel apporté à Gisenyi dans le cadre de la mission: il s'agit des dosages de la silice dissoute, du phosphore réactif dissous (SRP) et des formes inorganiques de l'azote (NH4+, NO2-, NO3-). Les étalonnages réalisés sont présentés en annexe (tableau a.1). Les méthodes utilisées sont les suivantes:
Cependant, malgré les seuils de détections très bas de méthodes de dosage, les mesures effectuées sur place n'ont pas permis la détection d'azote et de phosphore inorganique dissous. Pour cette raison, la mesure sur place des nutriments dissous a rapidement été abandonnée et des échantillons prélevés à diverses profondeurs ont été conditionnés comme indiqué en 2.2.3. en vue d'un dosage ultérieur.
Puisque, dans les milieux pauvres en nutriments, les substances nutritives sont en majeure partie “piégées” dans la biomasse planctonique, il est utile de recueillir des échantillons de plancton pour déterminer sa teneur en nutriments. Ceci permet en outre, sur la base des rapports C:N:P, de déterminer si le phytoplancton est carencé en nutriments, quel nutriment est potentiellement limitant (N ou P) et d'évaluer l'intensité de cette limitation.
Les échantillons pour ces dosages ont été recueillis comme indiqué en 2.2.2 Ces mesures ont recours au dosage du phosphore organique après une hydrolyse (méthode modifiée à partir de Wetzel & Likens, 1979) et à l'utilisation d'un analyseur élémentaire pour le C et le N organiques. Outre les informations que l'on recueillera sur l'état nutritionnel des algues, on disposera aussi d'une mesure de leur biomasse de plancton comprise entre 1 et 63 μm, que l'on peut estimer correspondre au phytoplancton.
La mesure de la concentration en chlorophylle a constitue une estimation simple et spécifique de la biomasse du phytoplancton.
Les pigments sont extraits du plancton recueilli sur un filtre GF/C de 25 mm ou 90 mm (filtration de 1 à 5 l d'eau prélevée à chaque profondeur), placé dans un tube en verre, par un solvant constitué par un mélange acétone-méthanol 5/1 (Pechar, 1987); l'extraction se fait à chaud par placement des tubes dans un bain-marie à 65°C (constitué par un bac plastique où plonge une résistance thermostatisée de type Thermomix) : elle est ainsi plus efficace et réduite à 2 min. Des billes sont placées sur les tubes contenant les filtres et le mélange acétone-méthanol pour éviter l'évaporation du solvant. L'absorbance se mesure au spectrophotomètre à 665 nm, dans des cellules de 50 mm, avant et après acidification (Lorenzen, 1967). La concentration en chlorophylle a “active” est calculée d'après l'équation générale basée sur la diminution d'absorbance de l'extrait acidifié (Marker et al., 1980 et Pechar, 1987). L'équation est la suivante:
Chl.a (μg.l-1) = (Db - Da) * 2,439 * 11,89 * v / (V * l)
où Db est la densité optique de l'extrait avant
acidification
Da est la densité optique de l'extrait après
acidification
v le volume de l'extrait total en ml
V le volume d'eau filtrée en l
l la longueur du parcours optique en cm
La teneur en pigments chlorophylliens a totaux (formes dégradées + forme active) peut être calculée à partir de Da:
Chl.a (μg.l-1) = 11,89 * 1,7.Da * v/(V * l)