M. G. SAROGLIA
Dans le fonctionnement d'une installation d'élevage de poissons, l'éleveur supporte des frais pour acheter (ou produire) de jeunes poissons, pour acheter la nourriture et l'énergie nécessaire au fonctionnement des pompes et des installations d'aération.
Pour récupérer l'argent investi et réaliser une marge suffisante de bénéfice, l'éleveur doit se poser comme objectif la réduction de toutes les consommations pour obtenir la production commerciale dans les plus brefs délais possibles, en minimisant les pertes de poissons par mortalité, en optimisant l'efficacité de conversion de la nourriture et en réduisant à l'essentiel les frais d'énergie.
Cet objectif doit être poursuivi en contrôlant l'environnement, à savoir l'ensemble des facteurs physiques, chimiques et biologiques susceptibles d'être la cause directe ou indirecte de stress chez les animaux élevés.
Parmi ces factcurs de milieu, une importance particulière est revêtue par la qualité de l'eau, les techniques de gestion, la qualité des aliments et les conditions hygiéniques de l'élevag. Les éleveurs effectuent plusieurs opérations (nettoyage des bassins, sélection des dimensions, changement de bassin et transport, etc…) qui, notoirement, affectent les poissons.
En plus de ces opérations routinières, le poisson peut être stressé par la mauvaise qualité de l'eau, par la présence d'agents d'infestation ou infectieux (parasites, champignons,bactéries et virus), par la présence de prédateurs, etc…
Du point de vue de l'éleveur, le stress doit être considéré comme un état causé par certaines procédures, par l'environnement ou par des événements qui interfèrent avec la capacité du poisson de croître jusqu'à la taille commerciale dans les délais prévus.
Les poissons élevés montrent une large plage de réponses aux stimulations stressantes, certaines apparentes, telles que perte d'appêtit, changements de comportement ou mort; d'autres occultes, telles que conversion non-efficace de la nourriture et modification de paramètres physiologiques. Dans cet exposé, nous examinerons, à titre d'exemple, les stress produits par les fluctuations de catabolites et en gaz dissous, en cernant les paramètres indicateurs de l'état de perturbation et en signalant quelques interventions possibles visant à contrôler le stress.
La plupart des espèces de poissons employées en aquaculture peut supporter des oscillations des nombreux paramètres chimiques et physiques du milieu, pourvu que celles-ci soient comprises entre des limites bien déterminées. Tant que ces limites ne sont pas dépassées, le poisson reste dans des conditions que nous pouvons définir de bonne santé et l'homéostasie est maintenue (fig. 1). Pour des oscillations supérieures à ces limites de tolérance et qui entrent dans la zone du seuil du risque, le poisson est stressé, bien qu'il y ait encore une compensation de l'homéostasie. Au-delà du seuil de risque, un désiquilibre de l'homéostasie intervient et le poisson commence à révéler de profonds changements des paramètres physiologiques. Lorsque ces conditions se prolongent, le point de “rupture” est dépassé et le poisson mourra ou, en tout cas, sera sérieusement atteint, même si les conditions de milieu redevenaient normales.
Pour des fluctuations au-dessus de la plage normale, en tout cas, bien que les conditions physiologiques générales demeurent acceptables, on assiste à une dépense énergétique due à l'instauration de mécanisme de compensation de défense.
Tout cela pourra aboutir à une réduction de l'énergie disponible pour la croissance.
Si nous alimentons les poissons avec une quantité quotidienne d'aliment commercial sec égale à 2 % de leur poids frais, ceux-ci ont à leur disposition près de 100 calories (419 joules) par poisson, par jour.
De ces calories, seules 59 calories constitueront l'énergie nette disponible et seront dépensées pour le métabolisme général et, plus précisément, pour les activités motrices de base au repos, pour les pertes caloriques, activation de processus de détoxication et de défense contre les stress, ainsi que pour des réactions de fuite et pour la nage active.
L'énergie à la disposition de la croissance ne sera donc que la différence restante et, si les conditions d'élevage sont optimisées, celle-ci pourra arriver au maximum à 45 % de l'énergie initiale ingérée.
Au contraire, dans des conditions non optimales, le pourcentage d'énergie disponible pour la croissance diminuera jusqu'à, dans la pire des hypothèses, être négative et entraîner ainsi la perte de biomasse.
Parmi les facteurs de milieu de nature chimique qui, stimulant les mécanismes de défense, peuvent entraîner une dépense énergétique, considérons à présent, à titre d'exemple, les cataboles azotés. Le plus important d'entre eux est l'ammoniaque, produite par le catabolisme des protéines et des acides aminés.
La quantité d'ammoniaque produite par un poisson, en 24 heures, varie avec la température, la taille du poisson et le type d'alimentation.
Par exemple, pour le bar (Dicentrarchus labrax), à la température de 18–24° C et pour des poissons de taille moyenne, on est dans l'ordre de 400 mg d'azote ammoniacal par kg de poisson, par jour (fig. 2). Cette quantité devra être éliminée avec un échange d'eau suffisant.
La production d'ammoniaque toutefois n'est pas constante à toutes les heures de la journée, mais augmente jusqu'à 3 – 4 fois les valeurs de base après l'alimentation (fig. 3). Nous avons ainsi des fluctuations journalières dans la concentration d'ammoniaque à l'intérieur des bassins, dont il faudra tenir compte car, même si les mesures chimiques effectuées, par exemple, le matin, indiquent une concentration d'azote ammoniacal acceptable, à d'autres heures de la journée, la concentration pourra dépasser le seuil de tolérance.
Dans ce cas, les animaux répondront, en réduisant la quantité d'excrétion ammoniacale, avec augmentation des ions ammonium dans le sang (ammoniémie) suite à l'accumulation des produits d'excrétion (fig. 4).
De plus, l'exposition à l'ammoniaque réduira la surface fonctionnelle des branchies, diminuera la respiration et ralentira le métabolisme.
L'analyse même microscopique des branchies sur poisson frais est un bon système pour diagnostiquer la perturbation due à des concentrations élevées même intermittentes d'ammoniaque.
D'autres facteurs de milieu, tels que température, salinité et pH influent sur la toxicité de l'ammoniaque totale.
La composante d'ammoniaque indissociée, NH3 doit être considérée comme la forme toxique d'azote ammoniacal.
Voyons sur les diagrammes des fig. 5 et 6 comment cette composante est influencée par la valeur de pH et la température.
Les effets sur la croissance du poisson commencent à devenir évidents pour des valeurs supérieures à 0,05 mg/1 de N - NH3, qui se produisent pour 6 mg/1 environ d'ammoniaque totale à pH 7,2, mais à 1,0 mg/1 pour un pH de 8,2.
Une oxydation de l'ammoniaque produisant des nitrites et des nitrates a lieu sous l'action de bactéries du genre Nitrosomonas et Nitrobacter, avec consommation d'oxygène.
Lorsque la concentration de O2 est faible ou que l'ammoniaque est présente à des concentrations trop élevées, l'oxydation peut s'arrêter au stade intermédiaire d'azote nitreux qui, par conséquent, s'accumule dans l'eau.
Cette forme azotée possède aussi un niveau de toxicité élevé, et peut interférer avec les systèmes de transport de l'oxygène, en vertu de l'oxydation irréversible de l'hémoglobine en methémoglobine, un pigment qui n'est plus en mesure de transporter l'oxygène.
Pour une exposition à une concentration létale de nitrites, dès les premières heures, on assiste à l'apparition de pourcentages élevés de méthémoglobinémie (fig. 7).
Au bout de 1 à 2 jours, commence à apparaître une forme d'anémie hémolytique grave avec une forte réduction de l'hémoglobine totale.
La mesure de la concentration hématique de méthémoglobine et d'hémoglobine totale sont de bons indices pour le diagnostic de niveaux excessifs d'azote nitreux dans l'eau. De même, l'analyse histochimique peut servir à indiquer la perturbation due à des nitrites. En effet, en procédant à la coloration du tissu splénique avec du bleu de Prusse, l'anémie hémolytique sera mise en évidence par des dépots élevés de fer ferrique dans la rate qui deviendront d'un bleu intense.
A la diminution de la concentration d'hémoglobine totale, correspondra le début de la mortalité parmi la population.
L'effet du stress dû aux nitrites peut continuer aussi lorsque l'exposition au toxique est terminée. De fait, quelques heures après une unique exposition à une concentration létale d'azote nitreux, malgrè la disparition rapide de la méthémoglobinémie, le processus qui porte à l'anémie hémolytique continue de façon irréversible (fig. 8).
Dans le cas que nous indiquons, le retour aux valeurs physiologiques d'hémoglobinémie n'a lieu que 24 jours après la fin de l'événement stressant.
Il est donc évident qu'un diagnostic rapide d'intoxication par nitrites permet d'éviter de gros dommages à la production qui peuvent se manifester même plusieurs jours après l'exposition aiguë.
Parmi les facteurs de milieu, la salinité est un de ceux qui influent le plus sur la toxicité des nitrites.
Plus particulièrement, les ions chlorure, interfèrant au niveau de la membrane branchiale avec la nitrite, peuvent réduire la toxicité jusqu'à trois ordres de grandeur, si l'on passe de l'eau douce à l'eau de mer à 37% de salinité (fig. 9). Ceci indiquerait que, dans le cas d'élevages en eau douce, surtout si l'eau est partiellement recyclée, une protection prophylactique contre les nitrites peut être effectuée en additionnant des quantités limitées d'ion chlorure, par exemple en ajoutant de l'eau de mer aux systèmes de recyclage.
En bref, dans de l'eau d'une teneur limitée en catabolites, on peut envisager une bonne croissance des poissons, un bon facteur de conversion de la nourriture et des perles limitées par mortalité.
Des teneurs élevées en catabolites peuvent par contre, entraîner des pertes élevées d'énergie avec une réduction du facteur de conversion, avec le risque d'apparition de pathologies infectieuses, perte d'animaux due à une mortalité aiguë et chronique.
Le paramètre que nous examinerons à présent, tout aussi important que les catabolites azotés, est l'oxygène dissous.
La capacité des poissons de consommer de l'oxygène varie en fonction de la pression partielle de ce gaz dans l'eau, et donc de sa concetration (fig. 10).
Au dessous de la concentration létale initiale, le poisson résiste pendant un temps limité puis meurt.
Dans la zone de dépendance respiratoire, le poisson actionne des mécanismes de régulation et de compensation qui, consommant de l'énergie, réduisent sa disponibilité pour d'autres processus vitaux tels que la nage, l'utilisation de la nourriture et la croissance. La protection la meilleure pour le poisson est assurée par des valeurs de tension de l'oxygène situées dans la zone de régulation respiratoire.
C'est pourquoi l'oxygène aussi peut agir, lorsqu'il n'est pas présent dans des concentrations suffisantes, comme inhibiteur de croissance et d'efficacité de conversion des aliments.
A cet effet, donc, les éleveurs, en général, adoptent des systèmes mécaniques tels qu'oxygénateurs à aubes, pompes, etc…, ou bien, insufflent de l'oxygène liquide. Tous ces systèmes, comme aussi l'augmentation d'échange de l'eau, constituent un coût en énergie électrique ou en combustibles. Leur emploi doit donc être programmé et prévu dans les endroits précis du bassin où effectivement l'oxygène est nécessaire.
Alors qu'un excès limité d'oxygène se résoudre en un gaspillage d'énergie électrique, des valeurs dépassant un seuil déterminé de sursaturation peuvent, à leur tour, provoquer un syndrome appelé par les auteurs anglosaxons “gas bubble disease” (GRD).
Le GBD peut tuer les poissons d'élevage lorsque le seuil se risque est dépassé.
Certains facteurs, tels que l'espèce et le niveau de développement ontogénétique, en plus de la température et de la nature des gaz dissous, peuvent influer sur le seuil de risque (fig. 11).
La sursaturation gazeuse a plusieurs causes dont, par exemple, l'insolation, le mauvais fonctionnement des pompes et l'oxygénation excessive de l'eau dans des réservoirs pressurisés et peut avoir aussi une évolution cyclique.
Pour éviter les pertes de poissons, il faut déceler au plus tôt les signes pathognomiques de la “gas bubble disease”, qui sont essentiellement les embolus, les emphysèmes et les hémorragies.
En conclusion, comme nous l'avons souligné auparavant, les facteurs stressants qui peuvent intervenir sur la vie du poisson d'élevage sont de différente nature et souvent des agents stressants sont présents simultanément.
Les stress qui dépassent les limites de tolérance physiologique peuvent être létaux. Des stress moins graves, qui toutefois sont les plus fréquents, réduiront la croissance, prédisposeront le poisson aux infections et réduiront la possibilité de supporter des stress ultérieurs.
La baisse d'efficacité de la conversion de l'aliment en chair et le pourcentage des maladies infectieuses peuvent être considérés comme des indicateurs de stress.
Malheureusement, lorsque ces effets indicateurs sont décelables, les dommages économiques pour la production de poissons sont déjà effectifs.
D'où la nécessité de connaître et d'avoir à disposition des facteurs de protection contre le stress, en mesure d'élever les seuils de risque ainsi que des paramètres “indicateurs” d'apparition précoce et d'interprétation sûres.
Des intégrations alimentaires opportunes peuvent agir en favorisant les défenses de l'organisme, comme dans le cas de l'acide ascorbique, vitamine qui possède une capacité éprouvée de défense contre les stress en général, et en particulier contre les stress dus aux métaux lourds et aux pesticides, ainsi que les stress provoqués par la présence simultanée de plusieurs facteurs de milieu à des conditions limites.
Par exemple, une température élevée et une salinité avec des teneurs en oxygène non optimales ont jadis provoqué un grave syndrôme chez les bars. La maladie se présentait avec un tableau clinique dénotant des troubles du métabolisme du calcium, des fractures osseuses, des pétéchies hémorragiques, le détachement du splanchnocrance du tronc et la mort des animaux.
L'addition au régime de fortes doses d'acide ascorbique a été suffisante pour faire régresser le syndrome susdit. Même là où cette maladie n'apparaissait pas, une augmentation de vitamine C dans le régime alimentaire permettait d'améliorer les conditions générales des poissons et le facteur de conversion de l'aliment. D'autre part, la réponse tissulaire aux stress aigus comprend la déplétion du glycogène musculaire et hépathique et de la vitamine C rénale et hépathique.
L'adoption d'un protocole d'analyses périodiques qui comprenne le contrôle, entre autres, de ces paramètres, sur des échantillons choisis au hasard, permettrait de déceler précocement un état général de stress chez les animaux élevés. Ces indicateurs non-spécifiques de stress pourraient ensuite s'accompagner d'enguêtes et d'analyses spécifiques telles que celles indiquées ici. La recherche dans ce secteur accomplit des progrès justement dans la tentative de dégager des indicateurs précoces et d'expérimenter les dits protocoles.
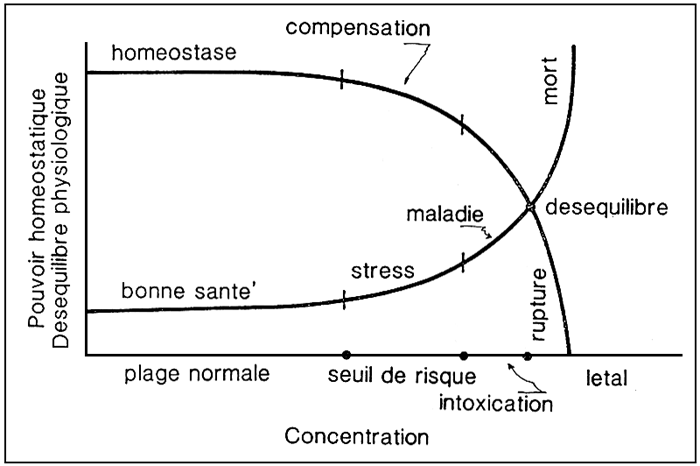
Figure 1. - Rapport existant entre concentration de l'agent stressant et conditions physiologigues. (D'après D. Calamari, 1976).
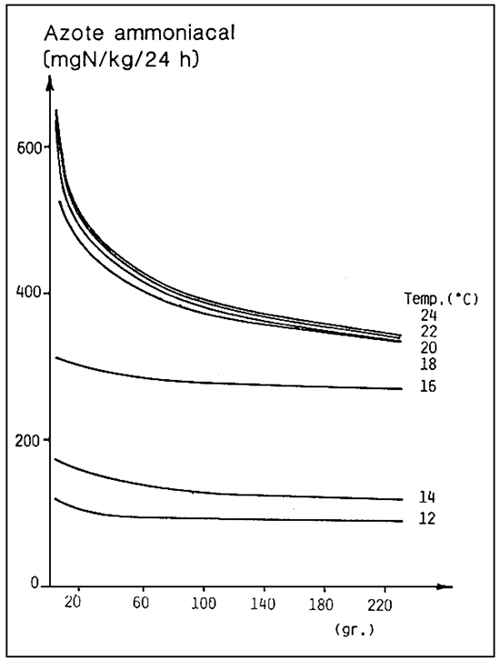
Figure 2. - Excrétion journalière d'azote ammoniacal en fonction du poids individuel et de la température de l'eau chez le bar (D. labrax). (D'après O.Guerin-Ancey, 1976).
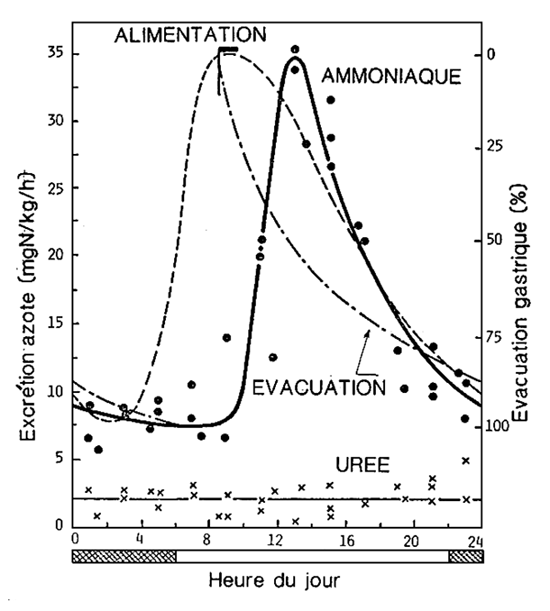
Figure 3. - Courbe journalière de l'excétion d'ammoniaque et d'urée chez les saumons (O. nerka). En pointillé, la courbe de consommation d'oxygène. (D'après J.R. Brett et C.A. Zala).
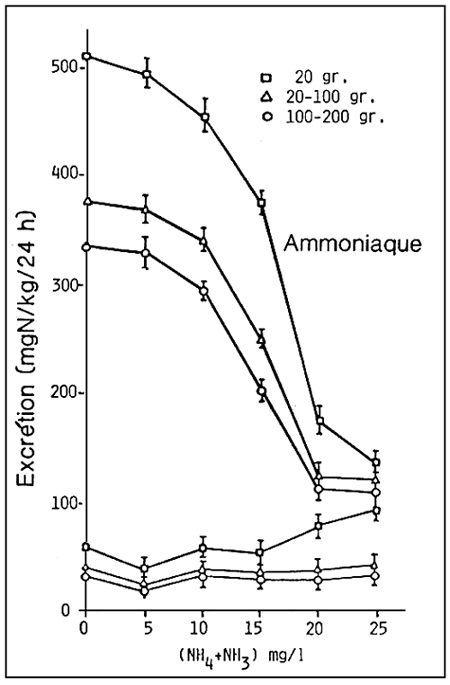
Figure 4. - Excrétion d'ammoniaque et d'urée en fonction de la concentration d'ammoniaque totale dans l'eau chez le bar (D. labrax) à différents stades de développement. (D'après O. Guerin-Ancey, 1976).
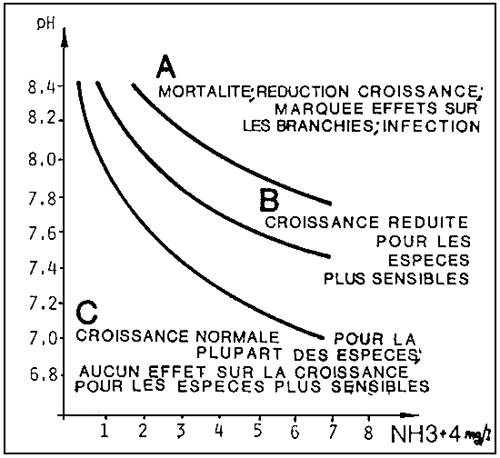
Figure 5.- Rapport entre ammoniaque totale et pH, à la température de 15°C, pour les niveaux de 0,02; 0,05; 0,1 mg/litre d'ammoniaque non ionisée. Les courbes sont valables dans l'intervalle 0–36% de salinité avec une approximation de 0,3 mg/litre d'azote ammoniacal total. (D'après G. Scarano, 1983).
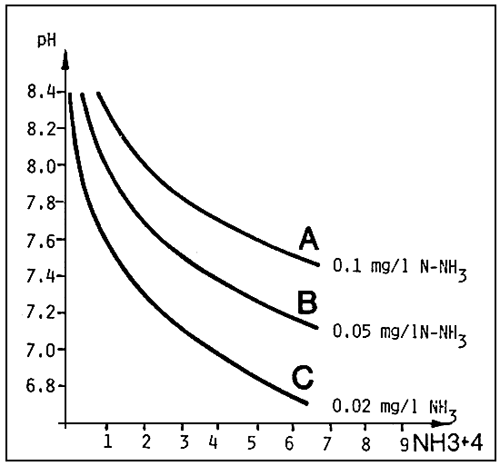
Figure 6. - Comme dans la figure 5, mais calculé pour une température de 25°C. (D'après G. Scarano, 1983).
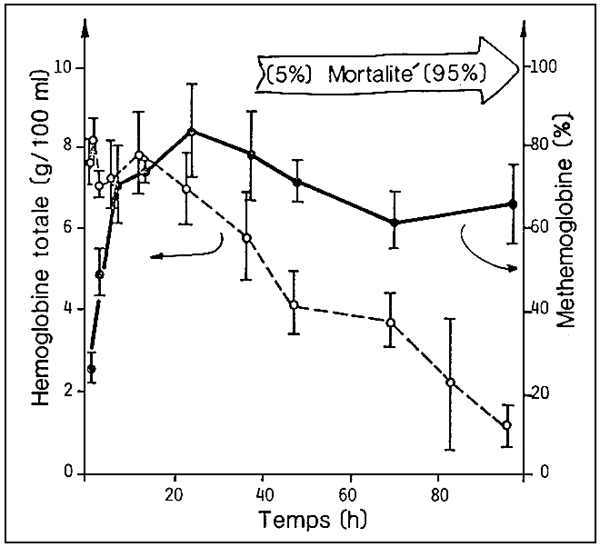
Figure 7. - Courbe dans le temps de l'hémoglobine chez le bar (D. labrax) pendant une exposition à une concentration létale d'azote nitreux. (D'après G. Scarano et al., 1984).
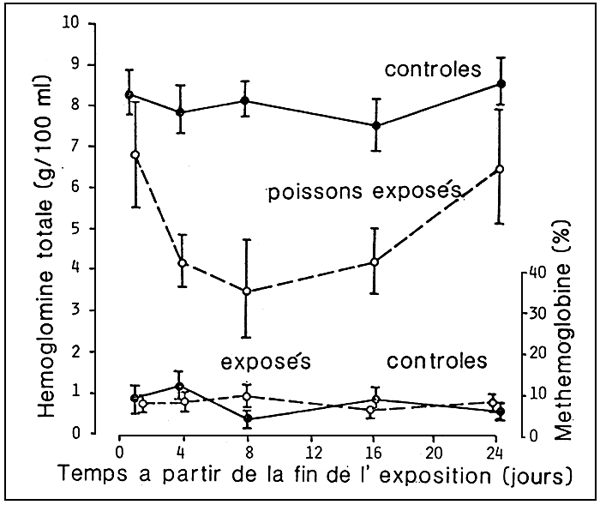
Figure 8. - Apparition d'anémie hémolytique chez le bar (D. labrax) suite à une bréve exposition à des concentrations létales d'azote nitreux. (D'aprés G. Scarano et M. Saroglia, 1984).
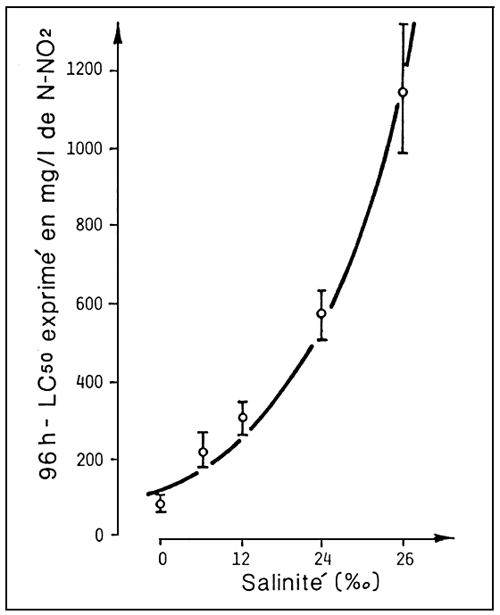
Figure 9. - Rapport entre salinité de l'eau et toxicité aiguë de l'azote nitreux chez l'anguille (A. anguilla). (D'après M. Saroglia et G. Scarano, 1984).
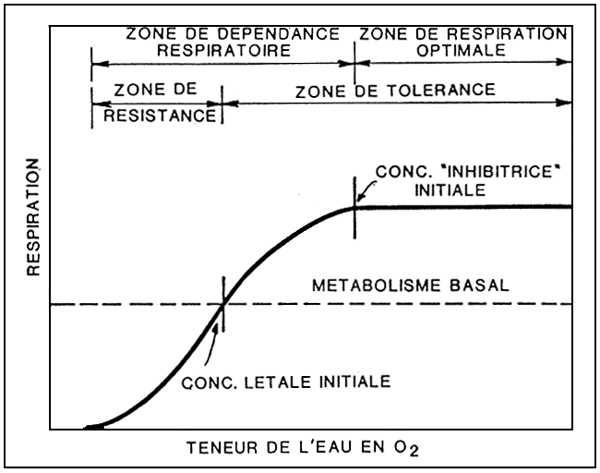
Figure 10. - Rapport entre disponiblité d'oxygène et respiration. (D'après W.S. Hoar, 1966).
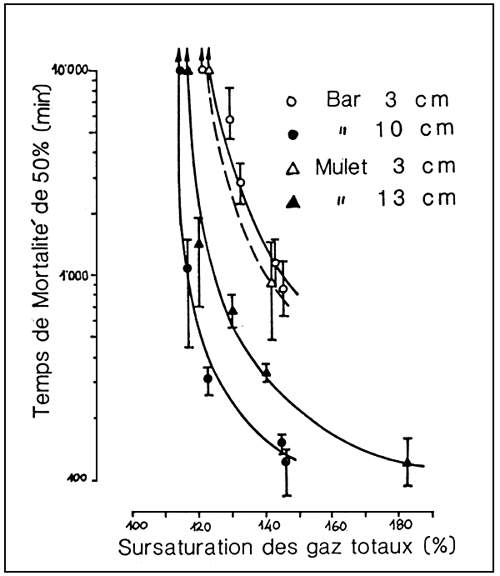
Figure 11. - Seuil de risque dû à sursaturation gazeuse chez le bar (D. labrax) et le mulet (M. cephalus) à différents stades de développement. (D'après R.H. Gray et al., 1984).