• PRINCIPAL DISEASES OF MEDITERRANEAN FIN
FISH CULTURE
BY J. MENEZES - PORTUGAL
• FISH DISEASE PROBLEMS IN THE WORLD
BY T. MATSUSATO
FAO VIA DELLE TERME DI CARACALLA,
00100-ROME ITALY
• STRESS AND THE AQUATIC ENVIRONMENT
BY C. AGIUS - MALTA
• PARASITES ET PARASITOSES DES POISSONS EN
CULTURE AU PORTUGAL
BY M. CARVALHO VARELA
CENTRO DE PARASITOLOGIA DA UNIVERSIDADE
TECNICA DE LISBAO/INIC, FACULDADE DE MEDICINA VETERINARIA, RUA GOMES FREIRE, P-1199 LISBOA
CODEX, PORTUGAL
M.P. CRUZ E SILVA
M. S. GRAZINA-FREITAS
LABORATORIO NACIONAL DE INVESTIGACAO VETERINARIA,
ESTRADA DE BENFICA, 701, P-1500 LISBOA,
PORTUGAL
• ASPECTS PATHOLOGIQUES DES POISSONS
D'ÉLEVAGE
BY T.DUARTE-PORTUGAL
• LES ÉPIZOOTIES EN CONCHYLICULTURE
BY H.GRIZEL
IFREMER - 56470 LA TRINITE SUR MER - FRANCE
• EPIDÉMIOLOGIE DES BIVALVES
BY H.GRIZEL
IFREMER - 56470 LA TRINITE SUR MER - FRANCE
• INTERRELATIONSHIP BETWEEN DISEASES AND
PRODUCTIVITY IN SHELLFISH FARMING
BY F.RUANO
INIP AV. DE BRASILLIA 1500 LISBOA - PORTUGAL
• NUTRITIONAL PATHOLOGY
BY G. SARVSIC - CROATIA
• LOGISTICAL PROBLEMS IN MEDITERRANEAN
FISH DISEASE SAMPLING AND LABORATORY
METHODS
BY C. AGIUS - MALTA
• REFERENCE COLLECTIONS ON PATHOLOGY,
DISEASE PREVENTION
BY M.HORNE
MILL OF KEIR HOUSE, DUNBLANE, PERTHSHIRE, FK15 9NS - SCOTLAND
• FISH DISEASES RESEARCH FUNDING AND
ORGANISATION THROUGH PRODUCERS
ORGANISATIONS AND TRADE ASSOCIATIONS
BY J.S.BUCHANAN
AQUATIC BIOSCIENCES CONSULTANT
THE OLD PARSONACE, ROSLIN MIDHOTHIAN
EH25 9LF - SCOTLAND
By M. J. MENEZE,
INIP, PORTUGAL
INTRODUCTION
Dr. Paperna stated in one of his papers, related to the Pathology of marine fin fishes,» in sea water culture systems can not rely on exising experience gained from salmonids and carp culture but also requires development of new knowledge relevant to the specific and unique aethiological and epizootological aspects of sea water systems and the fish species culture».
I agree with that statement and I think as almost all fish pathologists began by the salmonids pathological model tending to apply it in marine fin fish pathology it is necessary to consider its specificity. Anyhow it's unquestionable that the knowledge acquired in freshwater aquaculture pathology is the basis to enter in marine pathology, like Veterinary pathology on terrestrial animals is suitable to apply in aquatic pathology, if considering its specificity.
Firstly, marine fish are still are far completing their selective process of adaptation to culture life and we
yet know very few about its biology and behavior.
On the other hand let us remember that in the majority of Mediterranean countries, mariculture is
done by extensive and semi-intensive systems, using wild fry and broodstock, sometimes
associating that fry with artificial ones. Forgiving, for the moment, the risks for the natural
populations with the intensive use of wild fry, this peculiar way compel to the adequate manage of
health control. Those wild fish are carriers of potential pathogens in artificial conditions, that in
nature live together without damage. They are parasites, bacteria, fungi, etc already detected and
causing significant losses. Add to this the huge number of potential pathogens belonging to clear
normal aquatic microflora and microfauna, in all life stages or in larval ones.
The stress we submit animals through the captivity, high densities (compared with nature), handling, non suitable feed and feeding, etc debilitate them and they become an easy prey for those agents.
But we also must apply and amplify the impact of that particular specificities in intensive systems, in land based tanks or in floating systems.
If in aquaculture, as in any animal production, diseases control is a basic aim, specially the diseases
prevention, in mariculture it must be emphasized.
If therapeutic is feasible (but not advisable as routine in intensive systems, using land based tanks
in floating cages or in open culture it is very difficult and inpracticable.
For concluding my introduction let me then emphasize the need to deepen the research on marine fish pathology, focusing prophylaxis where is included which we call in latin language Medical Prophylaxis that means VACCINS and sera.
Following are referred diseases of economically important marine fishes in the Mediterranean region, references that were collected from 104 articles generated from ASFA 1978–1981.
The species concerned are: sea bass, Dicentrarchus labrax; gilthead sea bream, Sparus aurata; african sole, Solea senegalensis; grey mullet, Liza ramada; common mullet, Mugil cephalus. Include are also Atherina boyeri and Siganus canaliculatus.
Concluding diseases we have detected on sea bass, gilthead sea bream, african sole and mullets in Portugal.
SEA BASS (SB) GILTHEAD SEA BREAM (GRS) PATHOLOGY IN PORTUGAL
| Disease | clilnical picture | Etiology | Control |
| traumatic dermatitis (1) | skin congestivo haemorragic and necrotic lesions | opportunistic bacterial infection after traumatic manipulations | Furanotherapy (Antibiotherapy) long duration baths |
| Asphixia (2) | death with open mouth and operculum preceded by breathing at water surface | anoxia due to multifactorial origin | prevention |
| Acute bacteriosis | Ditto (1) plus ascytis visceral necrosis mly kidney and spleen | Flavobacterium Vibrio. Myxobacteria,Psedomonas | Antibiotherapy i m for breedors or by food |
| Gill and skin parasitos (4) | Dyspnea, congestivo haemorragic lesions, Parasites | Amloodinium, Tricho dina, Ichtryobodo, Ambiphrya, Crytocarion S. B :Diplectanum GSB:Microcotyle | Formalin Cu SO4 |
| SB Caligosis (5) | Ditto (4) | Caligus minimus | Formalin Trichlorfon |
| Body malformations (6) | Scoliosis, lodosis, cyphosis Swimbladder def. | hereditarial nutritional | |
| GSB visceral granulomatosis (7) | kidney hypertrophy visceral granuloma | nutritional? Spoiled raw (frozen) fish | fresh fish or pellets |
| GSB acute anemia (8) | Pale mucosae and viscera, fatty liver | lipid oxydation | Prevention |
| GSB lymphocystis (9) | Skin translucent, confluent nodules | Iridovirus | |
| GSB neoplasms (10) | odontoma mal. papiloma |
SOLE PATHOLOGY DETECTED IN PORTUGAL (J. Menezes)
| Disease | clinical picture | Etiology | control |
| nitrities intoxication (1) | Dyspena, skin (operculum, pelvic and analfins) an gill congestion | Increase of nitrities | Prevention |
| Acute anemia (2) | pale mucosae and viscera fatty liver | Lipid oxydation | Prevention |
| paragnathiosis (3) | Emaciation anemia | Paragnathia formica | 5 days quarantine |
| Traumatic dermatitis (4) | Skin congestivo-haemorragic lesion. | opportunistic bacteria infection | Furanotherapy |
PATHOLOGY OF MULLET IN PORTUGAL (J. Menezes)
| Disease | clinical picture | Etioogy | Control |
| Myxobolosis (1) | Cutaneous confluent whitish noduels | Myxobolus sp | |
| Pasteurel losis (2) | Visceral whitish nodules | Pasteurella sp. | |
| Paragnathiosis (4) | Emaciation anemia | Paragnathila formica |
By Toshihiko MATSUSATO
ITALY
The world harvest of cultured products in 1991 exceeded 14 000 000 metric tons of aquatic animals and plants. Aquaculture production has increased steadily in both absolute tonnage and as a proportion of aquatic products throughout the world. However, the production of major species in each country has shown increases and decreases which are attributable to several causes, especially disease.
As a result of the recent growth of intensive or semi-intensive aquaculture in the world, problems of fish diseases have occurred and became the most serious factor in obstructing sustainable development of the sector. The situation is especially serious in developing countries, where there is a risk of serious damage to national economies. Recently, many scientific activities related to fish pathology have been established, bur knowledge of fish diseases and techniques of fish health management differ markedly among the various regions. Damage caused by disease is estimated at about 10–20% of the value of total production from aquaculture. Further problems arise from the concern of industrialized countries, which are usually importers of aquaculture products from developing countries, as to possible contamination with hazardous chemicals and drugs used in disease prevention.
The promising future of aquaculture in the world may be stunted by the lack of disease control, especially in developing countries. To prevent this, training of scientists and technicians, establishment of diagnostic centres in developing countries and information exchange systems are needed.
Fish diseases must be combined with other aquaculture technologies, such as nutrition, genetics and environment, etc. Because of its worldwide involvement in fisheries and aquaculture, FAO is in a unique position to execute an international programme in support of fish disease diagnosis and treatment.
The increase in fish disease problems was noted and stressed at the International Conference on Aquaculture in the World (Kyoto, 1976), and the strengthening of cooperative efforts to resolve the problem has been a goal set by FAO i aquaculture.
Aquaculture projects, meetings of regional bodies such as EIFAC, IPFC and COSPESCAL, and intergovernmental activities under the aegis of OIE, NACA and AQUILA, have all dealt with aspects of fish diseases within FAO. Intergovernmental organizations such as SEAFDEC and non-governmental organizations such as ICLARM, have recommended activities aiming at mitigating the problem. The increase of target species for aquaculture, the widening of the aquaculture area and the diversification of aquaculture techniques have entrained a number of complications and made fish disease diagnosis more difficult; also, it should be borne in mind that fish pathologist have actually adapted to their field the techniques used in the medical and veterinary fields.
Why are modern aquaculture systems often so short-lived? Why do mass mortalities of cultured fish and shellfish occur? Are fish and shellfish diseases impossible to control, with the present level of knowledge and techniques at disposal? Can they be prevented at all? Fish pathologists will have to answer this question. However, the situation does not look too bright.
• There is a shortage of fish disease diagnosticians in the world. The number of active diagnosticians, in relation to the number of fish pathologists, is
| USA | 200 (30) |
| EEC | 200 (40) |
| Canada | 30 (10) |
| Nordic countries | 100 (20) |
| Japan | 300 (80) |
| China | 150 (30) |
| Other Asiancountries | 150 (40) |
| Far East | 10 (5) |
| African countries | 10 (5) |
| Latin American countries | 130 (5) |
• There is a lack of statistical data on fish diseases.
European countries, Nordic countries, Canada, USA, Korea (OR), Japan and some other
countries do have annual data on fish diseases for of the species cultured.
Examples follow for Norway (National Veterinary Institute), France and Japan (Fisheries
Agency).
Example 1, Fish Diseases in NORWAY, Diagnosis and Control, 1986–1988
With reference to our report of 1rst of December 1986 and later correspondance, we hereby send you
an updated review of the major important diseases registered in the period 1986–1988 at National
Veterinary Institute and the 4 regional State Veterinary Laboratories (Sandnes, Bergen, Trondheim
and Harstad). In addition to this, local veterinary laboratories have been involved in fish diagnostic
work, but we do not have the exact figures for their work.
It should also be added that the figures for 1988 is too small, as all information on the diseases
mentional was not available at the time when this report was written.
However the report gives an overall view and results of the fish disease control carried out by Norwegian governmental veterinary Laboratories.
As can be seen from the report, Viral hemorrhagic septicaemia (VHS, Egtved disease) has not been registered in Norway since 1974.
For your information, we also include a survey for fish viral investigations at the National Veterinary Institute in the last years.
1986
| No. Fish Examined | Diagnosis | Species (farms) | Source | File no's |
| Total No. Fish:27.573 | Furunculosis | Atlantic salmon, river Seatrout (Laerdalselva) | 3+1 | 6 |
| No. salmonids:26.888 | (A.salmoni-cida var.salmonicida) | |||
| No. other fish: | ||||
| Species: 500 | ||||
| No. different Fish species:23 | Vibriosis (V.ang.) | Atlantic Salmon, Rainbow trout, Plaice | 139 | 730 |
| No. formalinfixed: 4738 | Cold water Vibriosis «Hitra disease» | Atlantic Salmon, Rainbow trout | 59 | 553 |
| No. blood samples: 731 | Bacterial Kidney Disease (BKD) | Atlantic salmon | 12+1 river (Laerdalselva) | 105 |
| No. Ovarian fluid: 2365 | (Renibacterium salmoninarum) | Sea trout, Rainbow trout | ||
| Yersiniosis (Y. ruckeri) | Atlantilc Salmon | 14 | ||
| No. Bacteriological samples (plates): 58 | Mycobacterium infections | Macckrel, Aquarium fishes | 4 | |
| Winter ulccrs | Atlantic Salmon, Rainbow trout | 24 | 46 | |
| Clinical IPN | Atlantic salmon | 6 | 21 | |
| IPN virus | Atlantilc salmon, Rainbow trout | 325 | 682 | |
| Papillomatosis | Atlantic salmon | 2 | 12 | |
| Infectious anemia in salmon (ILA) | Atlantic salmon Atlantic | 7 | 7 | |
| Exophiala | Atlantic | 10 | 26 | |
| infections (Exophiala spp) | salmon | |||
| Whirling disease | Atlantic salmon, Rainbow trout Trout | 6 | 10 | |
| Proliferative kidney disease (PKD) | Atlantic salmon, Rainbow trout | 2 | 8 | |
| Ichthyobodiasis (I. necator) (freshwater) trout, Trout | Atlantic salmon, Rainbow | 56 | 143 | |
| Sea Water costiasis | Atlantic Salmon, Rainbow trout, Plaice | 32 | 35 | |
| Gyrodactyliasis (Gyrodactylus spp) | Atlantic salmon, Rainbow trout | 7 | 27 | |
| Eubothrium crassum | Atlantic Salmon, Rainbow trout | 107 | 186 | |
| Glochidie larvae | Atlantic salmon, Trout | 4 | 12 |
Egtved disease not registered.
Furunculosis:Stamping out procedures were carried out.
Whirling disease:Stamping out procedures carried out in affected sea water farms. No Export of fish to U.S. from these farms. Steps have been taken to ensure that fish raised in earthen ponds are not delivered fish farms in sea water.
Yersiniosis:Restrilcted movements and vaccination programme. Economic problems due to mortality small.
IPN: Only a few clinical cases.
The viral examinations and Myxobolus examinations were intensified during the years.
A disease characterized by anemia was recorded for the first time in late autumn 1984 in one fish farm on the South west coast of Norway, originally thought to be an atypical case of coldwater vibriosis, but medical treatment did not have any effect, The disease was also found in few farms in 1985 and the disease was recorded in several farms in 1986 and could be traced back to the original farm. No bacteria was detected in affected fish, but IPN virus have been detected in all affected farms.
Example 2. FRANCE
PATHOLOGIE PRESENTE DANS LES PISCICULTURES
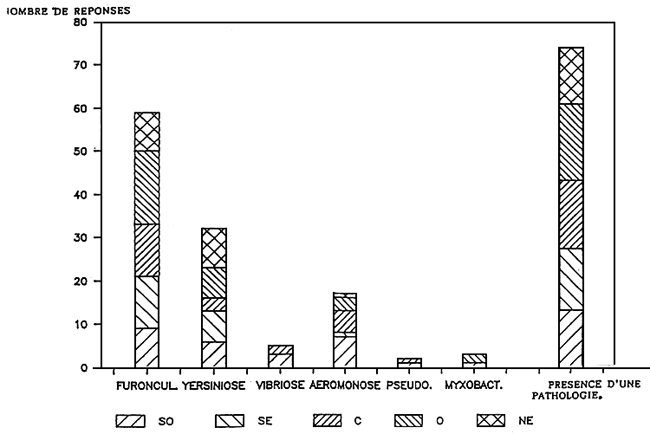
Example 3. JAPAN
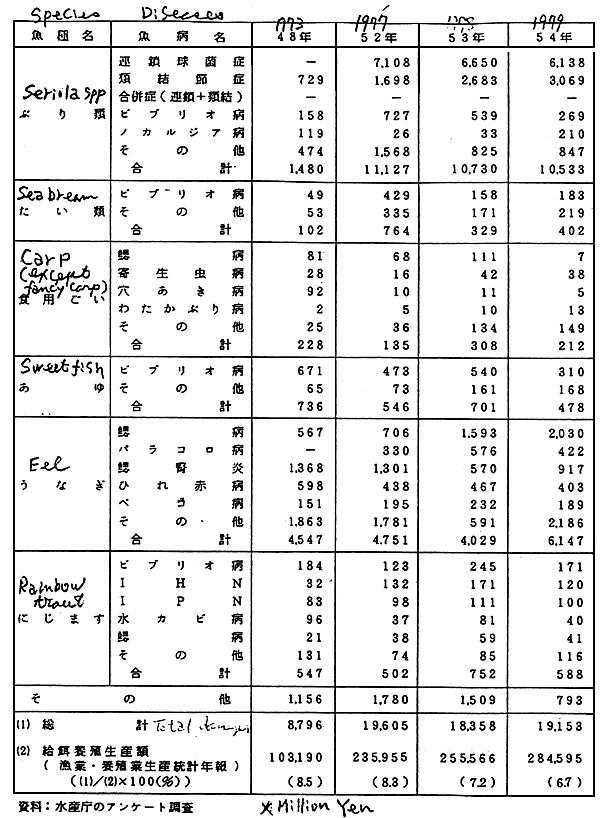
VALUE OF FISHERIES PRODUCT
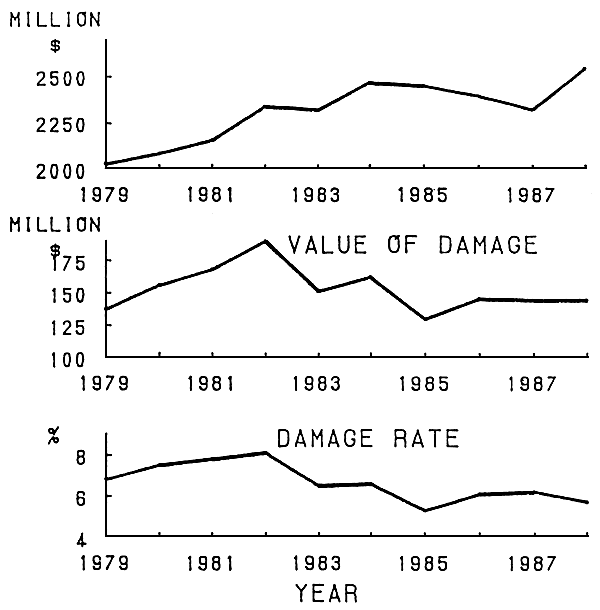
Fisheries production and economic losses induced by disease (Japan)
• An international database on fish diseases is taking. An Example of the FAO-OIE
| B056 | Leptospirosis | B312 | Psittacosis and ummosis | C854 | Avian spirochaetosis | |
| B057 | Q fever | B313 | Pullorum disease (9, pullorum) | C855 | Avian salmonellosis | |
| B058 | Rabies | (excluding Fowl typhoid-B30x and | ||||
| B059 | Paratuberculosis | Lagomorph diseases | C856 | Avian leucosis | ||
| (Cochliomyia hominivorax) | B351 | Myxomalasis | Dog and cat diseases | |||
| B352 | Tularamia | C921 | canine distemper | |||
| Cattle diseases | B353 | Viral haemorrhagic disease of rabbits | ||||
| B101 | Anaplasmosis | |||||
| B102 | Babesiosis | Fish diseases | ||||
| B103 | Bovine brucellosis | Fish diseases | C941 | Infectious dropsy of carps | ||
| (B. abortus) | B401 | Viral haemorrhagic septicaemia | C942 | Furunculosis of salmonids | ||
| B104 | Bovine genital | B402 | Infectious pancreatic neccrosis | |||
| campylobacteriosis | B403 | Myxobolosis (Myxosomiasis) | ||||
| B105 | Bovine tuberculosis | B404 | Spring viraemia of carp | |||
| (Mycobacterium bovis) | B405 | Infectious haematopoietic necrosis | ||||
| B106 | Cysticercusis (C, bovis) | B406 | Ilerpesvirosis of salmonids | |||
| B107 | Deruatatophilusis | B407 | Yersiniosis | |||
| B108 | Enzootic bovine leucosis | B408 | Renibacteriosis | |||
| B109 | Haemorrhagic septicaemia | B409 | Pseudomonosis | |||
| B110 | Infectious bovine | B410 | Pike fry rhabdovirosis | |||
| rhinotracheitis (IBR/IPV) | B411 | Herpervirosis of ictalurids | ||||
| B111 | Theileriasis | B412 | Branchionephritis | |||
| B112 | Trichomoniasis | |||||
| B113 | Trypanosomiasis | |||||
| B114 | Bovine malignant catarth | |||||
| Sheep and goat diseases | ||||||
| B151 | Brucella ovis infection | |||||
| B152 | Caprine and ovine brucellosis | |||||
| (B.melitensis) | ||||||
| B153 | Caprine****** | |||||
| B352 | TULARAEMIA | TULAREMIE | TULAREMIA | |||
| B353 | VIRAL HAEMORRHAGIC DIS RABBITS | MALADIE HEMORRAG VIRALE LAPIN | ENFERMEDAD HEMORR VIRAL CONEJO | |||
| B401 | VIRAL HAEMORRHAGIC SEPTICAEMIA | SEPTICAEMIE HEMORRAGIQUE VIRALE | SEPTICAEMIA HEMORRAGICA VIRALE | |||
| B402 | INFECTIOUS PANCREATIC NECROSIS | NECROSE PANCREATIQUE INFECT | NECROSIS PANCREATICA INFECC | |||
| B403 | MYXOBOLOSIS (MYXOBOLOSIS) | MYXOBOLOSE (MYXOSOMOSE) | MIXOBOLOSIS | |||
| B404 | SPRING VIRAEMIA OF CARP | VREMIE PRINTANIERE DE CARPE | VIREMIA PRIMAVERAL DE LA CARPA | |||
| B405 | INFECT HAEMATOPOIETIC NECROSIS | NECROSE HEMATOPOIETIQUE INFECT | NECROSIS HEMATOPOYETICA INFECC | |||
| B406 | HERPESVIROSIS OF SALMONIDS | HERPESVIROSE DES SALMONIDES | HERPESVIROSIS DE SALMONIDOS | |||
| B407 | YERSINIOSIS | YERSIONOSIS | YERSIONOSIS | |||
| B408 | RENIBACTERIOSIS | CORYNEBACTERIOSE (RENIBACTER) | RENIBACTERIOSIS | |||
| B409 | PSEUDOMONOSIS | PSEDUOMONOSE | PSEUDOMONOSIS | |||
| B410 | PIKE FRY RHABDOVIROSIS | RHADOVIROSE | RHAABDOVIROSIS | |||
| B411 | HERPESVIROSIS OF ICTALURIDS | HERPESVIROSE DES ICTALURIDES | HERPESVIROSIS DE ICTALURIDAE | |||
| B412 | BRANCHIONEPHRITIS | BRANCIONEPHRITE | BRANCIONEPHRITIS | |||
| B451 | ACARIASIS OF BEES | ACARIOSE DES ABEILLES | ACARIASIS DE LAS ABEJAS | |||
| B452 | AMERICAN FOUL BROOD | LOQUE AMERICAINE | LOQUE AMERICANA | |||
| B453 | EUROPEAN FOUL BROOD | LOQUE EUROPEENNE | LOQUE EUROPEA | |||
| B454 | NOSEMOSIS OF BEES | NOSEMOSE DES ABEILLES | NOSEMOSIS DE ABELAS | |||
| B352 | B353 | B401 | B402 | B403 | B404 | B405 | B406 | B407 | B408 | B409 | B10 | B411 | B412 | B451 | B452 | B453 | B454 | |
| EUROPE | LEP | LEP | PIS | PIS | PIS | PIS | PIS | PIS | PIS | PIS | PIS | PIS | PIS | PIS | API | API | API | API |
| SWITZERLAN | - | + | + PnQ SpT* | + PnQ SpT* | + | ... | + PnQ SpT* | - | + | + | + | + | - | - | ++ PnQ SpT* | + PnQ SpT* | + PnQ SpT* | + |
| UK/CHANNEL ISLANDS | - 0000 | - 0000 | - 0000 | - 0000 | - 0000 | - 0000 | - 0000 | - 0000 | - 0000 | - 0000 | - 0000 | - 0000 | - 0000 | - 0000 | - 0000 | - 0000 | ||
| UK/GREAT Britain | - | - 0000 | - 0000 PQi* n1 | ++ te* | + te* | (+) Qi* | - 0000 PQi* n2 | - 0000 | ++ * n3 | + Qi* | - | - 0000 | - 0000 | - 0000 | ++ T n4 | + S* | + ST* | +++ T |
| UK/ISLE OF MAN | - 0000 | - 0000 | - Pte* | - P* | - Pte* | - Pt* | - Pte* | - Pte* | - Pte* | - Pte* | - * | - * | - * | - | - | - | + | |
| UK/NORTH IRELAND | - 0000 | - 0000 Qte* | - Qte* | - 0000 Qte* | - 0000 Q* | - 0000 Q* | - 0000 Q* | - 0000 Q* | - 0000 Qte* | - 0000 Q* | - Q* | - 0000 Q* | - 0000 Q* | + Qft tv | - | - QfN | + QfT tv | |
| YUGOSLAVIA | - | ++ QfQi S* | - | - | - | - | - | - | - | - | - | - | - | - | - QiT* | +++ QfQi S* | + QfQi * | +++ QiT* |
There is a lack of national fish-desease control systems
Outline of Fish Disease Control in Japan
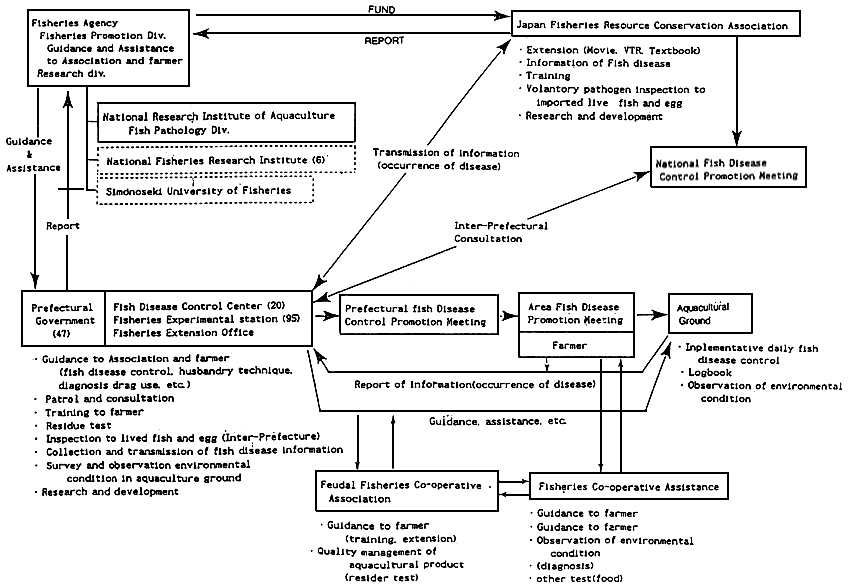
• It is difficult to apply quarantine in relation to fish diseases.
Quarantine regulations (Philippines)
All regulations pertaining to live fish importation and inspection are provided in FAO No.135. A duly accomplished Application for important shall be field at the BFAR at least 30 days prior to the arrival of the shipment. One of the conditions contained in this application is that the consignee will provide BFAR samples of the fish research purposes. Specially, the second to the last paragraph of the application form states:
«That the application shall provide BFAR sixty (60) live fish samples if the quantity of fish being imported exceeds six hundred (600) fishes. If the quantity of live fishes to be imported is less than six-hundred, then ten percent (10%) of the total quality will be provided to BFAR. These live fish samples are solely intended for research purposes on, fish parasites and diseases.»
The same condition is also embodied in the importation Permit to be issued by the BFAR Director Importation of the fish shall be effected upon issuance of this permit.
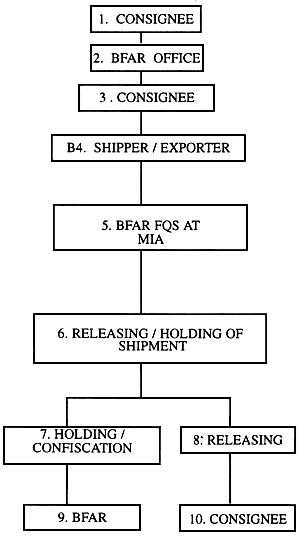 | 1. | Files application for fish importation |
| 2. | Issues permit to import | |
| 3. | Notifies shipper/exporter | |
| 4. | Ships the live fish | |
| 5. | Inspects/clears fish shipment : - Visual inspection of fish - Verifies/checks contents | |
| Administrative clearance of shipment by the BFAR FQS and Bureau of Customs | ||
| Prepare Inspectors Report (FQS) BFAR Fish Health Project representative gets live samples for research | ||
| 6. | Fish shipments is released or put on hold and/or confiscated by the Quarantine officer depending on technical and administrative findings | |
| 7. | Fishes infected/diseased or illegally imported are put on hold and/or confiscated | |
| 8. | Healthy and disease free fish are released to consignee | |
| 9. | Confiscated fishes are sent to BFAR for destruction or research | |
| 10. | Released fish go to consignee |
Figure 1. Shematic diagram showing the flow of live fish importation into the Philippine
• The number of chemotherapeutic agents and methods is limited.
• There are very few vaccines (only three serotype vaccines of Vibrio (V. anguillarum I, II and III).
| Chemotherapeutic agents | Route of administration | Dosage | Disease treated | Withdrawal time |
| Alkyltrimethyl ammonium calcium oxytetracyline | Oral | 50 mg/kg | Streptococcicosis | 20 days |
| Vibriosis | ||||
| Amoxicilline | Oral | 20–40mg/kg | Pscudotuberculosis | 5 days |
| Ampicilline | Oral | 5–50 mg/kg | Pseudotuberculosis | 5 days |
| Doxycline | Oral | 20–50 mg/kg | Streptococcicosis | 20 days |
| Erythromycin | Oral | 20–25mg/kg | Streptococcicosis | 30 days |
| Florfenicol | Oral | 10mg/kg | Pseudotubcrculosis Streptococcicosis | 5 days |
| Fumcquine | Oral | 20mg/kg | Pseudotuberculosis | 8 days |
| Josamycin | Oral | 30–50mg/kg | Streptococcicosis | 20 days |
| Kitasamycin | Oral | 80mg/kg | Streptococcicosis | 20 days |
| Lincomycin | Oral | 20–40mg/kg | Streptococcicosis | 10 days |
| Novobiocin | Oral | 50mg/kg | Pseudotuberculosis | 15 days |
| Oleandomycin | Oral | 25mg/kg | Streptococcicosis | 30 days |
| Oxytetracycline | Oral | 50mg/kg | Vibriosis | 20 days |
| Oxolinic acid | Oral | 10–30mg/kg | Pseudotuberculosis | 16 days |
| Sodium Nifurstyrenate | Oral | 50mg/kg | Pseudotubcrculosis | 2 days |
| Spiramycin | Oral | 25–40mg/kg | Streptococcicosis | 30 days |
| Sulfamonomethoxine | Oral | 100–200 | Vibriosis | 15 days |
| Sulfisoxazole | Oral | 100–200mg/kg | Paiusotulosis Vibriosis | 10 days |
| Tetracycline | Oral | 55–110mg/kg | Vibriosis | 10 days |
| Thiamphcnicol | Oral | 20–50mg/kg | Psedotuberculosis | 15 days |
chemiotherapeutic agents approved for the treatment of yellowtail in Japan
What is a desease of cultured aquatic organisms ?
• What is an anomaly ?
Technical problem
Average lifespan of shrimp culture ponds (after Fujimoto,1991)
| Area | System | Species | Climate | Water | Bottom quality | Initial density (pens/m2) | Food | Productivity (t/ha/year) | Harvest/year | Expected Lifespan of the farm | Present status | |
| Japan | 1 | Semi-intensive | Penaeus japonicus | Temperate | Sea water | Send | 20–50 | Pellets | 3–6 | 1 | >5 | Operational |
| 2 | intensive | - | - | - | - | 100–200 | - | 10–20 | 1 | >2 | Phasing out | |
| Taiwan | Intensive | Penacus | Sub-tropical | Brackish | Mud | 30–50 | - | 5–10 | 2 | >2 | - | |
| Philippines | 1 | Extensive | - | - | - | - | 0.3–5 | Fertilixers/raw material | 0.05–1 | 2 | >5 | Operational |
| 2 | Semi intensive | - | - | - | - | 6–15 | Pellets/raw material | 1–3 | 2 | <3 | - | |
| 3 | intensive | - | - | - | - | 15–30 | Pellets | 3–10 | 2 | <2 | Phasing out | |
| Thailand | intensive | - | Tropical | Sea water | - | 30–50 | Pellets | 5–10 | 1–2 | <1.5 | - | |
| India | 1 | Extensive | - | Sub-tropical | Brackish | - | 1.3–5 | Biofeeding | 0.05–1 | 1–2 | <6 | Operational |
| 2 | Semi intensive | - | - | - | - | 6–15 | Raw material/powder | 1–3 | 1–2 | <2 | - | |
| 3 | Intensive | - | - | - | - | 15–30 | Pellets/raw material | 3–5 | 1–2 | <3 | Beginning operations | |
| Indonesia | 1 | Extensive | - | - | - | - | 0.3–5 | Fertilizers | 0.05–1 | 2 | <5 | Operational |
| 2 | Semi intensive | 6–15 | Pellets | 1–5 | 2 | <3 | - | |||||
| 3 | Intensive | - | - | - | - | 15–3 | - | 3–5 | 2 | <2 | Phasing out | |
| China | Semi- | Penaeus | Temperate | Sea water | Mud-sand | 3–10 | - | 0.5–1 | 1 | <6 | Operational | |
| Ecuador | Semi-intensive | Penacus vanamei | Sub-tropical | Brackish | Mud | 3–10 | - | 0.715 | 2 | <3 | Phasing out |
By C. AGIUS
MALTA
STRESS
Stress can be defined as a condition produced by an environmental or other factor which disturbs the normal functioning to such and extent that the chances of survival are significantly reduced. In intensive fish cultivation, stress and stress responses are of imediate economic importance.
Whilst the aquatic environment and the poikilothermic (ie. cold-blooded) nature of fish are the major factors dictating disease processes, stress can alter the following balance in a number of ways.
ACUTE FORMS OF STRESS
These are normally associated with the routine hatchery procedures of grading, transportation and artificial stripping as well as nay sudden changes in environmental conditions. All of these almost invariably result in marked physicological stress responses with elevated plasma catecholamines and cortico-steroids.
CHRONIC FORMS OF STRESS
These are associated with intensive fish farming and include such factors as deterioration of water quality and the less obvious but equally important stresses of social interactions. In some cases fish rearing at very high stocking densities may exacerbate problems of social dominance, with submissive fish showing enhanced activity, reduced growth rate and increased susceptibility to infections. Tilapia species show some of these negative effects in culture. Overcrowding and water quality deterioration may increase the probability of disease by providing environmental conditions favourable to the survival and transmission of pathogens in the water. Moreover, stress may induce suppression of the immune system which could aggravate the situation as this increases the susceptibility to infection. Once stress exhausts the fish, skin and gut micro-organisms which are harmless to healthy fish may invade the host and cause disease. However, the presence of genuinely pathogenic micro-organisms is more likely to result in an outbreak of frank disease in stressed fish. This illustrates the need to exert caution in interpreting laboratory findings.
The maintenance of homeostasis (or a constant internal milieu) is dependent on a number of interacting environmental parameters. Note that it is normally sudden changes rather than the environmental parameters per se that are stressful.
TEMPERATURE
Fish are unable to sustain a body temperature different from that of the surrounding environment. Their body temperature therefore fluctuates with that of the environment. They have upper and lower thermal tolerance limits and optimum temperatures for feeding, food conversion, growth, spawning, egg incubation and disease resistance. These optimum temperatures may all be different. Moreover, because other factors such as oxygen solubility are temperature dependent, these optima may alter depending on other prevailing conditions. As the temperature departs from the optimum the fish's defence mechanisms weakens. In addition, with increasing temperatures
solubility of dissolved gases such as oxygen decreases; gases are even less soluble as salinity increases;
solubility of toxic compounds such as crude oil, pesticides and heavy metals increases.
SALINITY
Whilst fish like carp prefer fresh water. other thrive in a range of salinities. Salmon and eels spend part of their life in fresh water and the rest in salt water. Of the tilapias. Oreochromis aureus, O. spilurus and O. mossambicus are tolerant of high salinities whereas O. niloticus becomes susceptible at higher salinities. Fish are most at risk when fluctuations in salinity are sudden and of such magnitude that the gill and kidneys are unable to regulate the osmolality of the body fluids.
LIGHT
In intensive farming systems the light regime can be controlled. It is of particular relevance to sexual maturation and spawning as well as growth. Worth noting is the fact that in shallow intensive culture containers, ultraviolet light from excessive sunlight can cause sunburn on the dorsal surface of the head, lesions which could subsequently be invaded by opportune pathogens.
OXYGEN
In general, warm water species are more tolerant of low oxygen levels than temperate cold water species. In an intensive farming system, however, maintenance of optimal oxygen values is essential as sub-optimal availability impairs food conversion and growth rate as well as predisposing fish to disease.
CARBON DIOXIDE
In most natural waters, carbon dioxide levels do not exceed 6mg/litre and are dependent on pH,
temperature and the partial pressure of carbon dioxide in the atmosphere. With decreasing PH, the
proportion of free carbon dioxide increases. In intensive fast flow rearing systems where natural
plant productivity plays to significant part, the most significant source of carbon dioxide is fish
metabolism.
Increasing amounts of carbon dioxide depress fish respiration but provided the increase is not too
sudden some degree of acclimatisation is possible. It is probable that the minimum threshold
oxygen requirements of fish increase as carbon dioxide levels increase.
NITROGEN
Only one aspect needs be mentioned here, In intensive systems relying on pumped water supplies, air could be compressed with the water by the pumps resulting in greater solution of nitrogen (and oxygen) gases. This supersaturated water may cause gas-bubble disease (see later).
pH
pH is a measure of the degree of acidity or alkalinity and is measured on an arbitrary scale as follows:
| Acid | Neutral | Alkali | |||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
pH values change with salt content and temperature. In general fish are tolerant of a fairly wide range of pH values but 6.5 to 8.5 is the preferred range for a wide variety of species. Sea water has a much higher buffering capacity than fresh water because of its high carbonate alkalinity and borate ion content. This renders highly acidic or alkaline wastes, which are often highly toxic in fresh water, comparatively innocuous.
In water containing ammonium salts, increasing alkalinity causes greater concentration of undissolved ammonia, an extremely toxic molecule for fish (see next section). This is because of the following equilibrium reaction:
NH3 + H2O → NH4+ + OH-
Where fish are likely to be exposed to low pH waters, stops are taken to increase the pH by additions of lime.
AMMONIA
The free (undissociated) ammonia molecule is highly toxic for fish. The percentage of undissociated ammonia increases with increasing pH and temperature.
Below pH7 undissociated ammonia rarely poses a problem but above pH7 and especially in sea-water (pH7.8–8.2) its presence is always a potential threat to fish health. Levels above 0.01mg/litre are not recommended for seawater culture.
Intensively farmed fish fed on high protein diets produce high levels of ammonia as the main nitrogen-containing excretory product so that if alkaline or neutral water is being recycled without any treatment other than oxygenation, toxic ammonia build up may occur.
HYDROGEN SULPHIDE
This compound is commonly produced if sediments are present at the bottom of fish containers which allows for the development of anoxic conditions. Undissociated hydrogen sulphide is extremely poisonous for fish and should always be kept below 0.002mg/litre.
POLLUTION
The forms of pollution that could cause problems in the Arabian Gulf are:
Suspended solids such as shifting sand particles. These can damage the fine gill structure aswell as reduce light intensity and feeding activities. Fish usually survive short spates of such occurrences reasonably well.
Oil spills. These can ruin potential sites for aquaculture. Problem can be aggravated by the use of oil dispersants as these increase the toxicity for fish.
Sewage. This can result in poor water quality with reduced oxygen content, high toxic nitrite ion concentration and high phosphate and nitrate levels which could result in eutrophication with its attendant problems of oxygen depletion and toxin production.
Metals such as copper and iron. These can cause problems and may come from various sources, eg. industrial discharges and seepage from mining wastes.
Pesticides. These can come from various sources (eg. farms, industry) and can cause fish kills. At present little is known of the pathology caused.
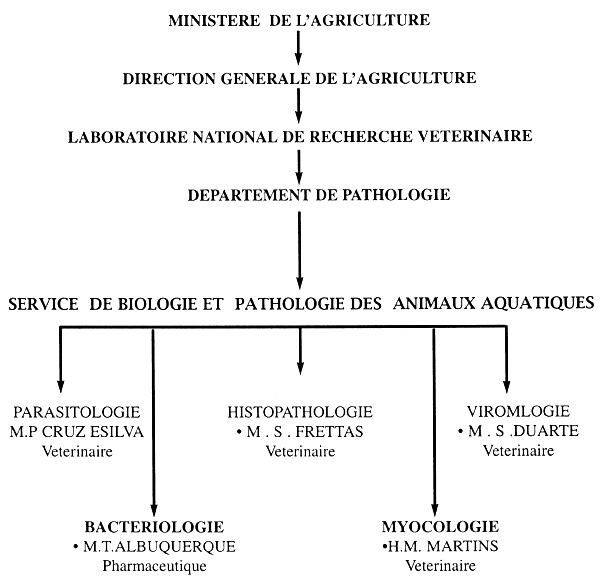
M. CARVALHO - VARELA - M.P CRUZ E SILVA
M.S GARAZINA-FREITAS
PORTUGAL
INTRODUCTION
L'ichthyopathologie marine est aujourd'hui champ nouveau de la pathologie, étant donné que jusqu'à quelques années, la pathologie des poissons marins était pratiquement inconnue et seule celle qui se référait aux poissons d'eau douce en systèmes de culture éveillait la curiosité des chercheurs.
L'importance que l'ichthyopathologie marine reçoit depuis les dernières années est due à notre avis, à l'accroissement qui se vérifie dans l'installation d'estuairine et mariculture, au profit des zones côtières st/ou reconversion d'espaces autrefois destinés à d'autre types d'exploration.
Une connaissance approfondie des infections parasitaires des poissons permet, à son tour, d'éviter et de controler le surgissement de cadres pathologiques potentiellement graves, direct ou indirectement pour la culture des espèces piscicoles, car les conditions confinées et de surpeuplement exaltent la diversité et l'intensité des infections parasitaires.
Il ne faut pas oublier non plus, que les études de la parasitofaune des animaux aquatiques nous fournissent d'abondantes informations sur ses hôtes.
Ayant présent que le cycle biologique d'un parasite est intimement lié à celui de son hôte, étant ainsi un indicateur philogénétique et écologique par excellence.
C'est ainsi que cette étude donne continuité aux travaux déjà présentés par les auteurs à niveau national et international (ALBUQUERQUE) et al., 1984, CARVALHO-VARELA, 1980; CARVALHO-VARELA et., 1983 a, b, 1984; 1989; CRUZ E SILVA et al., 1986; GRAZINA FREITAS et al., 1986; CARVALHO-VARELA & CUNHA-FERREIRA, 1987; CRUZE SILYA et al., 1989; CRUZE SILVA et al., 1990, GRAZINA FREITAS et al.,1992 (en publication)
MATERIEL ET METHODES
Cette étude a été commencée en Janvier 1980 et conclue en septembre 1992.
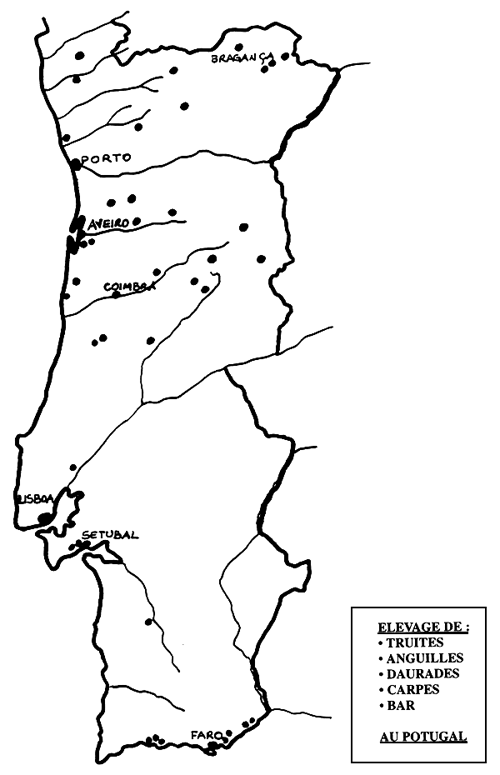
Les poissons marins sont provenus surtout de la côte du centre et sud du pays.
Les exemplaires d'anguiculture et de mariculture étaient originaire d'explorations industrielles au centre et sud du pays et de stations expérimentales officielles de la region de lisbonne (carte du portugal).
Les poissons, à l'arrivée au laboratoire, ont été soumis à un éxamen externe minutieux à l'aide d'un microscope stéréoscopique pour la recherche d'ectoparasites. On a excuté ensuite des frottis de peau suivis par l'observation au microscope optique. On a observé aussi les branchies, soit en frottis entre lame et lamelle, soit au microscope stéréoscopique.
Après la recherche d'ectoparasites on fait la nécropsie des animaux avec recueil de tous les organes en boite de petri pour observation au microscope stéréoscopique et pour examen histologique.
Les méthodes de. coloration utilisées pour éxamens parasitologique on été le Giemsa, Hermatoxiline-Eosine, Bleu de Méthylène et Nitrate d'Argent.
Pour les éxamens histopathologiques on a fixé les organes dans du formol à 10%, avec tampon phosphate, inclusions en parafine et coupes avec 5 micron d'épaisseur, colorations à l'Haemalumen de Mayer, Eosine de putt, «Alcian blue» et van Gieson.
Pour les cultures bacteriologiques on a utilisé les milieux TSA etb TSBS MERCK 10263, ainsi que le vibriostatique (0/129) associé avec des épreuves biochimiques.
RÉSULTATS
Dans les TABLEAUX I á III nous rapportons, par espèce piscicole, les parasites identifiés, leur prévalence et intensité d'infection en poissons de culture.
Les lésions macroscopiques et microscopiques les plus fréquentes ont été les suivantes:
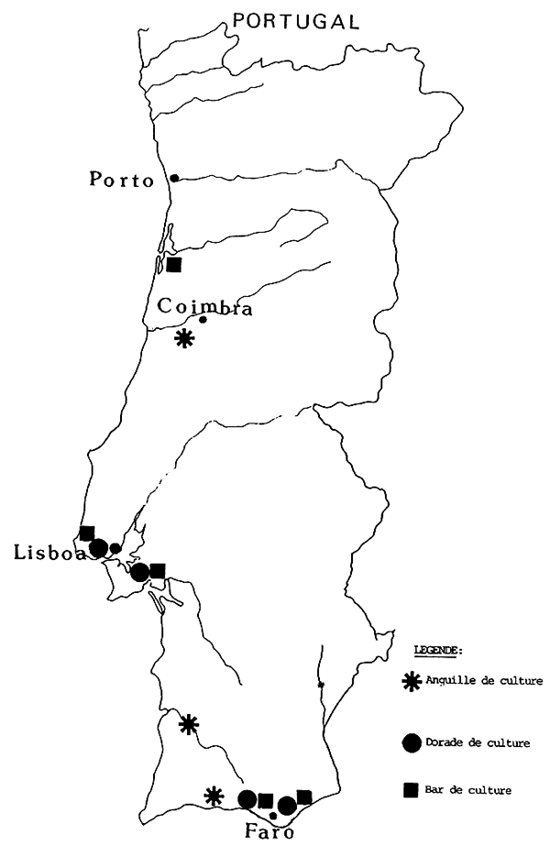
TABLEAU I
ANGUILLE EUROPÈENNE ADULTE (Anguilla anguilla)
(2366 animaux examinés)
| ESPÉCES PARASITAIRES | № ANIMAUX PARASITES PAR L'ESPÉCE | PRÉVALENCE (%) | INTENSITÉ D'INFECTION (MOYENNE) |
| PROTOZOA | |||
| CILIOPIIORA | |||
| Apiosoma sp. | 8 | (0.3) | +++ |
| chillodonella sp. | 87 | (3.7) | ++ |
| C.hexasticha | 27 | (1.1) | +++ |
| C.uncinata | 5 | (0.2) | + |
| Ichthyophthirius multifillis | 320 | (13.5) | +++ |
| Schyphidia sp. | 9 | (0.4) | +++ |
| Trichodina sp. | 571 | (24.1) | + |
| T.anguilli | 33 | (1.4) | ++ |
| APICOMPLEXA | |||
| Epieimeria sp. | 35 | (1.5) | + |
| SARACOMASTIGOPHORA | |||
| Ichthyobodo sp. | 192 | (8.1) | + |
| MYXOZOA | |||
| Myxidium giardi | 1533 | (64.8) | +++ |
| Myxobolus sp. | 8 | (0.3) | + |
| MONOGENEA | |||
| Gyrodactylus sp. | 391 | (16.5) | ++ |
| pseudodactylogyrus sp. | 853 | (36.1) | ++ |
TABLEAU II
DORADE ROYALE (Sparus aurata)
(248 animaux examinés)
| ESPÈCES PARASITAIRES | № ANIMAUX PARASITES PAR L'ÉSPÉCE | PRÉVALENCE (%) | INTENSITÉ D'INFECTION (MOYENNE) |
| PROTOZOA | |||
| CILIOPHORA | |||
| Trichodina sp | 19 | (7.7) | + |
| MONOGENEA | |||
| Dactylogyrus sp | 20 | (8.1) | + |
TABLEAU III
BAR COMMUN (Dicentrarchus labrax)
(476 animaux examinés)
| ESPÉCES PARASITAIRES | № ANIMAUX PARASITES PAR L'ESPÉCE | PRÉVALENCE (%) | INTENSITÉ D'INFECTION (MOYENNE) |
| PROTOZOA | |||
| CILIOPHORA | |||
| Cryptocaryon irritans | 1 | (0.2) | + |
| Tetrahymena sp. | 20 | (4.2) | + |
| Trichodina sp. | 12 | (2.5) | +++ |
| SARCOMASTIGOPHORA | |||
| Amyloodinium ocellatum (*) | 12 | (2.5) | +++ |
| DIGENEA | |||
| Diplectanum aequans | 1 | (0.2) | + |
- an niveau des branchies, les lésions provoquées par les ectoparasites se manifestaient essentiellement par hyperplasie, hypertrophie et nécrose des céllules épitheliales lamellaires et hypertrophie des céllules muqueuses;
- dans les anguilles de culture parasitées par Myxidium giardi on observait aussi des kystes parasitaires dispersés le long des lamelles branchiales;
- les dorades royales étaient densement infectés par epitheliocystes - «Cyst - forming chlamidia-like intracellular bacteria»-;
- dans la peau prédominait des ulcéres congestif-hemorragiques (bar commun) et la nécrose des céllules de l'épiderme;
- quant au lésions par endoparasites, elles apparaissaient essentiellement au niveau de l' intestine et se caratèrisaient par une entérite catarrhale ou par la capsulation de la forme parasitaire au niveau des villosités intestinales Myxidium giardi et Epieimeria sp.);
- la rate, la foie et le rein présentaient fréquentement dans l' anguille européenne, des spores de Myxidium giardi répandus parmi les organes ou enveloppés par une fine capsule de tissu conjonctif:
- les observations histopathologiques du foie des anguilles de culture mettaient toutes en évidence de la stéatose (à l'exception des anguilles récemment arrivées à l'exploration), indépendamment du type d' alimentation.
Dans le bar et la dorade infectés avec Vibrio on a observé des dêpots de hémossiderine dans la rate et le rein due à nécrose des céllules du tissu hématopoictique.
DISCUSSION ET COBNCLUSIONS
En ce qui concerne l' anguille européenne adulte Anguilla anguilla (TABLEAU 1), le nombre total
d' animaux de culture examinés (2366) nous permet déjà de considérer le pourcentage d' animaux
parasité (82.9%) comme significatif et de réelle importance en anguiliculture, surtout si intensive
Cette constatation, s' explique par les habitudes grégaires de l' espèce, les hautes densités de
population utilisées et l' usuelle présentation en pâte des aliments dans les anguilicultures
portugaises, ce qui favorise, la mauvaise qualité de l'eau des bassins. Treize espèces de protozoaires
ont été observées. parmi lesquelles prédominant les Ciliés, relativement aux autres groupes de
Protozoaires. Les espèces prévalentes ont été : Myxidium giardi Ichthyophthirius multifiliis et
Trichodina sp..
Le grand nombre d'animaux parasités par l' espèce M. giardi (1533) et la grande diversié d'organes
atteints peuvent avoir comme origine, à notre avis, la résistance transmise par les formes enkistées
de ce Myxosporidé. Les hautes prévalences et moyenne d'intensité d'infectionfs relatives aux deux
genres de Monogènes registrés Pseudodactylogyrus sp et Gyrodactylus sp de cycle biologique
direct, s'expliquent par les mêmes raisons citées à propos du parasitisme en général.
L'enregistrement récent du nématode Anguillicola crassus en anguilles d' eaux libres dans le région
d' Aveiro (CRUZ E SILVA et al., 1992) peut-être la cause d' importantes pertes economiques
dans la production intensive de l' anguille et dans le future survivance de cette espèce au niveau
international.
Les principales causes de la mortalité de la culture dans le sud de Portugal (TABLEAU II) sont d' origine parasitaire (Trichodina sp associés aux epitheliocystes-les deux se trouvant dans les branchies en infections moyennes. Les surtes epidemiologiques se montrent spécialement dans l' hiver, avec des températures très baisses des eaux et densités élevés du stock, en poissons de poids moyen de 15–20 grammes.
Dans le bar (TABLEAU III) les hyperinfections par dinoflagellés, Amyloodinium ocellatum, associés a ceux par Trichodina sp ont determiné de mortalités elevés dans les alevins. Nous pouvons confirmer la grande patogenicité de ce parasite pour cette espèce en cultures, dont les températures de l'eau sont très elévées (18–20° C).
CONCLUSIONS SYNTHÉTIQUES
Les résultants et leur discussions nous permettent de tirer les conclusions suivants :
Le nombre total d' anguilles de culture Anguilla anguilla examinées (2366) nous permet déjà de considérer le pourcentage d' animaux infectés par parasites monoxénes (82,9%) comme significatif et de réelle importance en anguiliculture, surtout si intensive Possibles explications :
Conditions écologiques eugenésiques du développement des parasites de cycle-biologique direct et niveau reproductif elevé sur et/ou l' intérieur de l' hôte.
Dans la dorade Sparus aurata en culture dans le sud du Portugal les ectoparasites sont essentiellement cause de mortalité, quand en association avec d' autres agents pathologiques ou de «stress».
Dans le bar Dicentrarchus labrax en culture les intensités d' infection par d' ectoparasites ont été elevés, et on rehausse la haute pathogenicité par le dinoflagellé Amyloodinium ocellatum.
BIBLIOGRAPHIE
ALBUQUERRQUE, M.T.F., DUARTE, M.T., GRAZINA FREITAS, M.S., MARINA MARTINS, H., PELETEIRO, C. & CRYZ E SILVA, M.P. (1984). Alguns aspectos sobre a Patologia da Enguia-europeia (Anguilla anguilla (L.)) e Truta-arco-iris (Salmo gairdneri RICHARDSON ) de cultura em Portugal. Publication «Seminario Aquacultura ENIPAPRH», 449–457;
CARVALHO-VARELA, M.(1980). Pathology in Aquaculture.Proc. Seminar JNICT/NATO Marine Sciences Panel, 241–250.
CARVALHO-VARELA, M;, CUNHA - FERREIRA, V., CRUZ E SILVA, M.P. MONTHEIRO, M.T. & GRAZINA FREITAS, M.S. (1983 a). Parasites and parasitosis in fish culture in Portugal. j. World Mariculture Soc., 12 (2), 9–14;
CARVALHO-VARELA, M., CUNHA-FERREIRA, V., CRUZ E SILVA, M.P. & GRAZI NA FREITAS (1983. Sobre a Parasitofauna da Enguia-Europeia (Anguilla anguilla (L.)) em Portugal. rep. Trab. LNIV, 16, 143–150;
CARVALHO-VARELA, M., CRUZ E SILVA, M.P., GRAZINA FREITAS, M.S. & CUNHA-FERREIR. v.(1984). Perspectivas actuais do controlo dos Parasitase Parasitoses na Anguilicultura Portuguesa, Publication «seminario Aquacultura INIP - APRH, 341 – 358;
CARVALHO-VARELA, M. & CUNHA-FERREIRA, V. (1987). Helminth parasites of the Common Sole,Solea solea, and Senegalese sole, Solea senegalensis on the Portuguese Continental coast; Aquaculture 67. 135–138;
CARVALHO-VARELA, M., CRUZ E SILVA, M, P., GRAZINA FREITAS FREITAS & CUNHAFERREIRA, V. (1989). Parasites et parasitoses des poissons en eau libre et en culture, Rés in :European Aquaculture Society, Special Publicaton, 10;
CRUZ E SILVA, M.P., GRAZINA FREITAS, M.S. & VENTURA, M.T. (1986). BINÒmio Patologia/Maneio na Anguilicultura Portuguesa. Rep. Trab. LNIV, 18, 41–47;
CRUZ E SILVA, M.P., CARVALHO-VARELA, M., PEREIRA DE CARVALHO, S. & GRAZINA FREITAS, M.S. (1989). Parasitoses dos animais aquàticos em estuarino e maricultura em Portugal. Resultados preliminares. Rés. «l Congreso Ibérico de Parasitologia», Caceres, Espagne, 92;
CRUZ E SILVA, M.P., GRAZINA FREITAS & CARVALHO-VARELA, M. (1990). Parasites and Parasitosis in European eel (Anguilla anguilla (L)) in Portugal, Res. in: Bull Soc, franç.. Parasitol., 8 (Supl), 287:
CRU E SILVA, M.P., GRAZINA FREITAS, M.S & CARVALHO-VARELA, M. (1992). First report of Anguillicola crassus in the European cel in Portugal. Bull. Eur. Assoc. Fish Pathol., 12 (5), 154–156;
GRAZINA FREITAS, M.S.; CRUZ E SILVA, M.P. &VENTURA, M.T (1986). Patologia de peixes marinhos-Casos estudados no Laboratorio Nacional de Investigaçao Veterinaria. Rep. Trab. LNIV, 18, 61–66;
GRAZINA FREITAS, M.S., CRUZ E SILVA, M.P. & CARVALHO-VARELA, M. (1992). Pathology of culture gilthead seabream and sea bass in Portugal. Seccion «Posters» «International Aquaculture Conference - 6a ACQUACULTURA'92, verona. Italie, 23–26 oct. (en publication);
LAUCKNER, G. (1984). Diseases caused by Protistans (algae). pp. 169–179, Kinne, o. (Ed.). Diseases of Marine Animal, 4 (1), 541 pp. Biologisch austalt Helgoland, Hamburg;
LEVINE, N.D., CORLISS, J.O., COX, F.E.G., DEROUX, G., GRAIN, J., HONIGBERG, B.M., LEEDALE, G.F., LOEBLICH, A.R ., LOM, J., LYNN, D., MERINFFELD, E.G., PAGE. EC., POLYANSKY, YU. L., SPAGUE, Y., VAVRA, J. & WALLACE, EG. (1980). A newly revised classification of the Protozoa, J. Protozool., 27, 37–58.
LOM, J. (1981). Fish invading dinoflagellates; A synopsis of existing and newly proposed genera. Folia parasitol. (Praha), 28, 3–11.
LOM, J. (19840. Diseases caused by Protistans. pp. 114–168. Kinne, o. (Ed.).Diseases of Marine Animals, 4(1), 541 pp. Biologisch Austalt Helgoland, Hamburg.
LOM, J. (19860. Protozoans infections in fish. Spec Publi - Eur. Aquacult. Soc. 9, 95–104.
By T. DURATE
PORTUGAL
TECHNICIENS DE LABORATOIRE
BACTERIES RENCONTREES CHEZ LES D'EAU DOUCE
| BACTERIES | ESPECES AFEECTEES | ||
| TRUITE | ANGUILLE | CARPE | |
| Acinetobacter calcoaceticus var.anitratus | * | ||
| Acinetobacter calcoaceticus var.lwoffi | * | * | |
| Aeromonas hydrophila | * | * | * |
| Aeromonas hydrophila hemolitica | * | * | |
| Aeromonas sobria | * | ||
| Alcaligenes sp. | * | * | |
| citrobacter freundi | * | * | |
| Diplococcus e b-hemoliticus | * | * | |
| Enterobacter aerogenes | * | * | |
| Enterococcus faecalis | * | ||
| Escherichia coll | * | * | |
| Flavobacterium sp. | * | ||
| Flexibacter sp. | * | ||
| Hafnia alvei | * | ||
| Klebsiella pneumoniae | * | ||
| Moraxella sp. | * | ||
| Plesiomonas shigelloides | * | * | |
| Pseudomonas acidovorans | * | ||
| Pseudomonas aeruginosa | * | ||
| Pseudomonas cepacia | * | * | * |
| Pseudomonas fuorescens | * | * | * |
| Pseudomonas maltophilia | * | ||
| Pseudomonas paucimobilis | * | ||
| Pseudomonas pickettii | * | ||
| Pseudomonas putida | * | * | |
| Pseudomonas putrefaciens | * | ||
| Pseudomonas sp. | * | * | * |
| Pseudomonas stutzeri | * | ||
| Pseudomonas vesicularis | * | * | |
| Salmonella arizonae | * | ||
| Vibrio parahaemolyticus | * | ||
ANALYSES EFFECTUEES DE 1982 A 1992
| Parasitologie | Histologie | Virologie | Bacteriologie | Mycologie | |
| 1982 | 30 | 44 | 24 | 6 | |
| 1983 | 28 | 92 | 30 | 3 | |
| 1984 | 195 | 203 | 54 | 7 | |
| 1985 | 2032 | 2480 | 155 | 28 | |
| 1986 | 1513 | 3678 | 145 | 13 | |
| 1987 | 674 | 2026 | 71 | 4 | |
| 1988 | 650 | 1877 | 22 | 37 | 12 |
| 1989 | 1244 | 2442 | 135 | 82 | 44 |
| 1990 | 603 | 970 | 24 | 44 | 2 |
| 1991 | 814 | 1258 | 63 | 32 | 4 |
| 1992 | 865 | 1163 | 1196 | 62 |
PARASITES RENCONTRES CHEZ LES POLSSONS D'EAU DE MER
| PARASITES | ESPECES AFFECTRES | |
| BAR | DAURADE | |
| PROTOZOAIRE | ||
Amyloodinium ocellatum | • | |
Cryptocaryon irritans | • | |
Tetrahymena sp. | • | |
Trichodina sp. | • | • |
| MONOGENEA | ||
Dactylogyrus sp. | • | |
| DIGENEA | ||
Diplectanum aequans | • | |
BACTERIES RENCONTREES CHEZ LES POISSONS D'EAU DE MER
| BACTERIES | ESPECES AFFECTEES | |
| BAR | DAURADE | |
| Pseudomonas fluorescens | • | |
| Vubrio damsela | • | |
| Vibrio parahaemolyticus | • | |
| Vibrio vulnificus | • | • |
PARASITES RENCONTRES CHEZ LES POISSONS D'EAU DOUCE
| PARASITES | ESPECES | AFFECTEES | ||
| TRUITES | ANGUILLES | CARPES | ||
| SARCOMASTIGOPHORA | ||||
| Ichtyobodo sp. | • | |||
| Hexamita sp. | • | • | • | |
| Oodinium sp. | • | |||
| O. limneticum | • | |||
| APICOMAPLEXA | ||||
| Eimeria sp. | • | |||
| Epieimeria sp. | • | |||
| CILIOPHORA | ||||
| Kinetofragminophorea | ||||
| Chilodonella sp. | • | • | • | |
| C. hexasticha | • | • | • | |
| C. uncinata | • | • | ||
| Oligohymenophorea | ||||
| Apiosoma sp. | • | |||
| A. piscicola | • | |||
| Ichtyophtirius multipliis | • | • | • | |
| Epistylis | • | |||
| Trichodina sp. | • | • | • | |
| T. anguillae | • | |||
| T. reticulata | • | |||
| Trichodinella | • | |||
| Ambiphrya | • | |||
| MYXOZOAIRES | ||||
| Myxidium giardi | • | |||
| Myxobolus sp | • | |||
| Ceratomyxa sp. | • | |||
| PLATHLMINTHES | ||||
| Monogenea | ||||
| Gyrodactylus sp. | • | • | • | |
| G. elegans | • | |||
| Dactylogyrus | • | • | • | |
| Pseudodactylogyrus anguillae | • | • | ||
BY H. GRIZEL
FRANCE
La conchyliculture est developpée dans plusieurs pays du monde, où elle fait l'objet d'une activité importante soit sous la forme de pêche sur les gisements de coquillages, soit sous la forme de culture.
Les grandes régions productrices de bivalves sont l'Amérique du Nord avec les Etats-Unis et le Canada. L'Asie avec le Japon et la Corée, l'Europe avec la France la Hollande et l'Espagne.
Tous ces pays ont connu à un moment de leur histoire halieutique des épizooties plus ou mois importantes et de durée variable. Chaque fois des études ont été entreprises pour déceler la cause de la maladie, comprendre son évolution et rechercher des solutions à la crise qu'elle engendrait.
Si dans la majorité des cas les mortalités ont pu être liées à la présence d'agents infectieux, plusieurs phénomènes sont restés sans explications réelles, les mortalités pouvant être imputées à des variations négatives du milieu, à de mauvaises conditions d'élevage ou encore à la non mise en évidence formelle de pathogènes. Il est très probable qu'une synergie des différentes causes avec effets en cascade soit en fait la bonne explication.
Les plus importantes épizooties répertoriées ont été causées par des virus, des bactéries, des champignons et des protozoaires. Des métazoaires appartenant au groupe des Crustacés ont également été reconnus à l'origine de maladies parasitaires. Enfin, récemment, des rickettsies ont été décrites en concomitance avec des mortalités de Mollusques, en particulier de bivalves fouisseurs.
1. EPIZOOTIES EN AMERIQUE DU NORD
Quatre principales maladies ont été décrites en Amérique du Nord depuis 1915, année au cours de laquelle de sévères mortalités ont été notées au Canada sur les côtes de l'Ile du Prince Edwards.
Cette maladie connue sous le nom de la maladie de Malpèque est rapportée par Needler et Logie (1947) sans qu'un agent causal ait pu être déterminé. De type contagieuse, elle s'est étendue entre 1915 et 1938 à la majorité des estuaires et baies de l'Ile du Prince Edwards qui est soumise à des conditions hydrologiques très variables. Les huîtres atteintes Crassostrea virginica, (Gmelin) présentent un arrêt de la croissance, une extrême maigreur de la masse viscérale, un muscle atonique et des pustules jaune-vert localisées sur différents organes.
Le pourcentage de mortalité varie de 10 à 90%. Entre 1934 et 1940, la production de la région du Queens est ainsi passée de 9 000 barils à quelques-uns seulement. Les mortalités apparaissent en général au mois d'août et se poursuivent au cours de l'automne.
La reconstitution des stocks a été entreprise à partir de 1957, en transférant dans de bonnes conditions des huîtres natives de l'Ile du Prince Edwards, où une population résistante s'est développée (Logie, 1958). Ces transferts vers les côtes du Nouveau Brunswick ont donné des résultats très encourageants (Logies et al., 1960; Drinnan et England. 1965; Drinnan, 1967). Depuis, la maladie est toujours présente à l'état endémique, provoquant des mortalités d'un taux supportable. Enfin, lors d'études plus récentes Rosenfield (1969) a envisagé une étiologie virale sans qu'elle puisse être confirmée.
En 1950, aux Etats-Unis, Mackin et al. au cours d'investigations découvrent un nouveau pathogène qu'ils nomment Dermocystidium marinum Décrit à l'origine dans la baie de Barataria en Louisiane. D. marinum s'est propagé dans le golfe du Mexique (Ray, 1966.a) où il a été signalé dans de nombreuses baies de Floride (Quick et Mackin, 1971). Dans le même temps, il est mis en évidence sur la côte atlantique dans les baies de Chesapeake (Hewatt et Andrews, 1954) et du Maryland (Dunnington, 1956).
Sensible aux basses températures et aux basses salinités, ce parasite ne se développe activement qu'à partir de 25°C, mais il prolifère dès 18°C pour des salinités supérieures à 15‰ (Andrews et Hewatt, 1957).
Les premiers stades infectieux (Mackin, 1951) sont localisés généralement au niveau de l'épithèlium intestinal, entrainant une réaction inflammatoire locale. La multiplication du parasite est accompagnée d'une dégradation des cellules épithéliales et de la destruction de la membrane basale. La propagation du pathogène aux autres tissus s'en trouve alors facilitée. Après cette phase critique caractérisée par une infiltration leucocytaire très importante de tous les tissus et par des abcès, les huîtres affaiblies meurent généralement au cours de l'été. D'après Quick et Mackin (1971) D. marinum serait la cause directe de 50 à 60% des mortalités annuelles relevées chez les populations d'adultes.
La mise au point d'une technique de culture sur milieu au thioglycolate (Ray, 1952) a permis à Mackin (1962) de réaliser des infestations expérimentales et à Perkins et Menzel (1967) et Perkins (1969, a) d'étudier en microscopie électronique les différents stades de son développement. L'induction de mortalités par D. marinum a été confirmée in situ (Andrews, 1965).
L'évolution des connaissances a entrainé la modification de la position systématique de ce parasite, rattaché par Mackin et Ray (1966) aux Labyrinthulales sous le nom de Labyrinthomyxa marina, Levine (1978) crée pour lui un genre nouveau Perkinsus marinus.
Parmi les nombreuses méthodes de prophylaxie proposées, seules celles en rapport avec les conditions de développement de P. marinus ont pu être utilisées avec quelques succès (Quick et Mackin, 1971). Cependant, les observations d'Otto et Krantz (1977), sur des souches de P. marinus adaptées aux basses salinités, limitent l'application de celles-ci. Par ailleurs, (Ray 1966, b et c) a défini une sensibilité de ce champignon à des antifongiques et à des antibiotiques, notamment au cycloheximide, sans qu'une thérapie puisse être appliquée.
Récemment, des mortalités constatées chez des moules Mytilus edulis, dans la baie d'Ascumpeque à l'Ile du Prince Edwards (Canada), ont été attribuées également à la présence d'un Perkinsus sp. (Li et Clyburne, 1979). Concomitamment à l'évolution de P. marinus, deux Protozaires appartenant aux Haplosporidies ont été mis en évidence chez des huîtres creuses, C. virginica, subissant d'importantes mortalités.
Signalé à l'origine dans la baie de Delaware (Haskin, (1958) in Andrews et al. 1962), sous le générique de Seaside organism (S.S.O.), ce parasite nommé Minchinia costalis par Wood et Andrews (1962a été retrouvé dans des eaux de salinité élevée depuis la Virginie jusqu'à Long Island Sound. Considéré un parasite endémique, la période de contamination par M. costalis est limitée à la période comprise entre les mois de mai et juillet (Andrews et al., 1962.
Les mortalités apparaissent au mois de mai de l'année suivant l'infection. Elles peuvent être alors supérieures á 50% selon le taux d'infestation. Les unicellulaires initiaux sont localisés précocement dans les tubules digestifs.
A partir du mois de mars suivant, les plasmodes se développent dans les hémocytes et dans le tissu conjonctif où ils donneront de nombreuses spores visibles dans les tissus des huîtres mourantes (Andrews et Castagna, 1978). L'étude de la sporulation en microscopie électronique a été faite par Perkins (1969, b).
L'autre Haplosporidie a fait l'objet d' une importante littérature. Observé dès 1957, dans la baie de
Delaware (Haskin.1961), ce parasite nommé Minchinia nelsoni par Haskin et al.
(1966) s'set propagé rapidement de la Caroline du Nord au Connecticut (Sindermann et
Rosenfield, 1967).
L'évolution géographique a été suivie le détail par de nombreux auteurs (Burton, 1963;
Andrews et Wood, 1967; Krantz et al., 1972; Ford et Haskin, 1982).
Le cycle de M. nelsoni semble être perturbé par des salinités inférieures á 10‰, le pourcentage d'huîtres parasitées diminuant alors de manière significative (Andrews, 1964; Sprague et al., 1969; Haskin et Ford. 1982; Andrews, 1983). La périodc d'infestation, comparable à celle de M. costalis, se situe surtout au mois de juin (Couch et Rosenfield, 1968; Farley. 1985; Ford et Haskin, 1982).
Les différents stades de développement (Farley, 1967) sont localisés, selon l'importance de l'infestation, dans le tissu conjonctif interstitiel ou également dans les épithéliums des palpes, des branchies et des diverticules digestifs (Couch et al., 1966; Farley, 1968). L'étude en microscopie électronique a réalisée par Perkins (1968).
Les mortalités occasionnées par ce parasite ont été très importantes dans certaines rivières. Ainsi, Haven et al . (1978) mentionnent M. nelsoni comme étant le principal facteur du déclin de la production huîtrière de Virginie, celle-ci étant passée de 3.5millions de boisseaux en 1954 à895,5 boisseaux en 1975.
Les modifications des cycles de culture proposées en tenant compte de l'impact de la salinité sur le parasite et du cycle de développement de M. nelsoni (Haven et al., 1978; Haskin et Ford, 1982) ont permis de pratiquer à nouveau, dans certaines rivières, la culture de C. virginica. Par ailleurs, Haskin et Ford (1979. 1982) ont noté la présence de populations d'Ituitres résistants à la maladie et présentant des mortalités nettement inférieures aux taux normalement relevés. Des expériences de Sélection avec ces souches sont en cours.
Nous signalerons enfin quelques cas de mortalités, qui, bien que ne revêtant pas un caractère épizootique peuvent être importants pour la compréhension de l'étiologie des maladies. Ce sont, en particulier sur la côte ouest des Etats-Unis, les mortalités survenues sur des élevages expérimentaux d'huîtres plates Ostrea edulis linné (Katkansky et. al., 1969 et les mortalités estivales de Crassostrea gigas Gmelin. à rapprocher de celles constatées au Japon (Glude, 1975 ; Koganezawa, 1975).
Par ailleurs, des observations plus récents ont permis de mettre en évidence, à Rhode Island, la présence de procaryotes en relation avec des mortalités massives de Placopecten magellanicus (Marti et al., 1982. Gulka et al., 1983).
2. EPIZOOTIES AU JAPON
La conchyliculture au Japon, pratiquée dans de nombreuses baies protégées, a pu, grâce ces caractéristique géographiques, développer des techniques originales de particulier les élevages sous radeau et en longues lignes.
Selon certains auteurs, cette, technique qui a induit un gain de croissance mais qui a également favorisé l'accroissement de la biomasse, serai une des causes indirectes des morttalités observées. Ainsi dès 1945, des mortalités massives de C. gigas se produisirent dans la baie d'Hiroshima, suite à pu à l'implantation des cultures en suspension (Koganesawa, 1975). Une étiologie microbienne n'a pu être retenue malgré les travaux de Takeuchi et al., (1960) qui suspectaient un bacille Achromobacter.
Les hypothèses et les conclusions les plus plausibles ont été formulées ultérieurement, lors des mortalités importantes survenues dès 1961 en baie de Matsushima. De nombreux travaux ont alors été réalisés en collaboration par plusieurs chercheurs dans différents voies complémentaires (Kan-no et al., 1965; Mori et al., 1965; Imai et al., 1965; Tamaté et al., 1965). Les principales conclusions sont reprises dans la note d'Imai et al (1968).
Les mortalités estivales de 1961 a 1964 ont été en moyenne de 50% par an, réduisant ainsi chaque fois de moitié la production de cette baie estimée à 1 456 tonnes en 1959.
Les huîtres atteintes présentent tout d'abord des lésions inflammatoires des diverticules digestifs et du tissu conjonctif. Celles-ci s'étendent et se généralisent aux oocytes qui se nécrosent. Les stades ultimes sont caractérisés par la présence d' abcès et par l'infiltration très importante d'amoebocytes.
Ces phénomènes ont été attribués à des désordres physiologiques et métaboliques due á une «overcroissance» et une «overmaturation» des gonades, résultant des températures élevées et de trop bonnes conditions de nutrition.
Des essais de transferts effectués avant le mois de juillet vers d'autres zones plus favorables ont permis d'abaisser les mortalités à moins de 10%, en particulier dans la baie ouverte d' Onagawa. Par ailleurs, des huêtres natives d'Hiroshima et transplantées en baie de Matsushima se sont montrées résistantes. Des essais de sélection ont été suggérés. Cette méthode a été reprise aux Etats-Unis par Beattie et al. (1980) pour tenter de résoudre des cas similaires de mortalités (Lipovsky et Chew, 1972).
Enfin, nous signalerons les mortalités survenues plus récemment dans le district de Sanriku sur des élevages de Patinopecten yessoensis. Elles seraient dues, d'après Mori (1975), á des dérèglements physiologiques résultant d'un mauvais de la reproduction lié à des conditions défavorables du milieu et de culture.
3. EPIZOOTIES EN EUROPE
La conchyliculture, implantée en Europe depuis fort longtemps, a traversé plusieurs crises dues pour la majorité à des maladies causées par des agents infectieux.
La plus ancienne épizootie affectant l'huître plate et relatée dans la littérature a eu lieu en France, en
Hollande et les côtes anglaises de 1920 à 1927.
Bien qu'aucun agent infectieux n'ait été réellement mis en cause, Orton (1924, a et b) décrit
plusieurs figures cellulaires anormales qui font penser á la présence de parasite intracellulaire. Au
cours de cette période la production est devenue quasiment nulle, les ostréiculteurs ayant dû se
reconvertir á d'autres métiers.
Antérieurement á cette crise, une maladie enzootique de l'huître plate connue sous le nom de maladie de la coquille (de Montauge, 1878) ou du pied, ou de la charnière , S'est propagée sur les côtes européennes atteignant la Grande Bretagne (Orton, 1924, a et b ), la France (Voisin, 1931) et la Hollande (Havinga, 1931).
Due au champignon perforant, Ostracoblabe implexa, décrit par Bornet et Flahaut (1889), cette maladie a provoqué des mortalités en particulier sur les gisement naturels d'huîtres (Korringa, 1947; Marteil, 1954).
le mycelium qui se nourrit aux dépens de la organique de la coquille est formé d'hyphes, donnant naissance à des prochlamydospores se transformant, à basse température, en chlamydospores . l'isolement et la culture d'O. implexa ont été réalisés par Alderman et Jones (1967 et 1971 qui ont aussi reproduit expérimentalement la maladie.
Les coquilles présentent initialement des ponctuations blanchâtres qui se réunissent en plage pour donner des formations verruqueuses colorées. Celles-ci provoquent des malformations de la coquille et entrainent un détachement du muscle lorsqu'elles sont situées à l'insertion, Les huîtres «baillent» et meurent (Alderman. 1976)
Cette maladie dont les foyers infectieux sont situés surtout dans les vieilles coquilles, a pu être stoppée dans sa progression par la mise en place de nettoyages systématiques, par la réglementation de l'utilisation de coquilles d'huîtres comme collecteur et en évitant les transferts de coquillages de zones parasitées vers des zones saines (Korringa, 1951, a ).
Les épizooties les plus graves ont en lieu à partir de 1966. Elles se sont succédées d'abord chez l'huître portugaise, C. angulata Lamark, avec la maladie des branchies de 1966 à 1969 et des mortalités massives de 1970 à 1973, puis chez l'huître plate avec l'apparition et le développement dès 1969 de la marteiliose puis en 1979de la bonamiose.
Les premiers symptômes de la maladie des branchies ont été observés par Trochon en 1966 chez les huîtres du bassin de Marennes-Oléron (Marteil, 1968).
Plusieurs étiologies parasitaires ont été avancées par différents auteurs. Besse (1968) envisage le rôle d'un Cilié. Alderman et Gras (1969) font des rapprochements avec P. marinus et enfin France et Arvy (1969) créent un genre nouveau Thanatostrea polymorpha pour un Protiste, proche des Labyrinthulales.
Ce n'est qu'en 1976, après une étude en microscopie électronique que Comps et Duthoit révèlent en fait une infection virale et décrivent des viroplasmes et des virions qui appartiendraient au groupe des Iridoviridae.
La maladie des branchies s'est étendue très rapidement en France à tous centres d'élevage, d'huîtres portugaises, à l'exception de l'étang de Thau (Marteil, 1969: Comps, 1983). Elle a également été signalée dès 1968 au Portugal et s'est propagée aux estuaires du sado et du Tage (Ferreira et Dias, 1973). Comps et Masso et (1978) notent sa présence à l'état endémique sur des gisement naturels du Sado et de la région de Cadix.
Les lésions branchiales ont été classées d'après le nombre d'ulcérations et le degré d'atteinte des feuillets branchiaux (Marteil. 1969). La description histologique des tissus lésés a été donner par Arvy et France (1968) et Comps (1969; 1970, a 1983). Les principales caractéristiques sont la présence d'infiltrations hémocytaires au niveau des nécroses , de cellules polymorphes de grandes dimensions contenant généralement les particules virales et de cellules brunes en nombre élevé.
Les taux de mortalités sont variables et progressifs. Ainsi, Deltreil (1969) note sur des lots expérimentaux, des pertes de 8% en juillet, 15% en septembre et 20% en novembre.
Les premières constatations de mortalités massives ont été faites au cours de l'été 1970 sur les élevages d'huîtres portugaises de la côte atlantique française, L'évolution de cette maladie a été suivie par Comps et Gras (1973) pour le bassin de Marennes, par Deltreil (1973) pour le bassin d'Areacon et l'estuaire de la Gironde. Comps (1983) donne des précisions sur les autres centres ostréicoles français. Cette maladie. a été retrouvée en 1984 sur un lot expérimental de C. angulata produit en écloserie et élevé en baie de Morlaix.
Tout comme la maladie des branchies, l'étiologie de cette maladie a suscité beaucoup de discussions et de polémiques et ce n'est qu'en 1976 que Comps et al. ont mis en évidence la présence de plages virogènes et de particules virales appartenant très probablement aux Iridoviridae.
Macroscopiquement la maladie ne s'exprime pas par des signes cliniques spécifiques. L'étude histologique révèle des infiltrations hémocytaires importantes dans les principaux organes de l'huître une multiplication des cellules brunes et la présence de cellules atypiques contenant des inclusions fuchsinophiles.
Les mortalités soudaines et importantes, ont provoque la destruction quasi totale des populations d'huîtres portugaises sur le littoral atlantique.
La mise en évidence de la résistance de C. gigas à ces maladies (Comps, 1972) a permis d'envisager le remplacement d'une espèce par une autre.
Marteilia refringens, décrit en microscopie électronique par Grizel et al (1974), a été trouvé à l'origine dans le bassin de Marennes-Oléron (Comps, 1970, b) et en Bretagne (Herrbach, 1971).
Un nouveau parasite, décelé dans un élevage d'huître atteint de mortalités à l'Ile Tudy au cours du mois de juin 1979, a été rapporté par Comps et al. sous la dénomination de parasite X, puis par Pichot et al. (1980(1979)) qui le nomment Bonamia ostrea.
L'étude des maladies dues à ces deux parasites sera développée ultérieurement.
Nous signalerons enfin, bien que ne revêtant pas un caractère épizootique, des atteintes parasitaires dues à Mytilicola intestinalis Steuer pouvant entrainer des mortalités, prinicipalement chez Mytilus galloprovincialis et M. edulis (Korringa, 1951, b).
Par ailleurs, nous noterons également la présence de Rickettsies associées à des mortalités de mollusques divers sans que leur rôle ait pu être mis en évidence (Comps et al., 1979; Comps et Raimbault, 1978; Joly et Comps, 1980) et nous retiendrons L'observation de mortalités estivales chez C. gigas dans les bassins d'Arcaahon (Maurer, 1982) et de Marenners-Oléron.