La détermination du niveau d'équilibre dans l'exploitation du lac de retenue et la prise de décision d'aménagement nécessaire pour assurer les récoltes optimales dans le futur exigent une connaissance profonde de la biologie des populations des poissons qui l'habitent. Cette connaissance ne peut être atteinte que par une étude approfondie concernant la structure des populations, le taux de croissance, les saisons et les lieux de reproduction, les régimes et les habitudes alimentaires des principales espèces.
La connaissance des phénomènes liés à la reproduction des poissons tropicaux présente un triple intérêt :
- l'étude de la dynamique des populations nécessite la connaissance d'un certain nombre de paramètres biologiques : taille de première maturité, fécondité par classe de taille) ;
- par l'étude des grandes fonctions biologiques, on peut espérer aborder les problèmes liés aux stratégies démographiques des espèces dans une optique évolutive ;
- le potentiel de la reproduction d'une espèce, les modalités et les conditions de frai ainsi que sa fréquence, le type d'oeufs pondus et le degré de soin apporté par les “parents” permettent de sélectionner les espèces intéressantes en matière d'élevage.
En Côte d'Ivoire, la reproduction des principales espèces de poissons d'eau douce a été étudiée de façon détaillée :
- Alestes baremoze (Paugy, 1978 ; Kouassi, 1978) ;
- Brycinus macrolepidotus (Paugy, 1982) ;
- Chrysichthys nigrodigitatus et Chrysichthys velifer (Kouassi, 1973) ;
- Schilbe mystus (Levêque et Herbinet, 1980) ;
- Petrocephalus bovei (Merona, 1980).
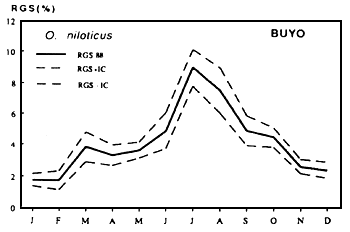
Certains aspects de la reproduction (taille de première maturité, période et lieu de ponte) ont été abordés par Planquette et Lemasson (1975) en ce qui concerne les peuplements de poissons du Bandama Blanc et par Traoré (1988) en ce qui concerne les peuplements du lac de Buyo, des retenues hydro-agricoles et des cours d'eau ivoiriens.
Ces études se sont focalisée sur trois principaux paramètres: le cycle reproducteur, la taille de première maturité et la fécondité des principales espèces de poissons capturées.
La maturation est un processus par lequel les cellules sexuelles primordiales évoluent en cellules mûres, prêtes pour la fécondation. On peut caractériser les principales phases évolutives des gonades à partir de trois types de critères qui sont d'ordre morphologique, pondéral et histologique :
- les critères morphologiques sont définis d'après l'observation macroscopique des gonades. Celle-ci porte sur la coloration, la consistance, l'importance de la paroi ovarienne, la forme et le volume occupé par les gonades dans la cavité abdominale :
- les critères pondéraux consistent à chiffrer l'accroissement des gonades durant le cycle sexuel. Les variations du poids des gonades sont presque toujours estimés par rapport à des paramètres tels que le poids corporel du poisson ; le Rapport Gonado Somatique (en abrégé R.G.S) est le rapport entre le poids frais des gonades et le poids du corps ;
- les critères histologiques permettent de mettre en évidence les étapes successives de la vitéllogénèse dans les ovaires.
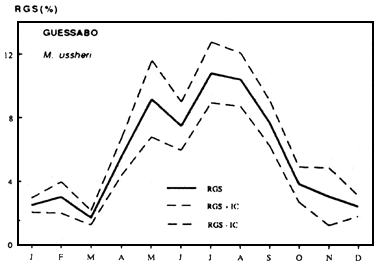
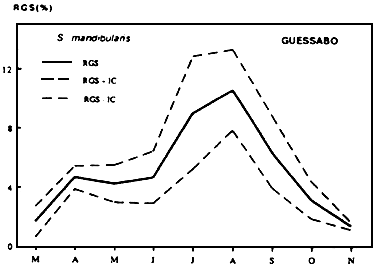
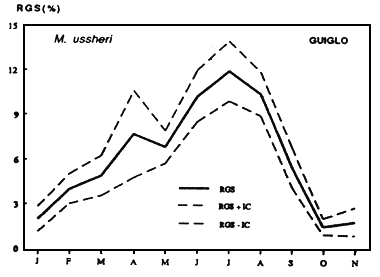
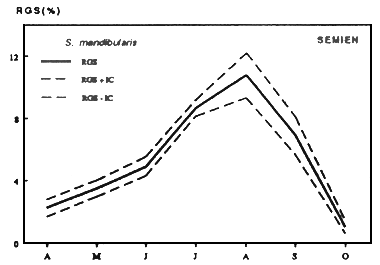
Le cycle reproducteur des principales espèces de poissons des plans d'eau ivoiriens a été étudié grâce au suivi l'accroissement du poids des gonades au cours de l'année. Cet accroissement a été matérialisé par l'évolution quantitative du rapport gonado-somatique des femelles de chaque espèce grâce à deux procédés complémentaires .
- Le pemier procédé a permis de mettre en évidence le cycle annuel des variations du R.G.S. de chaque espèce en construisant la courbe des variations des R.G.S mensuels moyens.
- Le second procédé a consisté à quantifier la maturation progressive des gonades au cours de l'année. Pour ce faire, les valeurs des R.G.S obtenues chaque mois ont été réparties en cinq catégories plus ou moins arbitraires :
- 0 % < R.G.S < 0,99 % pour les femelles immatures ou en repos sexuel ;
- 1 % < R.G.S < 4,99 % pour les femelles en maturation ;
- 5 % < R.G.S < 9,99 % pour les femelles matures ;
- 10 % < R.G.S < 19,99 % pour les femelles en maturation avancée ;
- R.G.S > 20 % pour les femelles en préponte.
Il ressort de ces études que d'une manière générale, les poissons d'eau douce de Côte d'Ivoire adoptent tois types de stratégies de reproduction :
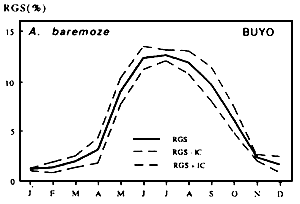
••• Pour la grande majorité des poissons, la reproduction est un phénomène cyclique limité à une courte période de l'année.
Pour les espèces concernées par ce cas de figure, le cycle reproducteur se caractérise par une courbe de R.G.S comportant deux principales phases ;
- une phase ascendante qui matérialise l'accroissement progressif du poids de la gonade durant la période de maturation. Cette phase débute généralement au mois de mai et s'achève en août–septembre où elle atteint son point culminant.
- une rapide phase descendante qui précède la phase de repos sexuel. Celui-ci commence au mois d'octobre, époque à laquelle bon nombre de femelles ont achevé leur ponte. Dans ce groupe, se retrouvent:
Certaines espèces de la famille des Characidae se reproduisent principalement en Juillet – Août – Septembre
Alestes baremoze
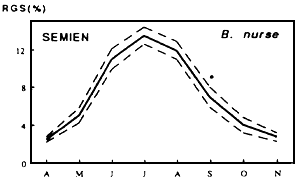
Brycinus nurse
Bryicinus longipinnis
la plupart des espèces de la famille des Mormyridae :
Marcusenius ussheri
Marcusenius furcidens
Marcusenius senegalensis
Petrocephalus bovei
Mormyrus rume
Mormyrops anguilloides
Ces poissons ont une période de reproduction bien limitée à quelques mois. Dans l'ensemble et par rapport aux autres familles, la reproduction est précoce, débutant pour plusieurs espèces en fin de saison sèche et se terminant en Juillet–Août, en pleine saison de pluie.
la plupart des espèces de la famille des Mochokidae:
Synodontis schall
Synodontis bastiani
Synodontis puntifer
Synodontis koensis
les espèces de la famille des Schilbeidae:
Schilbe mandibularis
Schilbe intermedius
la plupart des espèces de la famille des Cyprinidae:
Les Barbus ont généralement une reproduction très étalée dans le temps avec cependant une interruption en saison sèche (Décembre à Mars).Les Labeo, par contre, ont une période de reproduction plus étroitement limitée à l'époque de la crue maximale (de Juillet à Octobre).
• Chez les Mochokidae, les Schilbeidae et les Clariidae, la reproduction est limitée généralement à la période de crue, mais peut déborder cette période chez lesBagridae(figures 12)
Chez ces espèces donc, la reproduction coincide avec la crue dont le volume et la durée peuvent jouer un rôle important (figure 13). A une crue forte et durable doit correspondre un bon recrutement, alors qu'inversement, une crue annuelle déficitaire peut avoir des conséquences néfastes sur les stocks.L'influence de la crue est primordiale, puisqu'elle coincide avec la ponte et qu'elle peut, même dans le cas d'espèces à reproduction continue, correspondre à un pic de reproduction.
 |  |
 |  |
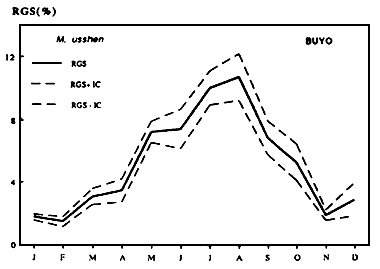 | 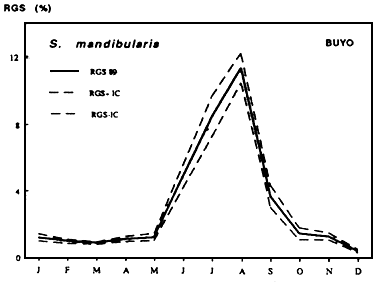 |
| Figures....: Cycle annuel des RGS de marcusenius ussheri | Figures....: Cycle des RGS de Schilbe mandibularis |
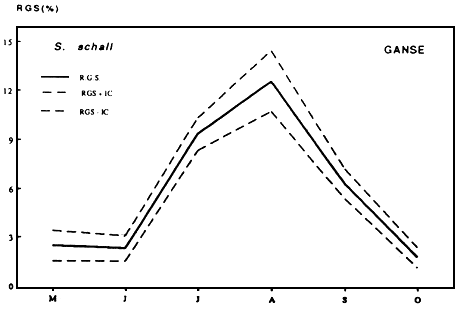
Fig. Cycle annuel du R.G.S moyen mensuel de S. schall
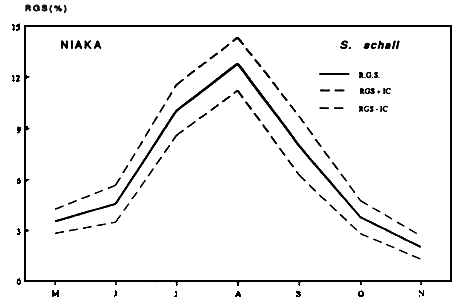
Fig. Cycle annuel du R.G.S moyen mensuel de S. schall
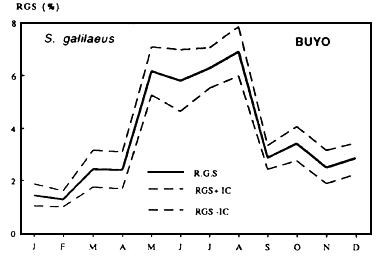
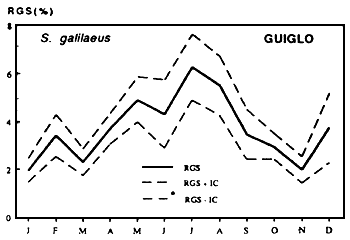
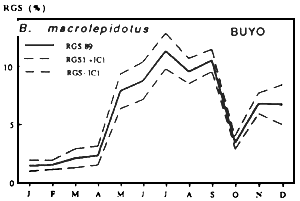
••• La seconde stratégie concerne essntiellement les espèces de poissons qui se reproduisent tout le long de l'année.
• Les Cichlidae sont dans l'ensemble en mesure de se reproduire toute l'année:
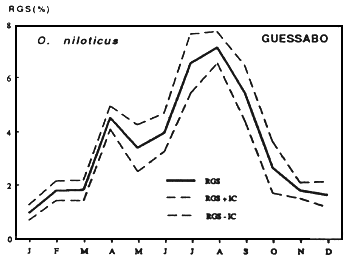
Oreochromis niloticus
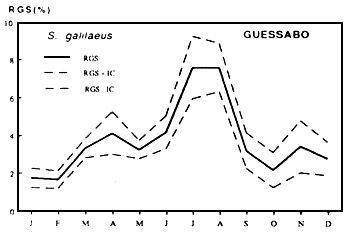
Sarotherodon galileaus
Tilapia zillii
Mias certaines espèces de Cichlidae semblent avoir une “préférence” pour la saison des pluies.Il s'agit de:
Hemichromis fasciatus,
Chromidotilapia guntheri
• Certaines espèces de Characidae ont une reproduction plus ou moins continue continue. Il s'agit de:
Hydrocynus forskalii,
Brycinus imberi,
Brycinus macrolepidotus
Le rapport gonado-somatique moyen (R.G.S) des femelles en maturation avancée varie suivant les espèces de 2 ou 5 % (Tilapia zillii) à plus de 20 % (Petrocephalus bovei, Brycinus nurse , Chrysichthys maurus par. exemple). Chez ces dernières espèces, dans certains cas particuliers, le poids des gonades peut atteindre et même dépasser le quart du poids total de la femelle pré-ponte (c'est le cas de Chrysichthys maurus capturé par les pièges-bambou). Peut ailleurs, entre les espèces d'une même famille, peuvent exister des différences de RGS considérables comme c'est le cas chez les Characidae, entre Brycinus nurse et Brycinus macrolepidotus, chez les Cyprinidae entre Barbus et Labeo, et chez les Cichlidae entre Hemichromis fasciatus et Oreochromis niloticus.
 |  |
 |  |
 |  |
| Figures....: Cycle annuel des RGS de deux espèces de Cichlidae |
 |  |
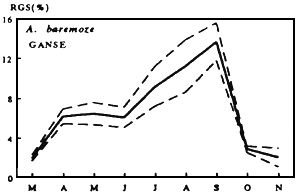 | 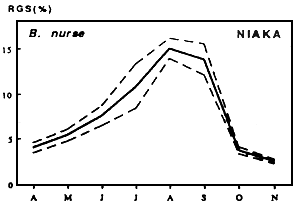 |
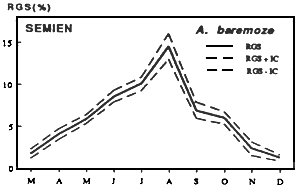 | 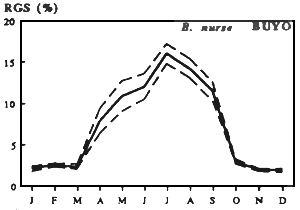 |
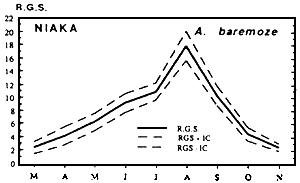 |  |
| Fig. Cycle annuel du R.G.S moyen mensuel de A. baremoze | Fig. Cycle annuel du R.G.S moyen mensuel de Characidae |
L'influence des facteurs de l'environnement sur la fonction de reproduction chez les poissons a été suivie en comparant les différentes phases du cycle reproducteur des principales espèces à ceraines variations des conditions de l'environnement Cette démarche a permis de montrer que la reproduction chez les poissons apparait comme un phénomène cyclique contrôlé en partie par les variations saisonnières de certains facteurs de l'environnement. En effet, chez les poissons à période de reproduction bien délimitée, le processus de ponte précède la période des hautes eaux pour les lacs et dévance la période de crues maximale dans les rivières.
Même si les auteurs s'accordent à reconnaitre que les mécanismes impliqués dans la chronologie des cycles reproducteurs sont très variés et prètent peu à la généralisation, force est de constater que cette chronologie est le résultat d'un compromis qui intègre de nombreux paramètres de l'environnement: pluie, variations des saisons hydrologiques, photopériode, température de l'eau, substrats de ponte, disponibilité de nourriture. Cependant l'hydrologie demeure le facteur le plus en vue (figures 14 et 15)
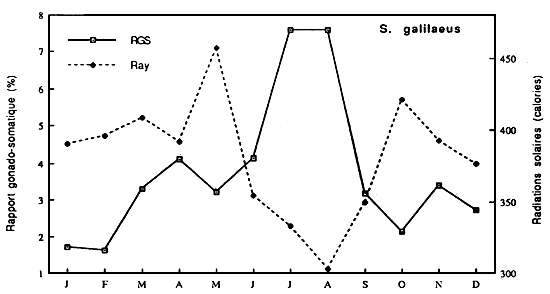
Fig...: Cycle annuel des radiations solaires à Guessabo et des RGS Sarothrodon galilaeus
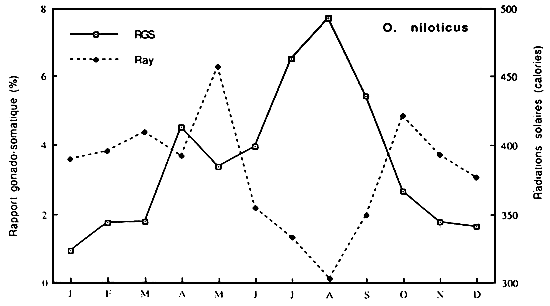
Fig...: Cycle annuel des radiations solaires à Guessabo et des RGS d'Oreochromis niloticus
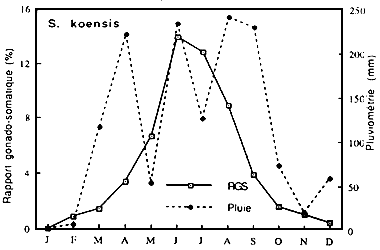 | 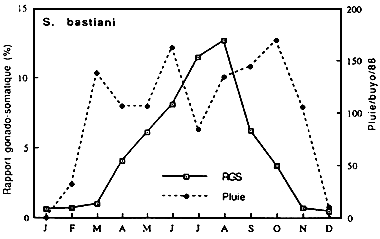 |
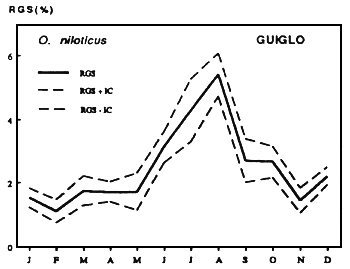
Fig...:Cycle annuel despluies à Guiglo et des RGS de Synodontis koensis | Fig....
Cycle annuel des pluies à Buyo
et des RGS de
Synodontis bastiani |
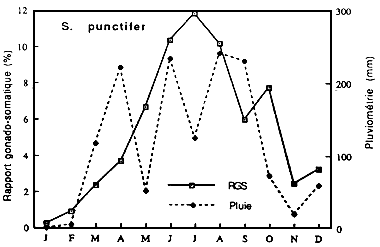 | 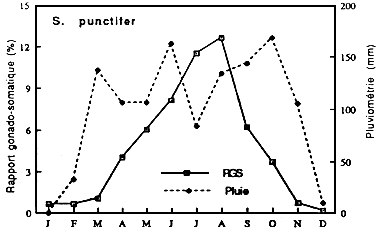 |
Fig..: Cycle annuel des pluies à Guiglo et des
RGS de Synodontis punctifer | Fig....: Cycle annuel des pluies à Buyo et des RGS de
Synodontis punctifer |
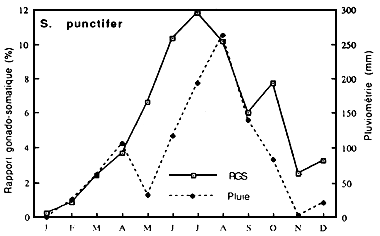 | 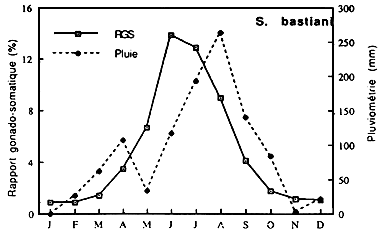 |
Fig..:
Cycle annuel des
pluiesà Guessabo et des RGS
de Synodontis punctifer | Fig..:
Cycle annuel des pluies
à Guessabo et des RGS de
Synodontis bastiani |
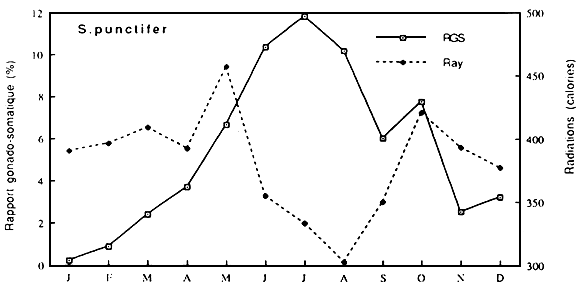
Fig..: Cycle des radiation solaires à Guessabo et des RGS de Synodontis punctiter
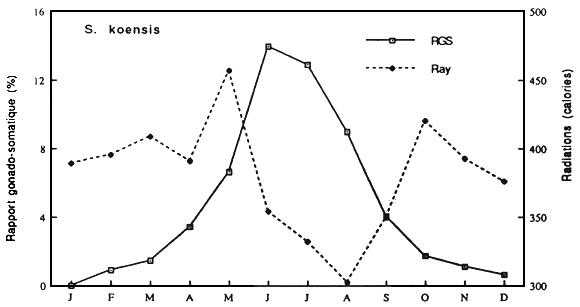
Fig..: Cycle annuel des radiations solaires à Guessabo et des RGS de Synodontis koensis
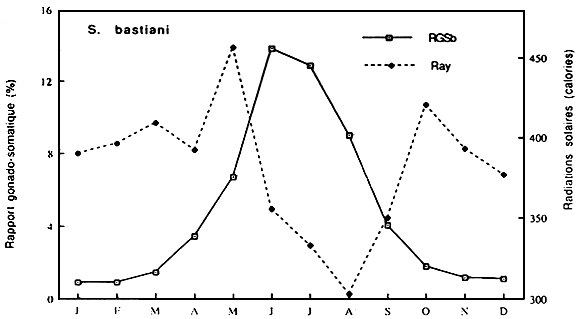
Fig..: Cycle annuel des radiations solaires à Guessabo et des RGS de Synodontis bastiani
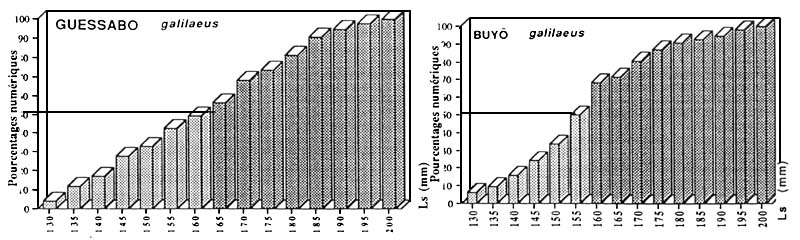
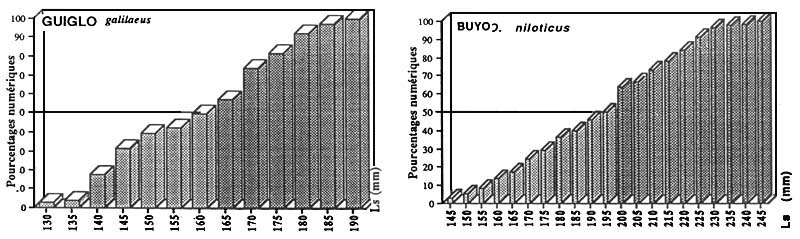
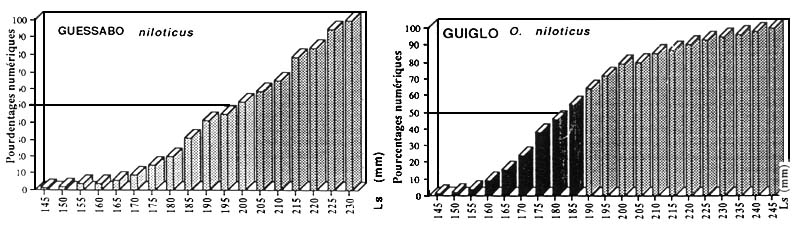
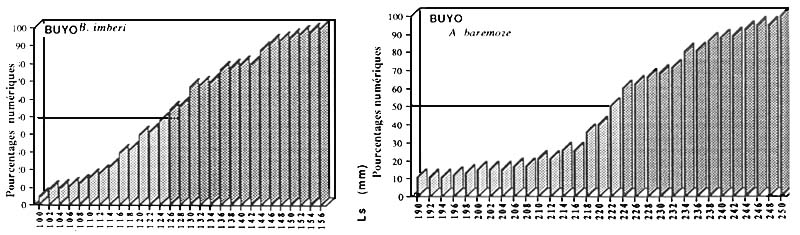
La maturité sexuelle est l'étape ultime du processus de maturation. Elle n'est possible que lorsque l'individu atteint une taille donnée. La méthode habituellement utilisée pour déterminer le dégré de maturité sexuelles des poissons est celle qui consiste à évaluer la taille de première maturité c'est à dire la L50 qui correspond à la taille à laquelle 50 % des femelles capturées en période de reproduction sont en maturation sexuelle avancée.
La connaissance de la taille de première maturité est importante dans la mesure où elle permet de choisir la maille de filet qui permet de préserver au mieux les juvéniles pour la survie des stocks.
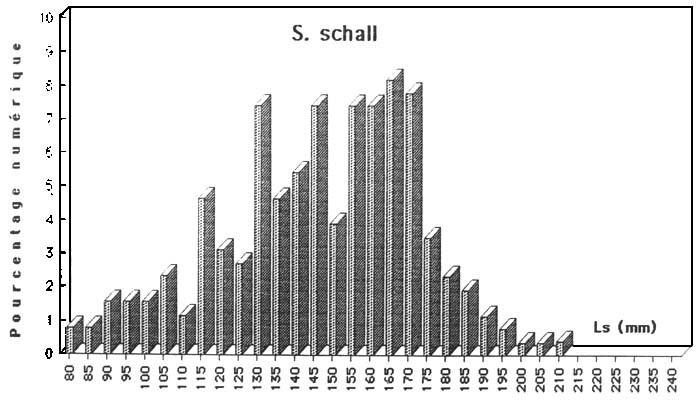
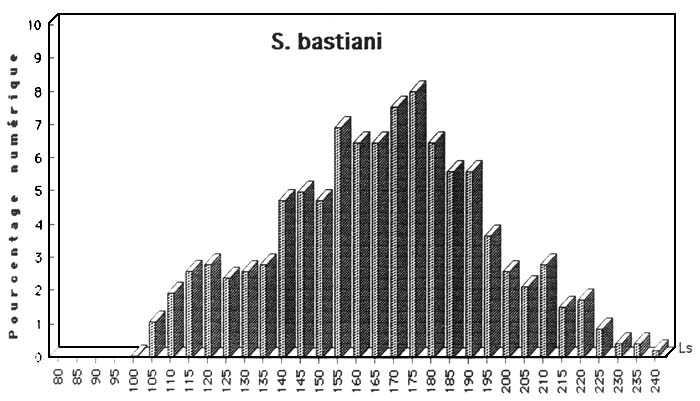
Ainsi, nous avons utilisé, pour chaque espèce, en période d'activité sexuelle maximale (R.G.S > 10 % pour la plupart des espèces et 5 % pour les espèces de la famille des Cichlidae) un lot abondant de femelles potentiellement fécondables et de toutes tailles. La longueur standard (Ls) de ces poissons a été mesurée et les sujets ont été regroupés par classe de taille de 5 mm pour les espèces grande taille et de 2 mm pour les plus petites. A l'intérieur de chaque classe de taille, le pourcentage des individus matures est estimé et les valeurs obtenues sont portées sur un histogramme dont l'axe des abscisses, représente les tailles (en longueur standard) correspondantes. Cette méthode permet de connaître la plus petite femelle en maturation avancée, la taille de première maturité et la taille à partir de laquelle tous les individus ont atteint leur première reproduction.
Pour les principales espèces, les tailles de premières matutité sont sont consignées dans la tableau 13.
Tableau 13 : Eléménts de reproduction des principalesespèces
| Espèces | R.G.S. moyens | Période de reproduction |
| Oreochromis niloticus | 2,6 | toutel année |
| Sarotherodon galilaeus | 2.1 | toutelannée |
| Tilapia zillii | 4,0 | toutel'année |
| Chrysichthys maurus | 16,2 | Saison de pluie |
| Chrysichthys nigrodigitatus | 19,5 | Saison de pluie |
| Alestes baremoze | 11.5 | Saison de pluie |
| Brycinus nurse | 19,5 | Saison de ploie |
| Brycinus macrolepidotus | 13,8 | Saison de plate |
| Brycinus imberi | 14,6 | Saison de plue |
| Synodontisschall | 13,6 | Saison de pluie |
| Schilbe mandibularis | 9,6 | Saison de ploie |
| Schilbe intermedius | 8.0 | Saison de ploie |
| Marcusenus ussheri | 15,3 | Saison de pluie |
| Petrocephalus bovei | 20,4 | Saison de pluie |
| Hemichromis fasciatus | 4,5 | Saison de ploie |
| Polypterus endlicheri | 9.2 | Saison de plue |
| Labeo coubie | 8,6 | " |
| Labeo parvus | 19,0 | " |
| Labeo senegalensis | 14.3 | " |
| Synodontis bastiani | 12,8 | " |
| Hydrocynus forskalii | 6,9 | " |
| Hepsetusodeo | 8,4 | " |
| Brycinus longipinnis | 13.5 | " |
| Mormyrus rume | 12 | " |
 | |
| Figure : Taille de première de sarotherodon galilaeus | |
 | |
| Figure : Taille de première maturité d'Oreochromis niloticus | |
 |
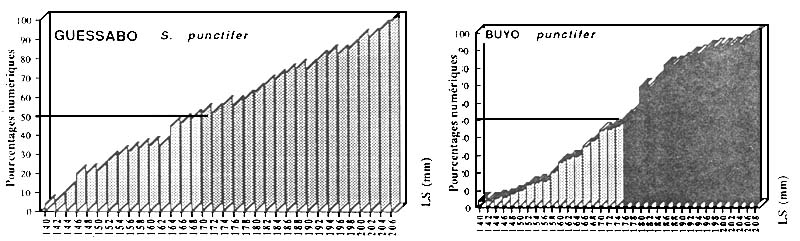 | |
| Figure : Taille de première maturité de Synodontis punctifer | |
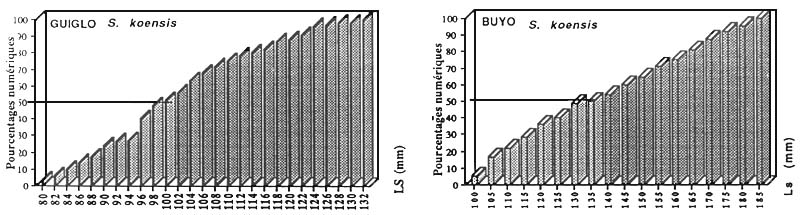 | |
| Figure : Taille de première maturité de Synodontis koensis | |
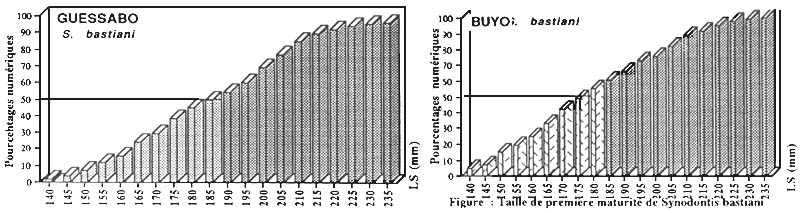 | |
| Figure : Taille de première maturité de Synodontis bastiani | |
 |
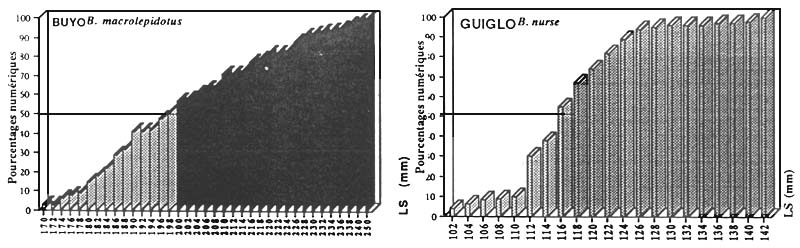 |
Figure : Taille de première maturité de quelques espèces de Characidae |
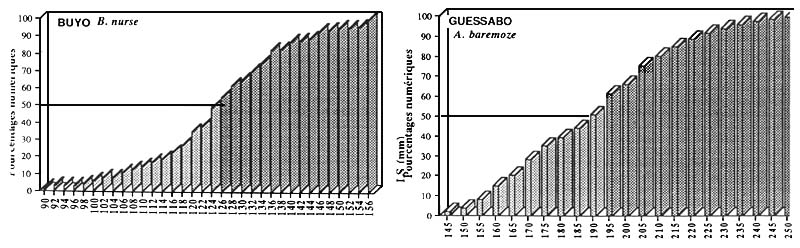 |
Figure : Taille de première maturité de deux espèces de Brycinus |
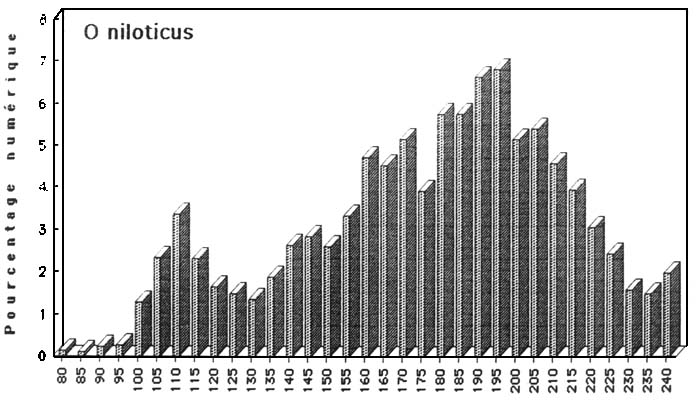
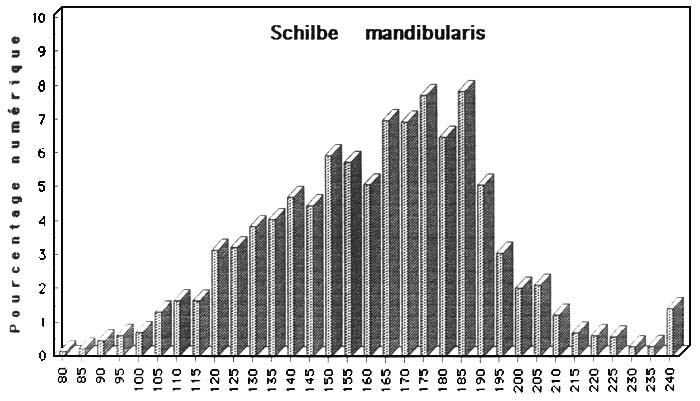
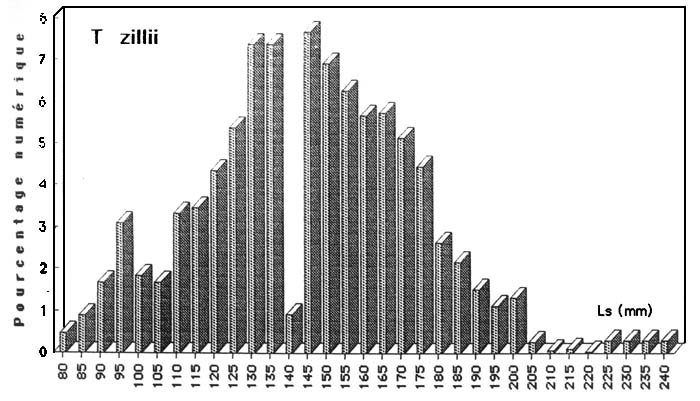
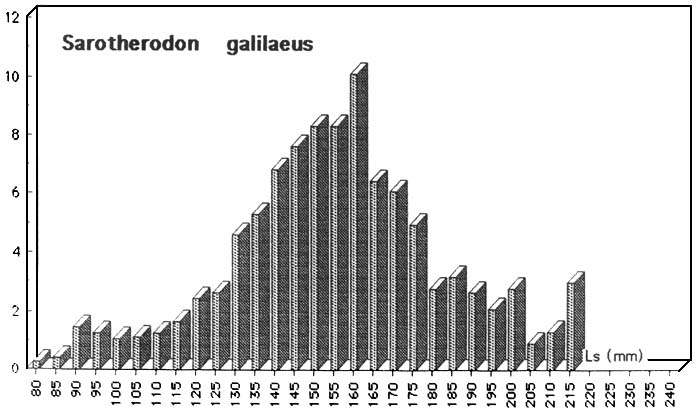
Figure : structure démographique de quelques espèces capturées
Figue: Structure démographique de quelques espèces
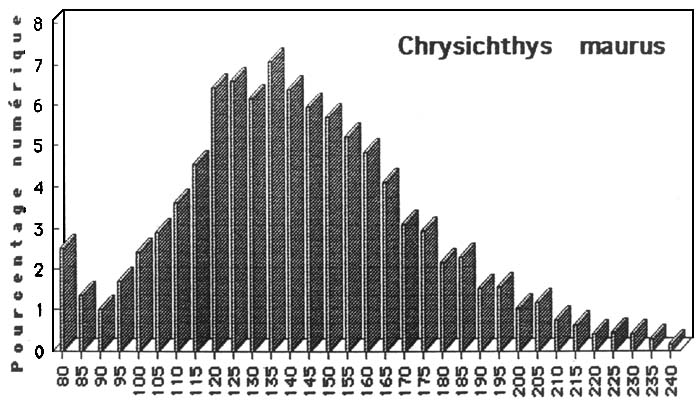
Figure : Structure démographique de Chrysichthys maurus
Parmi les principales constantes des diverses stratégies que déploient les poissons pour assurer la pérennité des espèces et le maintien de l'équilibre des populations, la fécondité occupe une place de choix, puisque le nombre et la qualité des oeufs conditionnent de toute évidence l'avenir des générations auxquelles ils donnent naissance.
L'analyse de la fécondité des poissons se revèle d'un double intérêt D'abord sous son aspect fondamental, l'étude de la fécondité permet une connaissance approfondie des mécanismes de la reproduction. Elle renseigne sur la capacité prolifique des espèces, sur la nature de leur mode d'occupation du milieu et sur le type de stratégie qu'elles adoptent
D'un autre point de vue la fécondité contribue à résoudre certains problèmes qui se posent au niveau de la gestion des ressources ichtyologiques. Sa connaissance est d'autant plus indispensable qu'elle constitue un des premiers termes de passage essentiel entre le stock et le recrutement et offre de ce fait aux dynamiciens, un moyen nécessaire à l'élaboration de modèles prévisionnels d'estimation des stocks.
La fécondité correspond au nombre d'ovocytes qui constituent le groupe modal le plus avancé et qui correspond grossièrement au nombre des oeufs qui seront émis à la ponte. Dans un ovaire, coexistent plusieurs types d'ovocytes: le stock général de réserve et suivant le cas, un ou plusieurs lots d'ovocytes à différents stades de développement
L'estimation de la fécondité a permis de classer les poissons d'eau douce de Côte d'Ivoire en trois grandes catégories :
• Sont considérées comme espèces à fécondité élevée celles qui ont un taux de fécondité supérieur
Dans les plans d'eau ivoiriens, il existe des espèces dont les ovocytes présentent une distribution de type unimodal suggérant une ponte simple et des espèces à structures plurimodale laissant prévoir une ponte fractionnée.
Environ les deux tiers des espèces importantes ont une distribution de type plurimodal qui suggèrent une ponte fractionnée ou multiple. Dans certains cas, la durée de la crue peut influer sur le nombre des émissions d'ovocytes et donc sur la fécondité globale du stock reproducteur.
Par contre, il existe une hétérogénéité au sein des différentes familles, en ce qui concerne le diamètre moyen des ovocytes en maturation avancée.
Les Characidae, les Cyprinidae et les Schilbeidae ont des oeufs petits. Ils sont moyens à gros chez les Mormyridae et les Clariidae.
A l'exception de Hemichromis bimaculatus,(D = 1,20 mm), les Cichlidae ont des oeufs plus volumineux.
• Les Bagridae, les Polypteridae et les Notopteridae ont des oeufs gros à très gros (D = 3,6 mm).
• Les espèces très prolifiques ont des oeufs de petit diamètre, peu chargés en vitellus et qui sont d'une manière générale liberés massivement dans le milieu naturel auquel ils sont abandonnés. Ces espèces à forte fécondité appartiennent en majorité aux Cyprinidae, aux Characidae et aux Schilbeidae, familles au sein desquelles on trouve les espèces les plus abondantes dans le milieu (Levêque et al, 1977 ; Albaret et al, 1978 ; Paugy et al, 1978). Ce sont pour la plupart des formes “pélagiques” et souvent migratrices.
• Chez les espèces à faible fécondité, on peut distinguer celles dont la diminution du nombre d'oeufs émis à la ponte est due, schématiquement, à une simple augmentation du diamètre moyen des ovocytes, de celles pour lesquelles la reduction de fécondité s'accompagne en plus de l'augmentation de diamètre, d'une diminution de poids relatifs des gonades.
Dans le premier groupe, on trouvera des espèces à R.G.S élevé et oeufs volumineux (cas des Chrysichthys par exemple), dans le second (Tilapia, Oreochromis, Sarotherodon, Papyrocranus afer), des espèces ayant à la fois des gonades petites et de gros oeufs.
Les espèces à faible fécondité sont en général benthiques, plus ou moins sédentaires voire territoriales.Leurs oeufs sont gorgés de réserves vitellines et leur aptitude à arriver à terme et à donner des larves et alevins armés pour survivre en proportion importante est accrue par divers procédés tels que fixation, dissimulation, fabrication de nid plus ou moins élaborés, garde des parents, incubation buccale.
Les espèces d'eau douce de Côte d'Ivoire n'appartiennent pas toutes à l'une ou l'autre des catégories définies (petite oeufs - forte fécondité et gros oeufs - faible fécondité). La plupart des Mormyridae par exemple occupent une position intermédiaire avec des oeufs moyens à gros et des fécondités également en général dans la moyenne. II en est de même pour les Clariidae.
Tableau : Fécondité des principales espèces de poissons des cours d'eau ivoiriens
| Espèces | Longueur standard (mm) | Poids du poisson (g) | Fécondité absolue | Fécondit érelative (F/kg) | Diamètre ovocytai re(mm) |
| Alestes baremoze | 135–240 | 30–210 | 3700–52000 | 225000 | 1.10 |
| Brycinus macrolepidotus | 192–300 | 145–582 | 21500–100000 | 180000 | 1,20 |
| Brycinus nurse | 70–162 | 10–107 | 2000049800 | 339000 | 1,05 |
| Brycinus imberi | 80–120 | 14–50 | 2100–16400 | 251000 | 1.00 |
| Chrysichthys maurus | 130–205 | 60–200 | 9004200 | 21000 | 2.8 |
| Chry. nigrodigitatus | 150–270 | 180–310 | 3050–6070 | 18000 | 2.9 |
| Oreochromis niloticus | 160–250 | 150–400 | 449–876 | 3720 | 2,55 |
| Sarotherodon galilaeus | 186–200 | 288–450 | 1102–1426 | 3840 | 2,30 |
| Tilapia zillii | 90–190 | 35–208 | 17504340 | 38600 | 1.65 |
| Hemichromis fasciatus | 120–150 | 67–83 | 1886–2509 | 30000 | 1.65 |
| Labeo coubie | 240–300 | 395–712 | 3880–10850 | 122000 | 1.25 |
| Heterobranchus longifilis | 108–330 | 190–272 | 29000–33160 | 123000 | 1.50 |
| Labeo parvus | 108–175 | 39–160 | 10540–68170 | 347000 | 0.95 |
| Synodontis schall | 148–220 | 76–305 | 8800–60700 | 160000 | 1,20 |
| Synodontis bastiani | 155–230 | 80–310 | 9800–61500 | 175000 | 1.25 |
| Schilbe mandibularis | 158–350 | 52463 | 14020–77160 | 21700 | 0,95 |
| Schilbe intermedius | 185–210 | 105–230 | 1815044900 | 25000 | 0,85 |
| Polypterus endlicheri | 330–800 | 350–350 | 2850–70300 | 15000 | 2,45 |
| Hepsetusodoe | 262–315 | 292–442 | 2500–11000 | 18250 | 2,30 |
| Hydrocynus forskalii | 178–510 | 75–238 | 760042370 | 129300 | 1,05 |
| Marcusenus ussheri | 136–218 | 38–175 | 1300–7340 | 52000 | 1.55 |
| Mormyrus rume | 271–302 | 204–220 | 4520–5720 | 25000 | 1.85 |
| Petrocephalus bovei | 67–110 | 7–26 | 340–2690 | 92000 | 1,55 |
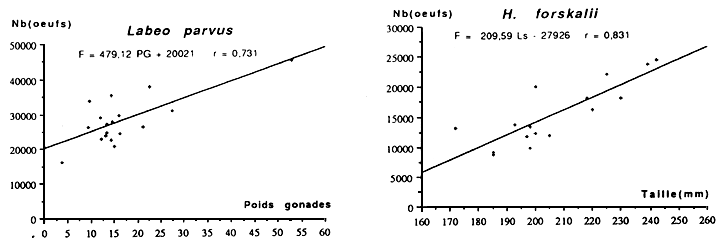
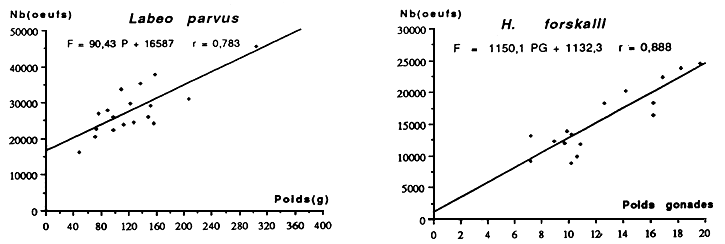
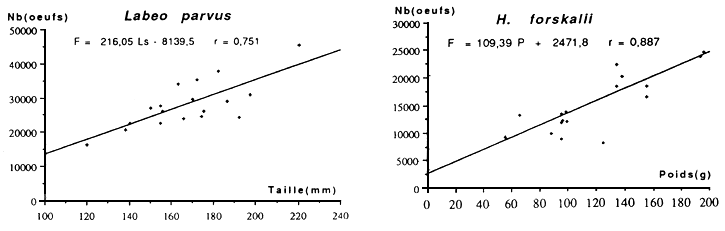
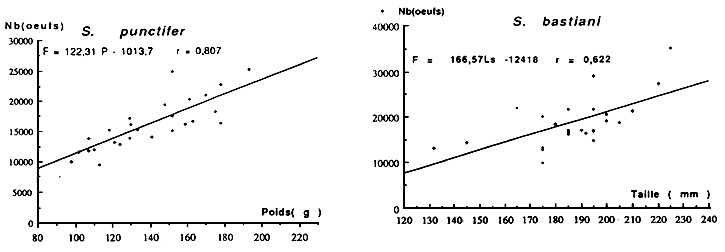
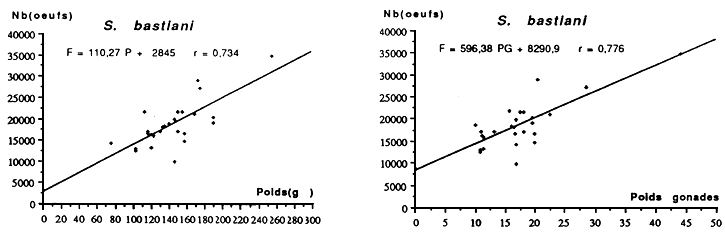
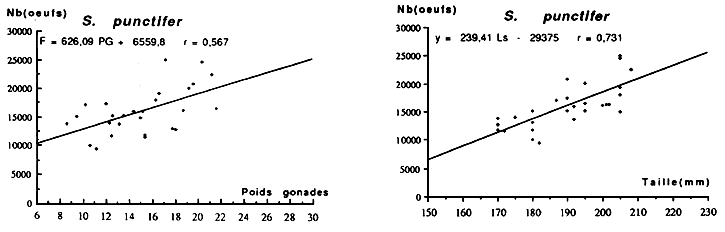
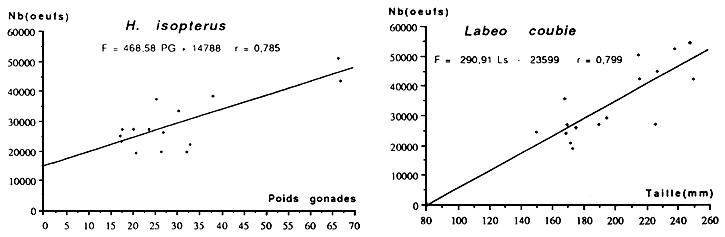
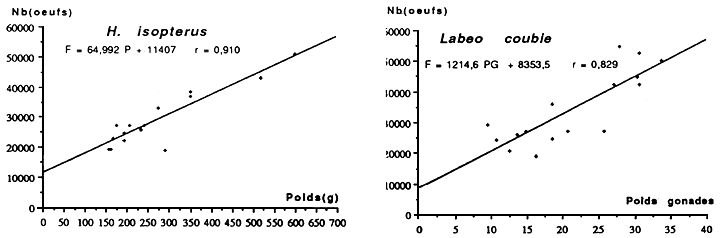
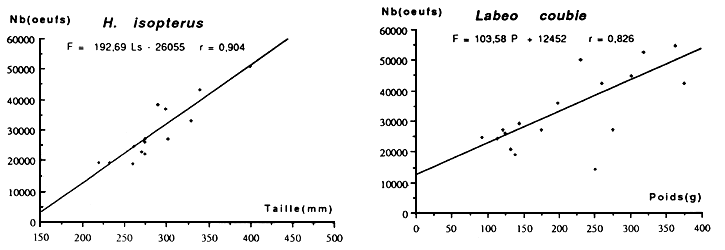
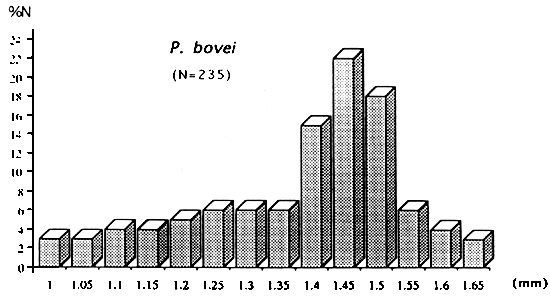
Fig: Distribution des diamètres des ovocytes intraovariens
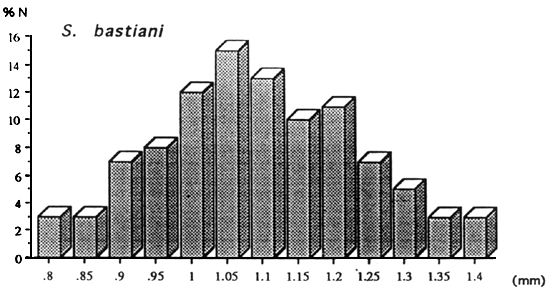
Fig: Distribution des diamètres des ovocytes intraovariens
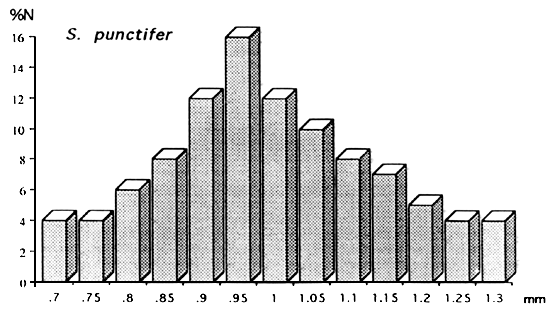
Fig: Distribution des diamètres des ovocytes intraovariens
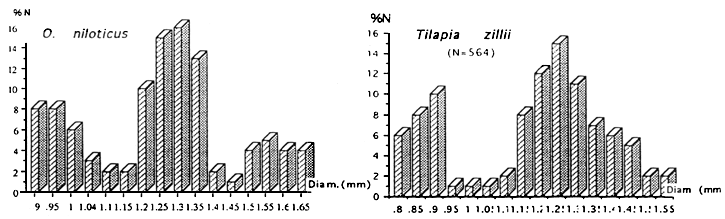 | |
| Figure : Distribution des diamètres des ovocytes intraovariens | Figure: Distribution des diamètres des ovocytes intraovariens |
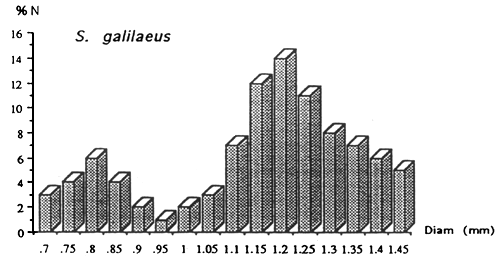
Fig : Distribution des diamètres des ovocytes intraovariens
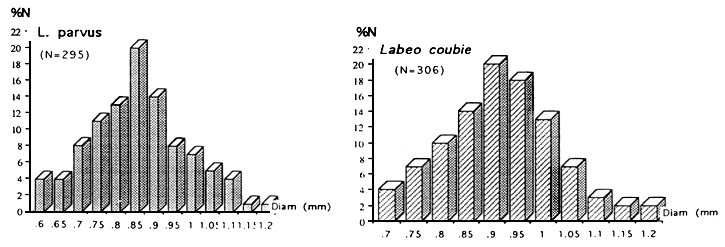 | |
| FUGURE : Distribution des diamètres des ovocytes intraovariens | Figure : Distribution des diamètres des ovocytes intraovariens |
Quelques travaux de recherche ont été menés sur les régimes alimentaires des poissons (Vidy, 1976 ; Traoré, 1989) en vue de déterminer les principales niches trophiques et d'identifier celles qui sont vacantes et qui pourraient justifier d'éventuels repeuplements de certains plans d'eau. Ces études ont été menées aussi bien sur les poissons du lac de Buyo, que sur ceux de certains fleuves (Bandama, Sassandra, Comoé, Leraba) que sur les principales retenues hydro-agricoles du Nord (Morisson, Lokpôhô, Nafoun, Solomougou et Sologo). Elles ont porté essentiellement sur des spécimens de poissons des familles de Bagridae (Chrysichthys maurus), Mormyridae (Marcusenius ussheri, Petrocephalus bovei), Characidae (Alestes baremoze, Brycinus macrolepidotus, Brycinus nurse), Schilbeidae (Schilbe mandibularis, Schilbe intermedius), Osteoglossidae (Heterotis niloticus), Cichlidae (Hemichromis fasciatus).
Les contenus stomacaux ont été étudiés grâce à la méthode d'occurence et de pourcentage numérique des proies ingérées.Ces études ont montré que la plupart de ces poissons se nourrissent à partir des apports endogènes du milieu ; les larves d'insectes aquatiques (essentiellement les larves d'Ephéméroptères, de Diptères et de trichoptères, les Crustacés et les Mollusques et à partir des apports exogènes (Insectes terrestres, débris végétaux) (tableaux .15/16.. et figures. 16/17). La plupart de ces poissons ont un régime alimentaire éclectique et dont l'élasticité est fonction de l'hydrologie et de la disponibilité de la nourriture.
Tableau 15 : Composition du régime alimentaire d'Alestes baremoze
| Proies ingérées | BUYO | NIAKA | SOLOMOUGOU | ||||
| % Occ. | % N | % Occ. | % N | % Occ. | % N | ||
| Ephéméroptères | 100 | 22,4 | 100 | 17,3 | 100 | 17,1 | |
| Beatidae | 100 | 10,5 | 100 | 6,8 | 100 | 5,8 | |
| Caenidae | 16,6 | 1.6 | 80 | 4,5 | 80 | 6,0 | |
| Tricorythidae | 100 | 6.7 | 100 | 5.1 | 61 | 4,4 | |
| Leptophlobidae | 55,5 | 3.6 | 8 | 0,9 | 7.5 | 0,9 | |
| Diptères | 100 | 14,8 | 100 | 20,4 | 100 | 10,7 | |
| Chironominae | 100 | 7,9 | 100 | 11,8 | 100 | 6,3 | |
| Tanypodinae | 100 | 6,9 | 100 | 8,6 | 100 | 4,4 | |
| Trichoptères | 100 | 8,4 | 100 | 21,8 | 100 | 20,1 | |
| Hydropsychidae | 80 | 6.1 | 100 | 7,1 | 100 | 10,4 | |
| Ecnomidae | 80 | 1.4 | 100 | 8,3 | 100 | 4,5 | |
| Hydroptilidae | 80 | 0,9 | 80 | 6.4 | 100 | 5,2 | |
| Chaoboridae | 100 | 8.4 | 100 | 14,2 | 100 | 11,8 | |
| Coléoptères | 55 | 7,8 | 12,5 | 2,2 | 30 | 7,2 | |
| Hémiptères | 55 | 3.1 | 12,5 | 1.1 | 30 | 2.1 | |
| Odonates | 5,6 | 1.7 | 0 | 0 | 0 | 0 | |
| Zooplancton | 100 | 6.6 | 100 | 5,3 | 100 | 8.2 | |
| Autres invert, aquat. | 80 | 8.4 | 80 | 3.6 | 100 | 12,5 | |
| Insectes terrestres | 100 | 16,7 | 100 | 14,1 | 100 | 10,3 | |
| Mollusques | 0 | 0 | 0 | 0 | 0 | 0 | |
| Ostracodes | 0 | 0 | 0 | 0 | 0 | 0 | |
| Poissons | 0 | 0 | 0 | 0 | 0 | 0 | |
Tableau 17:Composition du régime alimentaire de Chrysichthys maurus
| Proies ingérées | LOKPÔHÔ | NAFOUN | SOLOMOUGOU | ||||
| % Occ. | % N | % Occ. | %N | % Occ. | %N | ||
| Ephéméroptères | 100 | 13,8 | 100 | 17,9 | 100 | 10,8 | |
| Diptères | 100 | 29,4 | 100 | 20,9 | 100 | 15,4 | |
| Chironominae | 100 | 19,2 | 100 | 12,6 | 100 | 0 | |
| Tanypodiuae | 100 | 10,2 | 100 | 8,3 | 75 | 16,3 | |
| Trichoptères | 100 | 19,8 | 100 | 21,4 | 100 | 10,4 | |
| Hydropsychidae | 75 | 3,4 | 100 | 11,8 | 100 | 5,9 | |
| Ecnomidae | 100 | 11,2 | 100 | 3,2 | 100 | 29,4 | |
| Hydroptilidae | 25 | 5,2 | 60 | 6,4 | 75 | 8,9 | |
| Chaoboridae | 100 | 13,1 | 100 | 16,2 | 100 | 12,3 | |
| Coléoptères | 25 | 1,8 | 30 | 2,2 | 50 | 8,2 | |
| Hémiptères | 10 | 1,8 | 0 | 0 | 50 | 11,3 | |
| Odonates | 0 | 0 | 0 | 0 | 0 | 5.4 | |
| Plécoptère | 0 | 0 | 0 | 0 | 25 | 4.3 | |
| Zooplancton | 75 | 3,6 | 50 | 4,2 | 75 | 2.8 | |
| Autres invert, aquat. | 25 | 1,6 | 25 | 2,2 | 75 | 0 | |
| Insectesterrestres | 100 | 5,2 | 50 | 3,2 | 100 | 1,4 | |
| Mollusques | 75 | 3,6 | 100 | 3,4 | 100 | 5,4 | |
| Ostracodes | 100 | 6,3 | 80 | 6.4 | 50 | 4.3 | |
| Débrisvégétaux | 100 | - | 100 | - | 100 | 2.8 | |
Tableau 17 : Composition du régime alimentaire de Heterotis niloticus
| Proies ingérées | BUYO | NAFOUN | NIAKA | ||||
| % Occ. | % N | % Occ. | % N | % Occ. | % N | ||
| Ephéméroptères | 60 | 15,6 | 75 | 17.7 | 75 | 15.1 | |
| Diptères | 75 | 17,8 | 75 | 20,6 | 80 | 18.6 | |
| Chironominae | 50 | 10,3 | 60 | 10.3 | 50 | 6,6 | |
| Tanypodinae | 50 | 3,5 | 3,5 | 55 | 80 | 12 | |
| Trichoptères | 80 | 19,3 | 60 | 18,6 | 80 | 22,2 | |
| Hydropsychidae | 40 | 8,0 | 60 | 5,1 | 80 | 8,7 | |
| Ecnomidae | 50 | 8.0 | 60 | 8,7 | 50 | 7,3 | |
| Hydroptilidae | 20 | 3,3 | 50 | 4.8 | 50 | 4,2 | |
| Chaoboridae | 80 | 8,1 | 50 | 8,7 | 60 | 5.6 | |
| Coléoptères | 0 | 0 | 20 | 0 | 0 | 0 | |
| Hémiptères | 40 | 3,5 | 0 | 0 | 30 | 3,9 | |
| Odonates | 30 | 2,6 | 20 | 3,9 | 30 | 2,6 | |
| Hydracariens | 0 | 0 | 30 | 2.6 | 10 | 1.4 | |
| Zooplancton | 100 | 12,3 | 80 | 8,7 | 80 | 56 | |
| Antres invert, aquat. | 100 | 8,1 | 66 | 3,9 | 100 | 8,7 | |
| Insectes terrestres | 0 | 0 | 0 | 0 | 0 | 0 | |
| Mollusques | 0 | 0 | 33,3 | 2.6 | 10 | 1,4 | |
| Ostracodes | 100 | 5,8 | 66 | 3.9 | 10 | 4,2 | |
| Poissons | 100 | 6.9 | 100 | 5,7 | 80 | 4,2 | |
A partir des données recueillies sur le régime alimentaire des principales espèces étudiées et sur la base de certaines données bibliographiques relatives à certaines espèces que nous n'avons pas pu étudiées, nous avons distingué 8 sources de nourritures pour les poissons. Il s'agit de : phytoplancton, des macrophytes, du zooplancton, du benthon (mollusques, ostracodes, etc…), des insectes aquatiques, des crevettes, des insectes terrestres et des poissons-proies. Les macrophytes sont constitués par les herbiers immergés installés autour des herbiers et près des rivages. Les feuilles, les graines et les fruits des plantes immergées sont utilisés par certains espèces de poissons telles que Brycinus macrolepidotus, Tilapia zillii, etc… Les proies d'origine benthique sont essentiellement constituées de mollusques, de larves d'insectes et de vers oligochètes, de nématodes et d'ostracodes. Les mollusques consommés sont des individus de petite taille et des petites espèces. Ils peuvent être benthiques ou inféodés aux herbiers. Les insectes aquatiques ingérés sont représentés par les larves de chironomides, d'éphéméroptères, de Diptères de chaoboridae. Ces études ont permis de distinguer quatre grandes catégories de poissons selon leurs niveaux trophiques :
- les consommateurs primaires qui se nourrissent principalement d'algues, de phanérogames (feuilles, tiges, graines, fruits) et de débris végétaux.
Il s'agit de:
Oreochromis niloticus,
Sarotherodon galilaeus,
Tilapia zillii,
Distichodusrostratus
Brycinus macrolepidotus
;
- Les Insectivores qui sont des espèces qui consomment essentiellement des larves d'insectes aquatiques (Ephéméroptères, Diptères, trichoptères etc.), leurs proies secondaires étant les zooplancton, les insectes terrestres
- les prédateurs ichtyophages qui sont des carnivores qui consomment aussi bien des insectes, des crustacés que des poissons;
Il s'agit de:
Lates niloticus,
Hepsetus odoe,
Parachanna obscura,
Hydrocynus forskalii,
Mormyrops anguilloides,
Polypterus endlicheri,
Hemichromis fasciatus
Schilbe intermedius;
- les omnivores pour lesquels il est difficile d'assigner une place précise dans la chaine alimentaire. Parmi ces poissons, on peut citer
les Clarias spp.,
les Heterobranchus spp.,
les Labeo spp.
Cela nous a permis de procéder à un récapitulatif des caractéristiques écologiques liées au régime alimentaire des principales espèces de poissons rencontrées dans les écosystèmes fluviolacustres ivoiriens.
Cette classification n'est pas très rigoureuse dans la mesure où certains poissons se nourrissent à des niveaux trophi-ques particuliers et constants en dépit des variations géographiques et d'autres en revanche, ont une spectre alimentaire extrêmement étendu et peuvent prélever leur nourriture à différents niveaux trophiques. La plasticité de leur régime leur confère le pouvoir de s'adapter à des biotopes variés, à des conditions géographiques et climatiques différentes.Dans les différentes conditions écologiques où ils peuvent être amenés à vivre, ils trouveront une nourriture qui leur convient.
CRUE
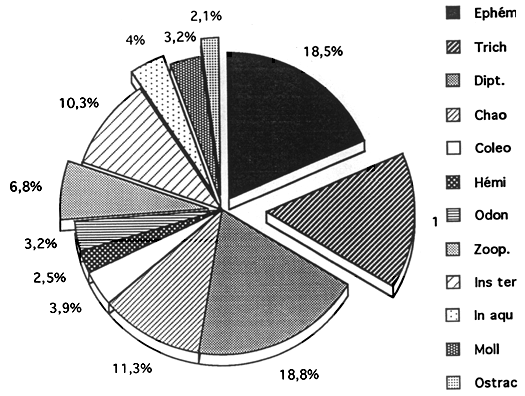
Fig..Spectre alimentaire de Chrysichthys maurus
ETIAGE
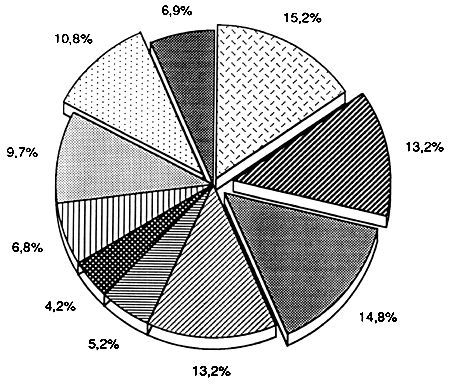
CRUE
Figure…:Spectre alimentaire d'A.baremoze
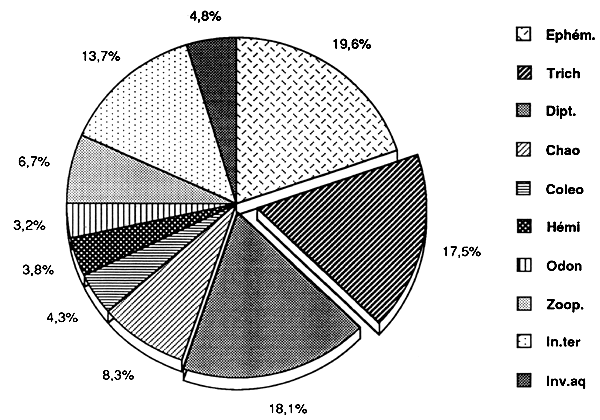
CRUE
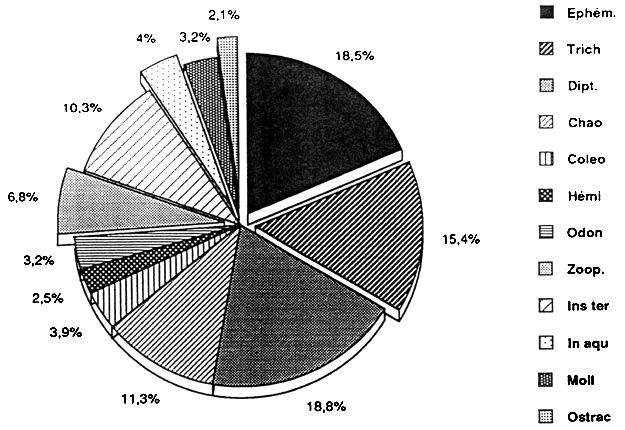
Fig..:Spectre alimentaire de Chrysichthys maurus
ETIAGE
Tableau...... : Récapitulatifs des caractéristiques écologiques liées au régime alimentaire des princiaples espèces de poissons des écosystèmes fluviolacustres de Côte d'Ivoire
| ESPECES | Biotopes préférentiels | Type de régime alimentaire | Principales composantes du régime |
| Heterotis niloticus | Zones pélagiques | Insectivore & granivore | Invenébrés benthiques molluques, Ostracodes, larves d'insectes aquatiques) et végétaux supérieurs |
| (Osteoglossidae) | |||
| Mormyrus rume | Zones profondes & Fonds rocheux | lnvertébrés benthiques larves d'insectes. mollusques, Ostracodes couverture biologique dépôts de fond | |
| (Mormyridae) | Insectivore & benthophage | ||
| Mormyrops anguilloides | Zones profondes & fonds rocheux | Prédateur ichtyophage | Poissons et invertébrés benthiques |
| (Mormyridae) | |||
| Marcusenius spp. | Fond rocheux & vaseux avec courant | Insectivore & benthophage | Larves d'insectes benthiques mollusques, Ostracodes zooplancton |
| (Mormyridae) | |||
| Petrocephalus bovei | Fonds rocheux et vaseux | Insectivore & benthophage | Inesctes benthiques zooplancton microcrustacés |
| (Mormyridae) | |||
| Heterobranchus spp. | Biefs profonds & vaseux | Omnivore & prédateur benthophage (qui fouille la vase de fond pour extraire sa nourriture) | Couverture biologique Larves d'insectes Débris végétaux, graines Fruits tombés des arbres des galeries forestières Poissons et détritus animaux |
| (Clariidae) | |||
| Clarias anguillaris | Biefs profonds & vaseux | Omnivore mais régime éclectique en fonction des ressources disponibles | Insectes et larves d'insectes Invertébrés benthiques (mollusques, crustacés etc) Débris animaux et végétaux |
| (Clariidae) | |||
| Chrysichthys maurus | zones peu profondes à Fonds rocheux & berges dures Poisson ombrophile | Prédateur benthophage | Larves d'insectes aquatiques (Chironomides et trichoptères en particulier) mollusques, ostracodes, alevins, zooplancton |
| (Bagridae) | |||
| Schilbe mandiibularis | Poissons de surface avec biotopes divers inféodés aux régions fortement encombrées de branchages | Inectivorc avec tendance ichtyophage progressive | Larves d'insectes Insectes terrestres crevettes, poissons et débris végétaux (graines et fruits tombés des arbres |
| (Schilbeidae) | |||
| Schilbe intermedius | Biotopcs divers Zones de branchages | Ichtyophage & insectivore | Poissons, larves d'insectes insectes terrestres |
| (Schilbeidae) | |||
| Alestes baremoze | Poissons de surface près des rives | Poisson à large spectre alimentaire, essentiellement Inectivore ( peut devenir zooplanctonophage) | Larves d'invertébrés aquatiques, insectes terrsetres zooplancton et débris végétaux |
| (Characidae) | |||
| Brycinus macrolepidotus | Eaux peu profondes (=nageur de surface) | Macrophytophage (régime éclectique) | Végétaux supérieurs (jeunes tiges, graines, fruits, feuilles) Insectes terrestres, larves d'insectes aquatiques et zooplancton |
| (Characidae) | |||
| Brycinus nurse | Eaux peu profondes | Spectre alimentaire très large mais avec tendance insectivore dominante | Larves d'insectes aquatiques (Chironomides, Ephéméroptères, trichoptères et Chaoboridae), insectes terrestres, zooplancton et débris végétaux |
| (Characidae) | |||
| Brycinus imberi | Zones peu profondes avec courant et radiers sur seuils rocheux | Consommateur insectivore ( mais spectre alimentaire large) | Larves d'invertébrés aquatiques, insectes terrestres, zooplancton et débris végétaux |
| (Characidae) | |||
| Hydrocynus forskalii | Zones pélagiques | Prédateur ichtyophage | Poissons (insectes aquatiques, crevettes et zooplancton) |
| (Characidae) | |||
| Hepsetus odoe | Zones peu profondes avec courant | Prédateur ichtyophage | Poissons (Crevettes, zooplancton) |
| (Hepsetidae) | |||
| Zones rocheuses avec courants (=poisson de fond qui affectionne les zones ombrophiles) | Larves d'insectes aquatiques mollusques, Ostracodes insectes terrestres, débris animaux et végétaux | ||
| Synodontis bastiani | Prédateur benthophage (=brouteur des fonds durs) | ||
| (Mochokidae) | |||
| Synodontis punctifer | Prédateur benthique (=brouteur des fonds durs) | Dépôts sur fonds durs Invertébrés benthiques (insectes aquatiques, mollusques, ostracodes) Débris animaux et végétaux | |
| (Mochokidae) | Zones profondes avec courant (=poisson ombrophile) | ||
| Synodontis kaensis | Zones rocheuses & vaseuses | Prédateur benthophage | Dépôts organiques sur fonds durs (couverture biologique), invertébrés benthiques |
| (Mochokidae) | |||
| Sarotheradan. galilaeus | Zones sableuses | Microphytophage | Plancton végétale de la couverture biologique |
| (Cichlidae) | |||
| Tilapia zillii | |||
| (Cichlidae) | Zone sableuse | Phytophage | Végétaux supérieurs d'insectes, zooplancton petits crustacés périphyton |
| Hemichromis fasciatus | Zones peu profondes | Prédateur ichtyophage | Poissons, larves d'insectes crevettes |
| (Cichlidae) | |||
| Labeo coubie | Fonds vaseux et rocheux | Omnivore | Couverture biologique dépots de fonds |
| (Cyprinidae) | |||
| Labeo parvus | Zone rocheuse avec courant | Omnivore | Dépôts de fond et couverture biologique |
| (Cyprinidae) | |||
| Parachanna obscura | Berges accidentées et zones inondées | Prédateur ichtyophage | Poissons Insectes |
| (Channidae) | |||
| Polypterus endlicheri | Prédateur ichtyophage et insectivore | Poissons, larves d'insectes Insectes terrestres, crevettes | |
| {Polypteridae) | |||
| Distichodus rostratus | Macrophytophage Détrivore | Plantes aquatiques (feuilles, tiges, graines | |
| Distichodontidae | |||
| Lates niloticus | Grandes masses d'eau profondes | Prédateur ichtyophage et insectivore | Poissons insectes, zooplancton |
| (Centropomidae) |
Le coefficient de condition ou facteur (K) tel que défini par le Green (1951) est le rapport :
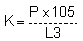
où P est le poids frais exprimé en grammes et L est la longueur standard exprimée en millimètres. Le facteur K donne une bonne idée de l'embonpoint du poisson, c'est-à-dire l'importance relative de sa masse corporelle par rapport à sa longueur. C'est un paramètre qui permet d'une part de comparer les espèces entre elles ou une même espèce dans différents milieux et d'autre part de caractériser la qualité de la relation trophique entre le poisson et son milieu. Le facteur (K) est un bon indice pour la caractérisation de l'embonpoint donc de l'état physiologique et nutritionnel du poissoaLe coefficient de condition des principales espèces de poisson a été calculé à partir des spécimens capturés dans le lac de Buyo, dans le Bandama, dans la Comoé et dans une vingtaine de retenues hydro-agro-pastorales du nord de la Côte d'Ivoire.
Tableau 18 : Coefficients de condition des principales espèces capturées
| ESPECES CAPTUREES | COlOTlUllSNTS DE CONDITION | |||||
| Niakara | Nafoun | |||||
| Min | Max | Moyenne | Mini | Max | Moyenne | |
| Oreodromis niloticas | 3,847 | 4,300 | 4.086 | 3,847 | 4,300 | 4.108 |
| Tilapia zillii | 3,729 | 4,254 | 3.985 | 3,578 | 4,060 | 3,885 |
| Sarotherodon galilaeus | 3,833 | 4.745 | 4.408 | 4.003 | 4.278 | 4.155 |
| Hemichromis fasciatus | 2,898 | 3,704 | 3,194 | 2,937 | 3.83 | 3,275 |
| Chromidotilapia guntheri | 3,382 | 3,631 | 3,496 | 3,466 | 4.107 | 3,831 |
| Brycinus nurse | 2.613 | 2,780 | 2,689 | 2,810 | 3.068 | 2,960 |
| Clarias anguillaris | 2,224 | 2,788 | 2,412 | 2,224 | 2.978 | 2,368 |
| Petrocephalus bovei | 2,186 | 2,809 | 2.406 | 2.163 | 2.525 | 2.265 |
| Schilbe intermedius | - | - | - | 1,317 | 1.446 | 1,389 |
| Synodontis schall | 2,430 | 2,860 | 2,586 | - | - | - |
| Barbus macrops | 2,361 | 2,843 | 2.611 | 2,180 | 2.643 | 2,471 |
| Chrysichthys maurus | 2,290 | 2,368 | 2,316 | - | - | - |
Tableau 19: Coefficients de condition des principales espèces capturées
| ESPECES CAPTUREES | COEFFICIENTS DE CONDITION | |||||
| Guessabo | Buyo | |||||
| Min | Max | Moyenne | Mini | Max | Moyenne | |
| Oreochromis niloticus | 3,954 | 4,282 | 4,008 | 4,100 | 4,508 | 4,212 |
| Tilapia zillii | 3,889 | 4.152 | 3,952 | 3,799 | 4,080 | 3,979 |
| Sarotherodon galilaeus | 3,636 | 4,222 | 3,976 | |||
| Hemichromis fasciatus | ||||||
| Chromidotilapia guntheri | - | - | - | |||
| Brycinus nurse | - | - | - | |||
| Clarias anguillaris | 1,062 | 1,240 | 1,110 | |||
| Petrocephalus bovei | 2,124 | 2,419 | 2,275 | |||
| Schilbe intermedius | - | - | - | |||
| Synodontis schall | - | - | - | |||
| Barbus macrops | 2,149 | 2,675 | 2,550 | |||
| Barbus trispilos | - | - | - | |||
Tableau 20: Coefficients de condition des principales espèces capturées
| ESPECES CAPTUREES | COEFFICIENTS DE CONDITION | |||||
| LOKPOHO | SOLOGO | |||||
| Min | Max | Moyenne | Mini | Max | Moyenne | |
| Oreochromis niloticus | 4,088 | 4,386 | 4.186 | 3,787 | 4,200 | 3,986 |
| Tilapia zillii | 4,087 | 4,472 | 4,250 | 3,804 | 4,684 | 4,077 |
| Sarotherodon galilaeus | 4,171 | 4,438 | 4,311 | - | - | - |
| Hemichromis fasciatus | 2,739 | 3,460 | 3,177 | 3,181 | 3,978 | 3,465 |
| Chromidotilapia guntheri | - | - | - | 3,525 | 3,925 | 3,822 |
| Brycinus nurse | 2,355 | 2,712 | 2,660 | 2,411 | 2,959 | 2,506 |
| Clarias anguillaris | 1,503 | 1,823 | 1.364 | |||
| Petrocephalus bovei | 2,228 | 2,529 | 2,370 | |||
| Schilbe intermedius | 1,124 | 1,572 | 1,431 | 1,129 | 1,491 | 1,396 |
| Synodontis schall | 2,813 | 3,189 | 3,156 | - | - | - |
| Barbus macrops | 2,202 | 3,104 | 2,680 | 2,311 | 2,920 | 2,512 |
| Heterotis niloticus | 1,403 | 1,604 | 1,532 | 1,166 | 1.414 | 1.299 |
Tableau 21 : Coefficients de condition des principales espèces capturées
| ESPECES CAPTUREES | COEFFICIENTS DE CONDITION | |||||
| Gansé | Léraba | |||||
| Min | Max | Moyenne | Mini | Max | Moyenne | |
| Oreochromis niloticus | 3,008 | 3,926 | 3,525 | |||
| Tilapia zillii | 3,298 | 3.889 | 3.793 | 3.750 | 4.731 | 4.089 |
| Sarotherodon galilaeus | 3,365 | 4,019 | 3,898 | 3,899 | 4.668 | 4,288 |
| Hemichromis fasciatus | 3,718 | 4,470 | 4,189 | |||
| Lates niloticus | 2,227 | 2,623 | 2,369 | - | - | |
| Brycinus nurse | ||||||
| Chrysichthys mauras | 2,056 | 2,895 | 2,364 | 1,956 | 2,223 | 2,054 |
| Petrocephalus bovei | ||||||
| Schilbe intermedius | ||||||
| Synodontis schall | ||||||
| Barbus macrops | 2,170 | 3.792 | 3.525 | 2,440 | 2,730 | 2,592 |
| Clarias anguillaris | 0,947 | 1,193 | 1,007 | |||
Tableau 22 : Coefficients de condition des principales espèces capturées
| ESPECES CAPTUREES | COEFFICIENTS DE CONDITION | |||||
| LATAHA | NAMBINGUE | |||||
| Min | Max | Moyenne | Mini | Max | Moyenne | |
| Oreochromis niloticus | 4,000 | 4,388 | 4,128 | 3,992 | 4,124 | 4,028 |
| Tilapia zillii | 3,918 | 3,999 | 3,986 | 3,828 | 4,448 | 4,169 |
| Sarotherodon galilaeus | 4,060 | 4,674 | 4,397 | 4,270 | 4,716 | 4,478 |
| Hemichromis fasciatus | ||||||
| Chromidotilapia guntheri | ||||||
| Brycinus nurse | 2,614 | 2.945 | 2,729 | |||
| Clarias anguillaris | 1,111 | 1,440 | 1,122 | |||
| Petrocephalus bovei | ||||||
| Schilbe intermedius | ||||||
| Synodontis schall | ||||||
| Barbus macrops | 2,173 | 2,570 | 2,144 | 2,144 | 2,828 | 2,678 |
| Barbus trispilos | ||||||
Tableau 23 : Coefficients de condition des principales espèces capturées
| ESPECES CAPTUREES | COEFFICIENTS DE CONDITION | |||||
| SAMBAKAHA | GBOYO | |||||
| Min | Max | Moyenne | Mini | Max | Moyenne | |
| Oreochromis niloticus | 3.919 | 4,188 | 3,988 | 3,546 | 3,999 | 3,816 |
| Tilapia zillii | 3,787 | 4,465 | 4,164 | 3,786 | 4,555 | 4,278 |
| Sarotherodon galilaeus | 4,050 | 4,495 | 4,382 | 3,538 | 4,844 | 4,367 |
| Hemichromis fasciatus | 2,096 | 3,380 | 3,214 | 2,682 | 3,472 | 3,186 |
| Marcusenius ussheri | 1,414 | 1,525 | 1,470 | 1,270 | 1,669 | 1,583 |
| Brycinus nurse | 2,614 | 2,918 | 2,722 | - | - | - |
| Chrysichthys maurus | 2,198 | 2,704 | 2,380 | - | - | - |
| Petrocephalus bovei | 2,085 | 2,481 | 2,341 | 1,685 | 2,301 | 1,989 |
| Schilbe intermedius | 1,267 | 1.562 | 1,352 | 1,304 | 1,547 | 1,400 |
| Synodontis schall | 2,221 | 2,979 | 2,676 | 2,366 | 2.943 | 2,638 |
| Barbus macrops | 2,084 | 2.722 | 2,454 | - | - | - |
| Heterotis niloticus | 1,304 | 1.729 | 1,438 | 1,174 | 1.584 | 1,329 |
Tableau 24 : Coefficients de condition des principales espèces capturées
| ESPECES CAPTUREES | COEFFICIENTS DE CONDITION | |||||
| KATIALI | TIAPLE | |||||
| Min | Max | Moyenne | Mini | Max | Moyenne | |
| Oreochromis niloticus | 3,960 | 4,320 | 4,028 | 3.677 | 4,236 | 4,194 |
| Tilapia zillii | 3,996 | 4.719 | 4.316 | 3,628 | 4,558 | 4,220 |
| Sarotherodor galilaeus | 3.948 | 4.495 | 4.389 | 3,377 | 4,226 | 4,094 |
| Brycinus macrolepidotus | - | - | - | 1,799 | 2,225 | 2.055 |
| Clarias anguillaris | 1.191 | 1.295 | 1,221 | 1,018 | 1,317 | 3,157 |
| Brycinus nurse | - | - | - | 2,798 | 2,328 | 2.617 |
| Marcusenius ussheri | 1,537 | 1,703 | 1,636 | - | - | - |
| Petrocephalus bovei | 2,271 | 2,740 | 2,526 | - | - | - |
| Schilbe mandibularis | 1,680 | 1,149 | 1,291 | - | - | - |
| Synodontis schall | 2.680 | 3,349 | 2,891 | - | - | - |
| Barbus macrops | 2,009 | 2,711 | 2,411 | 2,428 | 2,712 | 2.580 |
| Barbus trispilos | - | - | - | - | - | - |
La condition des principales espèces ne semble pas être très affectée par les différentes agressions que subissent les poissons. En effet, les coefficients de condition des principales espèces subissent des variations très limitées dans le temps et qui ont un caractère aléatoire. Celles-ci reflètent plus les fluctuations des saisons hydrologiques.