La caractérisation de la gravité de la listériose était limitée à une description des symptômes de la maladie, à un résumé des données épidémiologiques concernant les poussées épidémiques et à un examen des taux de mortalité. Une quantification plus détaillée de la gravité de la maladie dépassait le cadre de l'évaluation des risques et n'était pas nécessaire pour répondre aux questions posées par le CCFH. En bref, divers signes cliniques sont associés à la listériose qui peuvent être groupés en deux catégories: listériose invasive et listériose non invasive.
On parle de listériose invasive lorsque l'infection initiale du tissu intestinal par L. monocytogenes se propage à d'autres parties du corps par ailleurs stériles. Les organes le plus souvent infectés sont l'utérus chez la femme enceinte, le système nerveux central et le sang. Un résumé de 782 cas de listériose déclarés par vingt pays a montré que 43 pour cent étaient des infections liées à la grossesse, et 57 pour cent n'étaient pas liées à la grossesse, qui pouvaient à leur tour être classées en catégories: 29 pour cent de septicémies, 24 pour cent d'infections du système nerveux central et 4 pour cent de formes atypiques (Rocourt, 1991). Outre la gravité inhabituelle des signes cliniques, la listériose est caractérisée par un taux élevé de létalité qui va de 20 à 30 pour cent (Mead et al., 1999). La listériose peut laisser des séquelles (McLauchlin, 1997), mais leur incidence est rarement estimée (Rocourt, 1996). Jusqu'à 11 pour cent des nouveaux-nés et 30 pour cent de ceux qui survivent à une infection du système nerveux central souffrent de symptômes résiduels, parfois de séquelles psychiatriques (références citées dans Rocourt, 1996). La caractéristique épidémiologique courante de la listériose invasive est une manifestation assez fréquente de cas sporadiques et la reconnaissance occasionnelle de poussées épidémiques. La majorité des cas de listériose semblent être sporadiques, mais une partie de ces cas sporadiques peuvent être des groupes d'origine commune non reconnue. Une étude récente a indiqué que 95 pour cent de ces cas sporadiques sont d'origine alimentaire (Mead et al., 1999). Plusieurs poussées épidémiques d'origine alimentaire ont été décrites depuis 1981 et certaines ont touché un grand nombre de patients sur une longue période: 122 patients en Suisse en 1985-1987, environ 300 patients au Royaume-Uni en 1987-1989 et 279 patients en France en 1992 (Rocourt et Cossart, 1997).
La listériose non invasive (appelée gastroentérite fébrile à Listeria) a été observée principalement durant un certain nombre de poussées où la majorité des cas ont affiché des symptômes de gastroentérite, tels que diarrhée, fièvre, céphalées et myalgie, après une brève période d'incubation (Dalton et al., 1997; Salamina et al., 1996; Riedo et al., 1994; Aureli et al., 2000). Ces poussées ont généralement comporté l'ingestion de fortes doses de L. monocytogenes par des individus par ailleurs en bonne santé. On ignore le taux d'incidence et les facteurs qui caractérisent le début de cette forme non invasive pour des cas sporadiques.
Du fait que l'impact de la listériose non invasive sur la santé publique est incertain et que les données sur l'incidence des symptômes plus légers sont insuffisantes, l'impact de ce point terminal biologique sur la santé publique n'a pas été estimé durant la présente évaluation. Il s'ensuit que le terme listériose est employé ici au sens de listériose invasive.
Des poussées ayant la même origine ont été associées ou liées sur le plan épidémiologique à la consommation de fromages frais de type hispanique (queso fresco), à pâte molle, demi‑molle et à moisissures, de hot-dogs (saucisses de Francfort), de langue de porc en gelée, de viandes transformées, de pâté, saucissons, lait pasteurisé arôme chocolat, lait pasteurisé, lait non pasteurisé, beurre, crevettes cuites, moules fumées, poisson fumé, salade de pommes de terre, légumes crus et salade de chou.
Des cas sporadiques ont été associés à la consommation de lait cru, crèmes glacées non pasteurisées, fromage ricotta, fromages de chèvre, de brebis et de feta, fromages à pâte molle, demi-molle et à moisissures, fromage de type hispanique, saucissons, hot-dogs, champignons salés, œufs de morue fumée, moules fumées, poisson insuffisamment cuit, picholines, légumes crus et salade de chou.
En général, les concentrations de L. monocytogenes dans les aliments étudiés ont dépassé 103 UFC/g (EC, 1999; FSA/FSIS, 2001), mais il y a eu des exemples où elles ont été beaucoup plus faibles. Toutefois, une grande incertitude demeure concernant ces estimations car la concentration réelle du pathogène dans la portion d'aliment consommé par un individu infecté aurait pu varier considérablement par rapport à celle observée dans d'autres portions de l'aliment durant une étude postérieure.
Les réponses d'une population humaine aux expositions à un pathogène d'origine alimentaire sont très variables, ce qui indique que l'incidence de la maladie est fonction de plusieurs facteurs, y compris les caractéristiques de virulence du pathogène, le nombre de cellules ingérées, l'état de santé général et l'état immunitaire de l'hôte et les attributs de la matrice alimentaire qui modifient l'état du microbe ou de l'hôte. On ignore également quel effet l'exposition préalable à L. monocytogenes d'origine alimentaire exerce sur la réponse immunitaire de l'hôte, car on peut supposer que la plupart des individus sont exposés normalement jusqu'à un certain point à ce pathogène. Ainsi, la probabilité que tout individu puisse contracter la maladie parce qu'il a été exposé à un pathogène d'origine alimentaire dépend de l'intégration des effets de l'hôte, du pathogène et de la matrice alimentaire. Ces interactions sont souvent appelées triangle de la maladie infectieuse. Chacune de ces catégories et leur influence sur la relation dose-réponse pour L. monocytogenes sont examinées dans le rapport technique (FAO/WHO, 2004). Une relation mathématique entre la dose et la réponse serait idéalement capable de décrire les interactions entre tous ces facteurs. Toutefois, en raison de l'insuffisance des données, les effets potentiels de la matrice alimentaire sur la relation dose-réponse n'ont pas été examinés explicitement en tant que variable dans tous les modèles. On a étudié l'influence des facteurs de l'hôte tant dans les modèles disponibles que dans les modèles élaborés dans la présente évaluation des risques (voir Section 4.4) en créant différentes relations pour différentes populations sensibles et insensibles. Il est important de noter que ces relations mathématiques décrivent la relation dose-réponse sur la base d'une population mais ne sauraient décrire la probabilité de maladie pour un individu particulier.
Il n'y a pas de données concernant la dose-réponse provenant d'études chez des volontaires avec L. monocytogenes ou d'études chez des volontaires avec un pathogène substitut. On a donc élaboré et évalué des relations dose-réponse sur la base d'hypothèses d'experts, de données épidémiologiques ou sur les animaux, ou des deux. Ces relations dose-réponse, revues et résumées dans le Rapport technique, concernent toute la gamme des points terminaux biologiques, c'est-à-dire morbidité et mortalité, et ont été évaluées, d'une manière plus ou moins approfondie, à l'aide de données épidémiologiques sur les humains. Tous les modèles supposent que chaque cellule agit indépendamment et qu'une seule cellule bactérienne peut causer une maladie (la dose infectieuse minimale est une bactérie). Avec le modèle exponentiel, on suppose que la probabilité qu'une seule bactérie cause la maladie est la même pour tous les L. monocytogenes ingérés et cette probabilité est exprimée par un seul paramètre, la valeur r. Le modèle à deux paramètres de Beta-Poisson introduit l'hétérogénéité dans l'interaction pathogène-hôte et l'on suppose que « r » est une variable. Le modèle Weibull-Gamma est un modèle à trois paramètres qui, outre qu'il tient compte de l'hétérogénéité pathogène-hôte, comprend également un paramètre qui modifie la forme de la courbe dose-réponse. Chacun de ces modèles de dose-réponse a des caractéristiques et des limitations spécifiques (voir résumé dans FAO, 2000). Les modèles disponibles, classés par catégorie par le point terminal biologique examiné et le type de modèle utilisé sont résumés au tableau 1.
Les relations empiriques décrites au tableau 1 donnent des prévisions très variables dans la fourchette des doses correspondant aux concentrations de L. monocytogenes habituellement présentes dans les aliments. À titre d'exemple, les courbes dose-réponse prévues pour certaines des relations au tableau 1, établies sur la base de données épidémiologiques ou d'hypothèses d'experts, sont présentées à la figure 1. Les différences reflètent le fait que des séries de données, des modèles mathématiques et des points terminaux biologiques différents ont été utilisés pour décrire la probabilité qu'une exposition à L. monocytogenes puisse causer la maladie.
Les connaissances actuelles ne permettent pas d'entériner un seul modèle dose-réponse déjà disponible (tableau 1). Les données sur les animaux ne peuvent être utilisées directement du fait que les souris de laboratoire sont beaucoup plus sensibles que les êtres humains. En raison de la gravité de la listériose, aucune étude n'a été ni ne sera conduite chez des volontaires. Une étude complète d'une poussée épidémique a été faite seulement dans quelques cas en raison du long délai qui s'écoule entre la consommation d'un aliment contaminé et le début de la maladie. La nature sporadique de la listériose rend aussi très difficile toute enquête. Les poussées épidémiques observées à Los Angeles chez des femmes enceintes qui consommaient du fromage hispanique et en Finlande chez des enfants hospitalisés ayant subi des greffes qui consommaient du beurre contaminé ont été les seules relativement bien documentées. On s'est appuyé sur ces deux poussées pour évaluer les modèles dose-réponse exponentiels élaborés pour ces groupes à risque (voir la réponse à la question 2 du Codex, à la Section 6). Ainsi, des informations épidémiologiques incomplètes, des extrapolations incertaines de données sur les animaux à l'homme, l'absence de données sur des essais d'alimentation humaine et le manque de modèles mécanistes sont, associés à une compréhension insuffisante de la variation des souches et des effets de la matrice alimentaires, des facteurs limitatifs qui contribuent à l'incertitude dans la description de la relation dose-réponse.
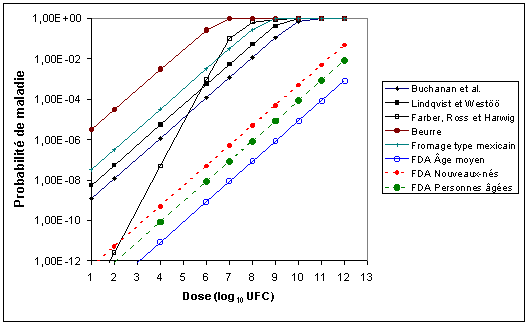
Figure 1. Comparaison des courbes dose-réponse pour la morbidité tirées de données épidémiologiques ou d'hypothèses d'experts. Les modèles sont fondés sur des cas de maladie où les principaux symptômes comprenaient une maladie grave (poisson fumé, Buchanan et al., 1997; poisson fumé, Lindqvist et Westöö, 2000; Farber Ross et Harwig, 1996; beurre, Finlande, voir FDA/FSIS, 2001), ou infections périnatales/néonatales (fromage de type hispanique, voir FDA/FSIS, 2001). Voir ici le tableau 1 pour une description des modèles.
Note: Les points indiqués sur les courbes ne sont donnés qu'à titre d'exemple et ne représentent pas des points de données. Cette figure est incluse à titre indicatif; il convient d'être prudent en interprétant ces courbes étant donné qu'elles sont fondées sur différents points terminaux, types de données, etc. et en général les prévisions fondées sur ces modèles affichent un degré élevé d'incertitude et de variation.
Tableau 1. Résumé des modèles dose-réponse de L. monocytogenes passés en revue dans la présente évaluation des risques.
Modèle et étude |
Point terminal biologique |
Observations |
Exponentiel(1) |
Morbidité (listériose grave). |
Sur la base d'une estimation des individus immunodéprimés. Il est volontairement prudent (c'est-à-dire qu'il tend à surestimer le risque) et a supposé que tous les cas étaient attribuables à une seule catégorie d'aliment. Morbidité prévue50 = 5.9 ´ 109 UFC. |
Exponentiel(1) |
Sur la base d'une estimation des individus immunodéprimés. Il est volontairement prudent (c'est-à-dire qu'il tend à surestimer le risque) et à supposer que tous les cas étaient attribuables à une seule catégorie d'aliment. Morbidité prévue50 = 1.2 ´ 109 UFC. | |
Weibull-Gamma(1) |
Infection grave chez l'homme. |
La dose estimée pour que 50 pour cent de la population soit infectée: |
Exponentiel(1) |
Morbidité (Listériose grave). |
Sur la base d'une poussée épidémique en Finlande due à la consommation de beurre. La population touchée était un groupe d'individus fortement immunodéprimés hospitalisés. |
Exponentiel(1) |
Morbidité (Listériose périnatale). |
Sur la base d'une poussée chez des femmes enceintes aux États-Unis d'Amérique causée par du fromage de type hispanique. |
FDA/FSIS-Général(2) |
Mortalité. |
Le modèle comprend des individus âgés de 30 à 60 ans. Voir Note (3). |
FDA/FSIS-Nouveaux-nés(2) |
Le modèle comprend les foetus et les nouveaux-nés de moins de 30 jours. On a supposé que l'exposition avait lieu in utero. | |
FDA/FSIS-Personnes âgées(2) |
Le modèle comprend des individus de plus de 60 ans. | |
Modèle exponentiel(1) |
Mortalité chez les souris. |
Modèle basé sur des souris auxquelles on a injecté L. monocytogenes par voie intraveineuse. Les souris qui n'avaient pas été exposées auparavant étaient plus sensibles à L. monocytogenes. L'emploi de la mortalité chez les souris sans correction pour la sensibilité amoindrie apparente des humains à L. monocytogenes a conduit à une surestimation importante de la mortalité chez les humains. |
Beta-Poisson et exponentiel (pas d'ajustement)(1) |
Infection chez les souris. |
L'emploi de l'infection chez les souris sans correction pour la sensibilité amoindrie apparente des humains à L. monocytogenes a conduit à une surestimation importante de l'incidence de l'infection chez les humains. Le choix du point terminal d'infection de sites par ailleurs stériles chez les souris est difficile à rattacher à la maladie chez l'homme. |
Notes: (1) Voir la section 4.3 dans le Rapportprincipal pour les descriptions des modèles exponentiels, Beta-Poisson etWeibull-Gamma.
(2) Modèle original fondé sur des modèles mathématiques multiplespondérés. Le modèle FDA/FSIS a utilisé des données sur des animaux delaboratoire pour établir la forme de la courbe dose-réponse. Selon des donnéesépidémiologiques fournies par les États-Unis, il y aurait 2 500 cas et 500décès par an. La courbe dose-réponse a été adaptée à la contamination par L. monocytogenesà la distribution de la consommation, ainsi elle calculera le nombre de cas àpartir des données épidémiologiques.
(3) Il comprend l'examen des distributions pour la virulence des souches.Il est basé sur des données fiables concernant la létalité chez les souris, desorte que le modèle donne des prévisions cohérentes avec l'incidence desinfections mortelles par L. monocytogenes signalées dans FoodNet – le réseau des États-Unis de surveillance active des maladie d'originealimentaire.
Actuellement, il n'y a que des critères limités sur lesquels fonder le choix du modèle dose-réponse, et il faudrait disposer de meilleurs outils pour comparer les différents modèles. Les critères disponibles comprennent l'emploi recommandé de modèles dose-réponse hors du seuil qui sont linéaires dans la fourchette des faibles doses et qui ont un fondement biologique et des paramètres pouvant être interprétés biologiquement (FAO/OMS, 2003). Toutefois, le choix des modèles à utiliser dépendra également de facteurs tels que l'objet de l'évaluation des risques et le niveau de ressources et de moyens techniques mis à la disposition des évaluateurs des risques. L'emploi de plusieurs relations de modèles dose-réponse pour décrire les estimations des risques est un autre moyen de remédier à l'incertitude liée aux différentes lacunes dans les connaissances. Une autre approche qui a été adoptée par au moins un groupe d'évaluateurs des risques est l'utilisation simultanée de plusieurs relations de modèles dose-réponse (FDA/FSIS, 2001). Néanmoins, ce dernier choix exige un modèle très sophistiqué – ce qui pourrait influer négativement sur l'objectif visé, c'est-à-dire conduire une évaluation des risques qui pourrait être adaptée par la FAO/OMS afin d'être utilisée à l'échelon mondial où le niveau des ressources et des moyens techniques pour l'évaluation des risques varie largement. Par ailleurs, aucun des modèles disponibles n'a pu répondre complètement aux besoins de la présente évaluation des risques en ce qui concerne les paramètres examinés et la simplicité des calculs. C'est la raison pour laquelle l'équipe des évaluateurs des risques, avec le concours d'un groupe d'experts internationaux en maladies d'origine alimentaire, a choisi d'élaborer une série de modèles dose-réponse plus simples fondés sur l'emploi du modèle exponentiel.
L'approche générale adoptée consistait à tirer parti des données épidémiologiques et de l'évaluation détaillée de l'exposition disponible dans l'évaluation des risques de la FDA/FSIS. La modélisation a été simplifiée en décrivant les relations dose-réponse à l'aide d'un modèle dose-réponse exponentiel, d'une manière similaire à celle décrite dans Buchanan et al. (1997) et dans Lindqvist et Westöö (2000).
L'emploi du modèle exponentiel conjointement avec des données d'enquêtes alimentaires et des statistiques annuelles sur la maladie pour élaborer un modèle dose-réponse a été proposé pour la première fois par Buchanan et al. (1997), sur la base d'une analyse de la contamination alimentaire et de données épidémiologiques provenant d'Allemagne. Le modèle exponentiel de Lindqvist et Westöö (2000) était fondé sur des données d'enquête alimentaire et des statistiques annuelles sur les maladies provenant de la Suède. En outre, l'évaluation des risques de la FDA/FSIS (2001) a décrit des modèles dose-réponse fondés sur plusieurs formes mathématiques, y compris le modèle exponentiel. Ces utilisations du modèle exponentiel étaient toutes fondées sur une déduction de la relation dose-réponse à partir de l'incidence annuelle de la listériose et des données sur l'exposition pour un ou plusieurs aliments. Les modèles s'appuyaient sur des données épidémiologiques similaires pour les épisodes de listériose parmi les populations saines et les populations sensibles. Ils supposaient également des ratios similaires de personnes sensibles et de personnes saines et que la consommation des aliments était la même dans les deux populations. Ils différaient néanmoins en ce qui concerne l'ampleur de l'exposition présumée, des modèles de Buchanan et al. (1997) et de Lindqvist et Westöö (2000) qui rattachent l'exposition à un seul aliment et de ceux de la FDA/FSIS (2001) qui prennent en compte une vaste gamme d'aliments prêts à consommer. Les modèles différaient également quant à l'estimation des plus grands nombres de Listeria ingérés. Dans la modélisation de Buchanan et. al (1997) et de Lindqvist et Westöö (2000), les doses les plus fortes présentes dans les aliments étaient de 104 UFC/g. En revanche, les modèles de la FDA/FSIS (2001) supposaient que lorsque 108 à 1010 portions par an étaient considérées, les doses maximales, dans les rares occasions où elles provoquaient la listériose, seraient supérieures de plusieurs ordres de grandeur (107 UFC/g). Ces différences dans les doses individuelles maximales présumées conduisent à des différences substantielles dans la relation dose-réponse dérivée, de sorte que L. monocytogenes est estimé beaucoup moins virulent dans le modèle de la FDA/FSIS (figure 1).
La validité de cette approche dépend d'un certain nombre d'hypothèses et de sources d'information: le pourcentage d'individus sensibles à des infections graves causées par L. monocytogenes; l'adéquation du modèle exponentiel pour décrire la relation dose-réponse du pathogène chez les humains dans la gamme de doses considérée; l'évaluation de l'exposition et le nombre de L. monocytogenes ingérés; et la précision des statistiques sur le taux annuel de cas de listériose graves.
L'approche adoptée dans la présente étude est fondée sur les caractéristiques moyennes de la population, c'est-à-dire l'exposition estimée de la population humaine à une distribution de différentes souches, entraînant un certain nombre de maladies. Par conséquent, la variabilité observée dans la virulence est considérée au sens que les données et donc les valeurs r reflètent les caractéristiques moyennes de nombreuses souches de L. monocytogenes, y compris la fréquence des cas et l'importance de la virulence. De la même manière, le point terminal biologique (réponse) utilisé pour la relation dose-réponse est la listériose, ce qui implique que ce terme se réfère à une « infection grave » ou à une « listériose invasive », et comprend les individus infectés qui souffrent d'infections invasives parfois mortelles, telles que la listériose périnatale, la méningite ou la septicémie. Étant donné que l'incidence annuelle de la listériose comprenait toute la population désignée, dans cette approche de la modélisation dose-réponse, il est aussi tenu compte de la variabilité parmi les individus exposés au pathogène.
On a choisi le modèle dose-réponse exponentiel en raison de son applicabilité reconnue (c'est-à-dire son adéquation) pour modéliser la listériose grave, sa simplicité en tant que modèle à un seul paramètre et sa nature linéaire lorsqu'il est extrapolé à la fourchette des faibles doses examinée. L'équation est:
P = 1 -e-r*N
où P est la probabilité de maladie grave, N est la dose ingérée (le nombre de L. monocytogenes ingérés), et r est la probabilité qu'une seule cellule cause la maladie, qui définit la relation dose-réponse pour la population étudiée.
Le modèle exponentiel est un modèle sans limite fixée, ce qui implique qu'il n'y a pas de « dose infectieuse minimale ». Au contraire, le modèle suppose qu'une seule cellule de L. monocytogenes a une probabilité très petite mais bien définie de causer la maladie. Un attribut clé du modèle est sa linéarité et sa proportionnalité entre la dose et la probabilité de maladie à de faibles doses. Il s'ensuit que si l'on divise la dose par dix, la probabilité de contracter la maladie diminuera de dix fois. En outre, cela implique que, sauf à de très fortes doses, 1 000 portions ayant un niveau spécifié de contamination ont le même effet sur la santé publique que 10 000 portions contenant dix fois moins d'organismes. Un autre avantage découlant de l'emploi du modèle exponentiel à un seul paramètre est qu'une série de valeurs r pour différentes populations sensibles peut être calculée à partir des risques relatifs tirés d'études épidémiologiques.
Pour conduire la présente évaluation des risques, on a calculé des valeurs r spécifiques pour les populations moins sensibles (saines) et les populations plus sensibles, en partant de l'hypothèse que la consommation totale de L. monocytogenes était la même dans ces groupes. On y est parvenu en utilisant la distribution de la contamination alimentaire renforcée du projet de modèle de l'exposition de la FDA/FSIS 2001 conjointement avec le nombre de cas de listériose par an estimé par le CDC (Mead et al., 1999) en tant que pourcentage de la population totale des deux groupes plus ou moins sensibles au sein de la population des États-Unis d'Amérique. Cela a fourni des valeurs pour P et N, de sorte que la valeur r pouvait être calculée en réarrangeant et en résolvant l'équation ci-dessus (voir la réponse à la question 2 au chapitre 6).
Mathématiquement, la valeur r est considérée comme un paramètre constant pour une population spécifiée. Néanmoins, la précision de l'estimation de la valeur dépend de l'effectif et de la globalité de la population étudiée, de la précision des statistiques annuelles sur les maladies, de la fiabilité des données sur la fréquence et l'ampleur de la contamination des aliments par L. monocytogenes. L'incertitude associée à la valeur r comprenait des estimations de l'incertitude dans les données utilisées pour obtenir la constante. Les estimations de l'incertitude pour le pourcentage de la population à risque accru vont de 15 pour cent à 20 pour cent de la population totale. Les estimations de l'incertitude dans le pourcentage de cas totaux dans les statistiques annuelles de la maladie associées à la population de plus en plus sensible sont de l'ordre de 80 pour cent à 98 pour cent, et la gamme d'incertitude dans le nombre total de cas de listériose aux États-Unis d'Amérique se situerait entre 1 888 et 3 148 cas (2 518 cas ±25 pour cent). Les valeurs r dérivées avec des incertitudes estimées ont ensuite été déterminées à l'aide de la simulation de Monte Carlo. Ainsi, bien que la valeur r soit mathématiquement constante, en raison de l'incertitude dans son estimation, les valeurs réelles utilisées dans le calcul de la courbe dose-réponse étaient une distribution fondée sur les incertitudes estimées.
Dans le projet d'évaluation des risques de la FDA/FSIS (2001), on a estimé le nombre total de portions à chacun des cinq différents niveaux de dose pour un certain nombre d'aliments prêts à consommer. La limite supérieure du niveau de dose le plus élevé, c'est-à-dire la dose maximale de L. monocytogenes dans une portion individuelle, est incertaine et peut varier pour les différents types d'aliments. Des limitations dans les bases de données sur la contamination ne permettent pas de résoudre cette question. Toutefois, les doses maximales de L. monocytogenes enregistrées dans des portions individuelles des différents aliments influent sensiblement sur la dose moyenne ingérée calculée. Celle-ci à son tour influe sur la valeur r dérivée et la courbe dose-réponse qui en résulte. On a donc examiné en détail cette hypothèse. On a estimé les valeurs r pour quatre estimations de points pour des doses maximales de 7,5, 8,5, 9,5 et 10,5 log10 UFC, respectivement. Plus la dose maximale supposée était faible, plus la valeur r estimée était élevée. Plus la valeur r était élevée, plus la virulence supposée de L. monocytogenes était forte. En outre, pour utiliser des estimations de point pour les doses maximales de L. monocytogenes, on a aussi calculé les valeurs r pour les populations sensibles et les populations saines en utilisant les techniques de simulation de Monte Carlo, dans lesquelles on a remédié à l'incertitude dans la dose maximale en combinant tous les niveaux de doses précédentes en une seule distribution uniforme discrète.
Comme il a été expliqué dans les sections précédentes, les données disponibles sur la contamination et épidémiologiques ne permettent pas de faire un choix sans équivoque des valeurs r les plus appropriées pour différentes populations. En conséquence, l'équipe d'évaluateurs des risques, en consultation avec le groupe d'experts internationaux, a utilisé les valeurs r présentées au tableau 2 pour illustrer divers attributs associés à l'évaluation des risques et répondre aux questions posées par le CCFH.
Pour la question 1 du CCFH, qui concernait le risque encouru en consommant différents nombres de L. monocytogenes, une valeur r de 5,85 ´ 10-12 a été utilisée pour la population sensible. Il s'agissait de la courbe dose-réponse la plus « prudente » (c'est-à-dire qu'elle attribue la plus grande virulence à L. monocytogenes) utilisée dans la présente évaluation des risques et calculée en supposant que la dose individuelle maximale dans l'évaluation de l'exposition de la FDA/FSIS (2001) était de 7,5 log10 UFC par portion.
Pour montrer comment estimer les valeurs r sur la base des risques relatifs pour différentes sous-populations sensibles dans la question 2, on a choisi une valeur r de 5,34 ´ 10-14 comme valeur de référence pour la population générale saine. Cette valeur r a été calculée sur la base d'une hypothèse pour une dose individuelle maximale intermédiaire de 8,5 log10 UFC par portion, dans les aliments.
Pour les exemples d'aliments donnés dans l'évaluation des risques et la question 3 du CCFH, les valeurs r utilisées étaient fondées sur l'emploi des techniques de simulation de Monte Carlo associées à une distribution uniforme discrète (voir la section précédente) dans laquelle le nombre maximal de L. monocytogenes ingérés variait de 7,5 à 10,5 log10 UFC par portion. Ces courbes dose-réponse et leurs intervalles de confiance sont décrits à la figure 2.
En résumé, un modèle dose-réponse exponentiel a été utilisé dans l'évaluation des risques. Le modèle contient un paramètre, r, qui est la probabilité qu'une seule cellule causera une listériose invasive. On a estimé ce paramètre (valeur r) par l'association des modes de consommation de la population (exposition) avec des données épidémiologiques sur le nombre de cas de listériose dans la population. La valeur r estimée, qui variera selon les séries de données utilisées et les hypothèses formulées, a donc été utilisée dans le modèle exponentiel pour estimer les risques spécifiques donnés N, le nombre de L. monocytogenes consommés.
Tableau 2. Valeurs r utilisées dans l'évaluation des risques pour répondre aux questions du CCFH.
|
Utilisées pour la question |
Population |
Médiane |
5% percentile |
95% percentile |
|
1 |
Sensible(1) |
5,85 ´ 10-12 (4) |
||
|
2 |
Saine(2) |
5,34 ´ 10-14 (4) |
||
|
3 et les quatre exemples d`aliment |
Sensible(3) |
1,06 ´ 10-12 |
2,47 ´ 10-13 |
9,32 ´ 10-12 |
|
Saine(3) |
2,37 ´ 10-14 |
3,55 ´ 10-15 |
2,70 ´ 10-13 |
Notes: (1) calculées en supposant une dose maximale de 7,5 log10 UFC par portion. (2) Calculées en supposant une dose maximale de 8,5 log10 UFC par portion. (3) On a supposé que le niveau des doses maximales de L. monocytogenes dans les aliments variait uniformément entre 7,5 et 10,5 log10 UFC par portion. (4) Utilisée comme estimations de points.
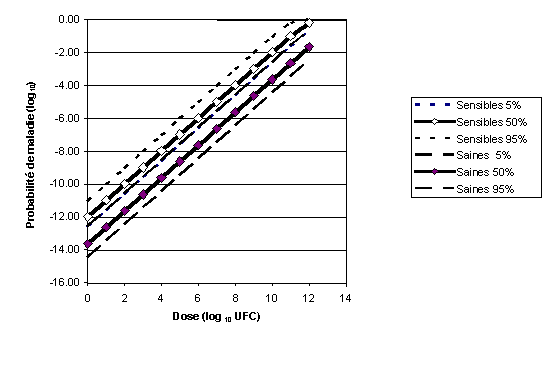
Figure 2. Comparaison des courbes dose-réponse pour les populations sensibles et les populations saines. La moyenne (50 pour cent) et les niveaux d'incertitude de 5 pour cent et 95 pour cent sont indiqués.
Note: Les lignes des 5 pour cent sensibles et des 95 pour cent saines ne peuvent être distinguées.