En la década del 60 se introdujeron en Cuba especies de carpas que responden a los nombres comunes de:
| Carpa común | Cyprinus carpio |
| Carpa cabezona | Aristichthys nobilis |
| Carpa plateada | Hypophthalmi chthys molitrix |
| Carpa herbívora | Ctenopharyngodon idella |
que integran un grupo conocido genéricamente en Cuba como ciprínidos.
A partir de la fecha de introducción se inició el proceso de transferencia de tecnología para lograr las producciones masivas de estas especies.
Las experiencias adquiridas a lo largo de estos años han permitido crear normas de trabajo para las estaciones de producción de alevines de ciprínidos.
Las etapas que se consideran son las siguientes:
Este paso es fundamental en el proceso de obtención de descendencia, ya que de la cantidad y calidad de los reproductores dependerá la de la cría a obtener. Las normas fundamentales de esta etapa, así como las de mantenimiento del banco de reemplazo se muestran en el Cuadro 13.
Indices fundamentales de mantenimiento de reproductores y reemplazo en estaciones productoras de ciprínidos en Cuba
| Indice | Unidad | Especies | ||||
| C.P. | C.CA. | C.H. | C.C. | |||
| Relación hembra macho | u | 2:1 | 1:1 | 2:1 | 1:1 | |
| Magnitud de la reserva de reproductores | % | 100 | 100 | 100 | 100 | |
| Edad del primer desove | ||||||
| útil: | Hembras | años | 2,5 | 3,0 | 2,5 | 1,0 |
| Machos | 2,0 | 2,5 | 2,0 | 1,0 | ||
| Peso del primer desove | ||||||
| útil: | Hembras | kg | 4,0 | 7,0 | 5,0 | 2,0 |
| Machos | kg | 3,0 | 6,0 | 4,0 | 1,0 | |
| Vida útil de los reproductores | años | 3 | 3 | 3 | 4 | |
| Densidad de siembra de reemplazo de un año (policultivo) | u/ha | 500 | 350 | 350 | 300 | |
| Densidad de siembra de reemplazo de dos años (policultivo) | u/ha | 200 | 150 | 100 | 200 | |
Simbología: C.P.: carpa plateada;
C.CA.: carpa cabezona;
C.H.: carpa herbívora;
C.C.: carpa común
Por razones de aprovechamiento del alimento natural de los estanques, se emplea siempre el método de policultivo, que permite incrementar la densidad de siembra debido al uso diferencial de los distintos nichos ecológicos de cada una de las especies.
Con sólo una hectárea de estanque dedicado al mantenimiento de reproductores, es posible producir larvas para más de 30 ha de estanques de crecimiento. Por ello, el cuidado de los reproductores y reemplazo tiene una importancia especial.
Se ha demostrado que en las condiciones climáticas de Cuba es posible obtener, al menos, tres desoves anuales de carpas (Uliver et al., 1986). Se adoptó el sistema de inducción del desove en instalaciones creadas al efecto, conocidas como salas de incubación (Figuras 16–18).
En estas áreas reproductivas se realiza el proceso de inyección, mantenimiento de los reproductores, obtención de huevos y esperma, fertilización, incubación y obtención de larvas, por lo que constituyen el corazón de la estación (Damas et al., 1986).
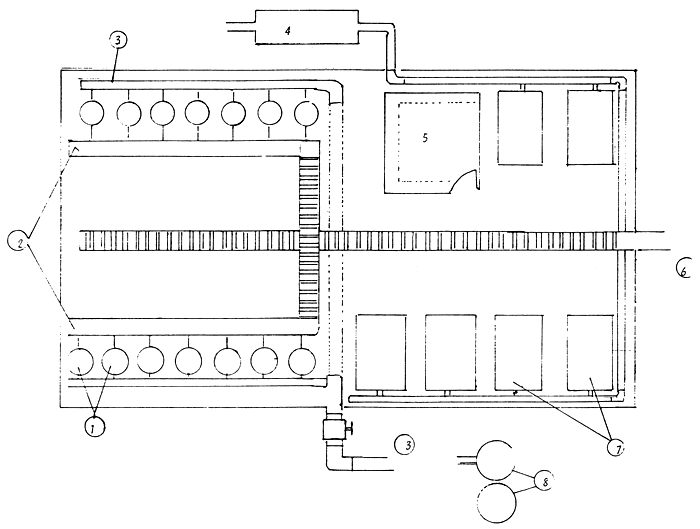
Actualmente se emplea el método seco de fertilización y la incubación se produce en unidades del tipo “Amur” de 200 litros de capacidad, según lo escrito por Millares et al. (1983). En la Figura 19 se presenta el esquema de una estación típica de ciprínidos en la isla.
En los Cuadros 12–15 se pueden observar las normas de trabajo del área de reproducción, en los estanques de pre-desove, mantenimiento de reproductores durante el tratamiento hormonal, obtención de los productos sexuales, incubación de huevos y mantenimiento de larvas, respectivamente (Salazar y González, 1986).
Con el propósito de asegurar una mayor supervivencia de las larvas se ha normado un período de cría preliminar de los peces una vez extraídos de las incubadoras. La siembra de estas larvas en pequeños estanques de tierra les asegura un mejor acceso al alimento natural, un mejor control de los insectos acuáticos en su actividad depredadora y un incremento posterior de su tasa de crecimiento. En el Cuadro 18 se pueden observar las características fundamentales del proceso.
Al pescar las larvas de los estanques de pre-cría, se transfieren a los estanques de crecimiento donde alcanzan la talla de repoblación. Aquí nuevamente se utiliza un sistema de policultivo de todas las especies (Camejo et al., 1980, 1986). En el Cuadro 17 se muestran los parámetros fundamentales. Una vez concluida la etapa de crecimiento se efectúa la pesca de los estanques y la repoblación siguiendo una técnica similar a la empleada con la tilapia.
(a) El traslado de peces se lleva a cabo sólo después de ser autorizado por el ictiopatólogo responsable y después de un examen preliminar de los peces (Anon., c).
(b) El examen preliminar consiste en un análisis clínico de una muestra representativa que abarca el siguiente número:
5 peces en el caso de los reproductores,
10 a 15 cuando se trata de alevines,
25 cuando son larvas,
100 a 200 huevos.
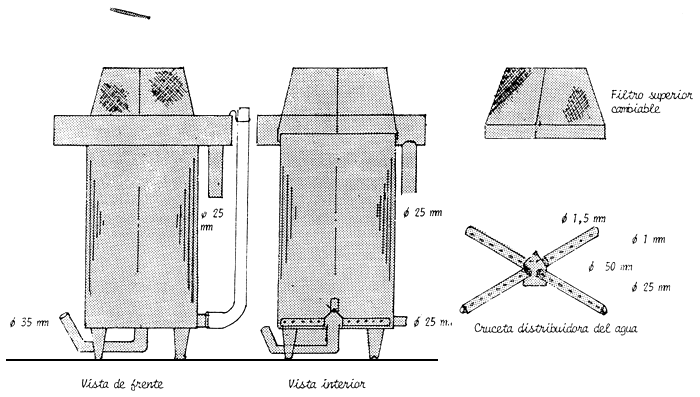
Figura 16 Aparato incubador de metal o plástico de uso múltiple
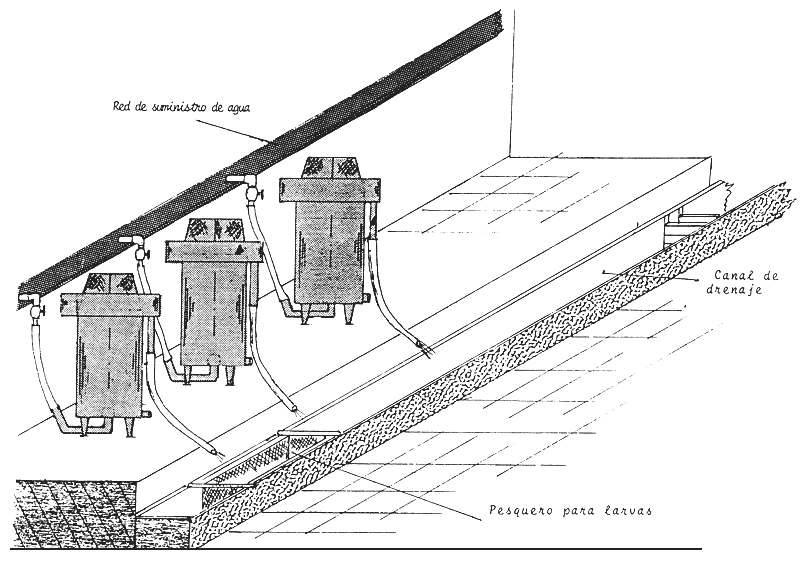
Figura 17 Esquema de la colocación de los aparatos de incubación en la sala de desove
1 = Incubadoras
2 = Canal de drenaje
3 = Red de suministro
4 = Filtro de agua
5 = Laboratorio
6 = Canal central de drenaje
7 = Tanque para el mantenimiento de los reproductores
8 = Tanque suministro de agua
Figura 18 Esquema de la distribución interna de la sala de incubación
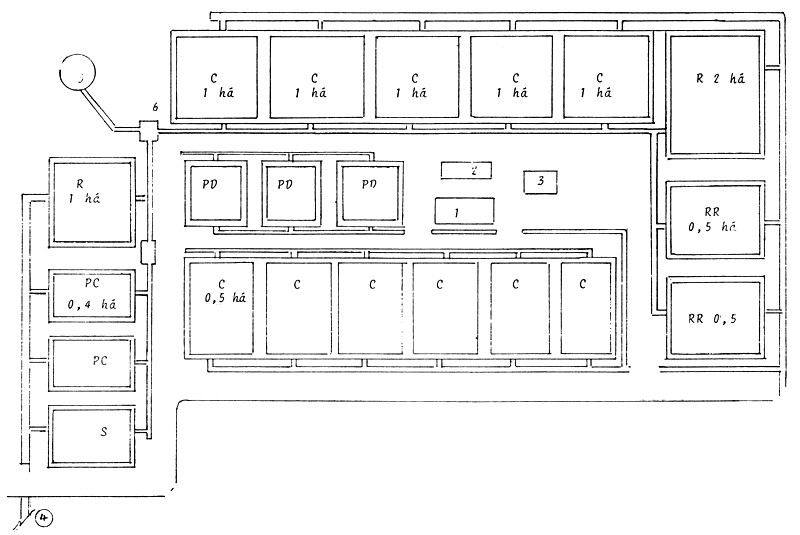
| Simbología: | ||
| 1.R = Est. reproductores | R = Reemplazo | 5 = Estación de bombeo |
| C = Est. crecimiento alevines | S = Sanitario | |
| 1 = Sala incubación | 6 = Caja reguladora | |
| PD = Est. pre-desove | ||
| PC = Est. pre-cría | 2 = Laboratorios | |
| 3 = Almacén | ||
| 4 = Canal de drenaje |
Figura 19 Esquema de una estación de ciprínidos en Cuba
Cuadro 14
Normas de trabajo para la reproducción artificial de ciprínidos. Obtención de productos sexuales, inseminación, desgome de huevo e incubación
| Indice | Unidad | Especies | ||||
| C.P. | C.CA. | C.H. | C.C. | |||
| Fecundidad | miles huevos | 500 | 500 | 500 | 300–500 | |
| Cantidad de esperma necesaria para un litro de huevos | ml/lit. | 3–5 | 3–5 | 3–5 | 3–5 | |
| Fecundación de los huevos | % | 70 | 70 | 70 | 70 | |
| Dosis de las sustancias para el desgome de los | ||||||
| huevos: | Talco industrial | g/lit. | - | - | - | 10 |
| Leche de vaca | ml/lit. | - | - | - | 100 | |
| Tipo de incubadora | “AMUR” para todas las especies | |||||
| Número de huevos/incubadora | mm | 1 000 | 1 000 | 1 000 | 1 000 | |
| Flujo de agua/incubadora | lit./min | 8–12 | 8–12 | 8–12 | 14–16 | |
| Supervivencia de los huevos durante la incubación | % | 50–55 | 50–55 | 50–55 | 50–55 | |
| Período de incubación de acuerdo a la temperatura | ||||||
| 23°– 24°C | horas | 24–26 | 14–16 | 24–26 | 72 | |
| 25°–26°C | 20–22 | 20–22 | 20–22 | 60 | ||
| 27°–28°C | 17–18 | 17–18 | 17–18 | 48 | ||
Cuadro 15
Normas de trabajo para la reproducción artificial de ciprínidos. Estanques de predesove
| Indice | Especies | |||||
| Unidad | C.P. | C.CA. | C.H. | C.C. | ||
| Area | m2 | 500–5 000 | 500–5 000 | 500–5 000 | 500–5 000 | |
| Profundidad media | m | 1,5 | 1,5 | 1,5 | 1,5 | |
| Densidad de siembra | ||||||
| Hembras | u/h | 1 000 | 1 000 | 1 000 | 300 | |
| Machos | 1 000 | 1 000 | 1 000 | 500 | ||
| Temperatura óptima del agua | °C | 22–26 | 22–26 | 22–26 | 22–26 | |
Simbología: C.P.: carpa plateada;
C.CA.: carpa cabezona;
C.H.: carpa herbívora;
C.C.: carpa común
Normas de trabajo para la reproducción artificial de ciprínidos. Mantenimiento de los reproductores durante el tratamiento hormonal
| Indice | Unidad | Especies | ||||
| C.P. | C.CA. | C.H. | C.C. | |||
| Relación hembra-macho | u | 1:1 | 2:3 | 2:1 | 2:1 | |
| Volumen del recipiente para mantenimiento de los reproductores | m3 | 3,6 | 3,6 | 3,6 | 3,6 | |
| Densidad de mantenimiento de los peces durante la inducción | kg/m3 | 20 | 20 | 20 | 30 | |
| Flujo de agua por 100 kg peces | lit./seg. | 6 | 6 | 6 | 6 | |
| Dosis total de hipófisi de carpa, fraccionada en 12 horas | mg/kg | |||||
| Hembras | 5 | 5 | 5 | 3–4 | ||
| Machos | 1 | 1 | 1 | 2 | ||
| Dosis total de gonadotropina coriónica humana fraccionada en 12 horas | u.i/kg | |||||
| Hembras | ||||||
| Machos | ||||||
| Indice de respuesta a la inducción | % | 80 | 80 | 80 | 85 | |
| Tiempo para la obtención de los productos sexuales | horas | |||||
| 22°–22,5°C | 10,5 | 10,5 | 10,5 | 14 | ||
| 23°–23,5°C | 9,5 | 9,5 | 9,5 | 12 | ||
| 24°–24,5°C | 8,5 | 8,5 | 8,5 | 10 | ||
| 25°–25,5°C | 7,5 | 7,5 | 7,5 | 8 | ||
| 26°–26,5°C | 6,5 | 6,5 | 6,5 | 6 | ||
| 27°–27,5°C | 6,0 | 6,0 | 6,0 | 6 | ||
Simbología: C.P.: carpa plateada;
C.CA.: carpa cabezona;
C.H.: carpa herbívora;
C.C.: carpa común
Normas de trabajo para la reproducción artificial de ciprínidos. Mantenimiento de larvas en las incubadoras
| Indice | Unidad | Especies | ||||
| C.P. | C.CA. | C.H. | C.C. | |||
| Densidad | ml/lit | 8–10 | 8–10 | 8–10 | 10 | |
| Flujo de agua | lit./min | |||||
| 24°C | 16 | 16 | 16 | 16 | ||
| 28°C | 14 | 14 | 14 | 14 | ||
| Supervivencia | % | 75 | 75 | 75 | 85 | |
| Duración del mantenimiento de las larvas en dependencia de la temperatura | ||||||
| 22°–23°C | horas | 90 | 90 | 90 | 48 | |
| 24°–25°C | 60 | 60 | 60 | 44 | ||
| 26°–27°C | 48 | 48 | 48 | 40 | ||
| 28°–29°C | 36 | 36 | 36 | 36 | ||
| Producción final de larvas por hembra | miles | 150 | 150 | 150 | 100 | |
Simbología: C.P.: carpa plateada;
C.CA.: carpa cabezona;
C.H.: carpa herbívora;
C.C.: carpa común
Normas para la cría preliminar de larvas de ciprínidos
| Indice | Unidad | Especies | |||
| C.P. | C.CA. | C.H. | C.C. | ||
| Area del estanque | ha | Desde 0,001 hasta 1,0 | |||
| Profundidad media del estanque | m | " 0,8 hasta 1,0 | |||
| Densidad de siembra de las larvas | millón ha | 4 | 4 | 4 | 3 |
| Duración del período de pre-cría | días | De doce a quince días | |||
| Supervivencia de las larvas | % | De 60 a 70 | |||
| Peso promedio final de las larvas | mg | No menor de 30 | |||
Simbología: C.P.: carpa plateada;
C.CA.: carpa cabezona;
C.H.: carpa herbívora;
C.C.: carpa común
Cuadro 19
Normas de crecimiento de alevines de ciprínidos en base al alimento natural
| Indice | Unidad | Especies | |||
| C.P. | C.CA. | C.H. | C.C. | ||
| Producción pesquera total | t/ha | 2,5 | |||
| Densidad de siembra de larvas después de la pre-cría | mil/ha | 70 | 30 | 15 | 30 |
| Supervivencia | % | 65 | 65 | 65 | 65 |
| Tiempo de cultivo | días | 75 | 75 | 75 | 75 |
| Peso promedio de los alevines | g | 20 | 20 | 20 | 20 |
Simbología: C.P.: carpa plateada;
C.CA.: carpa cabezona;
C.H.: carpa herbívora;
C.C.: carpa común
(c) Si se detectan peces parasitados, sólo se autorizará, después de comprobar la efectividad del tratamiento terapéutico correspondiente.
(d) Se prohibe el traslado de peces de instalaciones afectadas con enfermedades infecciosas de etiología desconocida.
Debido a que nuestro país se ha convertido en un importador de especies exóticas, con el riesgo de introducción de enfermedades que esto conlleva, existen medidas excepcionales de cuarentena para estas situaciones.
(a) El período de cuarentena de peces importados será por un tiempo no menor de 21 días, de acuerdo con la especie, período de incubación de la enfermedad y mecanismo de transmisión (Anon., d).
(b) Antes del inicio de la cuarentena, y al concluirla, los peces se someterán al control ictiopatológico. Sólo se levantará la cuarentena con la autorización expresa del Departamento de Ictiopatología.
(c) Si, durante el período cuarentenario, surgieran enfermedades infecciosas u otras de etiología desconocida, se incinerarán todos los peces, se tratará el agua con desinfectante y se dejará de utilizar el estanque por un período no menor de tres meses.
La prevención de enfermedades debe ocupar un lugar fundamental, ya que de esta forma se evita el riesgo de grandes pérdidas, o tener que aplicar costosos medicamentos para salvar peces valiosos.
En Cuba se presta una atención preferente a la labor de prevención o erradicación de enfermedades por la repercusión que esto puede tener en las repoblaciones de embalses. Por ello cada estación productora de semilla cuenta con el personal calificado en esta rama y con un conjunto de medidas de obligatorio cumplimiento para asegurar la calidad sanitaria del material de siembra (Anon., c).
A continuación se resumen los aspectos fundamentales que se aplican en la prevención y erradicación de enfermedades.
(a) Es obligatoria la desinfección a estanques, cajas de traslado, artes de pesca e instrumentos de muestreos.
(b) Antes de la desinfección se realizará una limpieza esmerada con el objetivo de eliminar la materia orgánica remanente.
(c) Los desinfectantes se aplicarán de manera regular en solución acuosa a cada parte de los estanques o inventario piscícola en uso; parte del cual se muestra en la Figura 20.
Los principales desinfectantes que se utilizan, así como las dosis, se muestran a continuación:
| Desinfectantes | Dosis |
| Cal viva | 1 litro de solución al 10 % por metro cuadrado de estanque |
| Soda cáustica | Solución caliente al 2–4 % |
| Formaldehído | Solución caliente al 1–2 % |
| Cal clorada | Solución al 2–5 % |
| Hipoclorito de sodio | Solución al 2–3 % |
Si, a pesar de las medidas profilácticas aplicadas, surge una enfermedad y si el valor de los peces es suficientemente alto como para efectuar una inversión en reactivos o medicamentos, se procede a la aplicación de los mismos (Anon., d).
En Cuba se aplican tres tipos fundamentales de tratamientos:
(a) tratamientos externos: los peces se sumergen en una solución curativa por el tiempo requerido para la terapía.
Equipo versátil de gran utilidad en las estaciones piscícolas. Se emplea en el traslado de reproductores y alevines, así como para la fertilización química, también en la desinfección tanto con cal como con formol. Está dotado de aire comprimido y turbina centrífuga para esparcir los líquidos
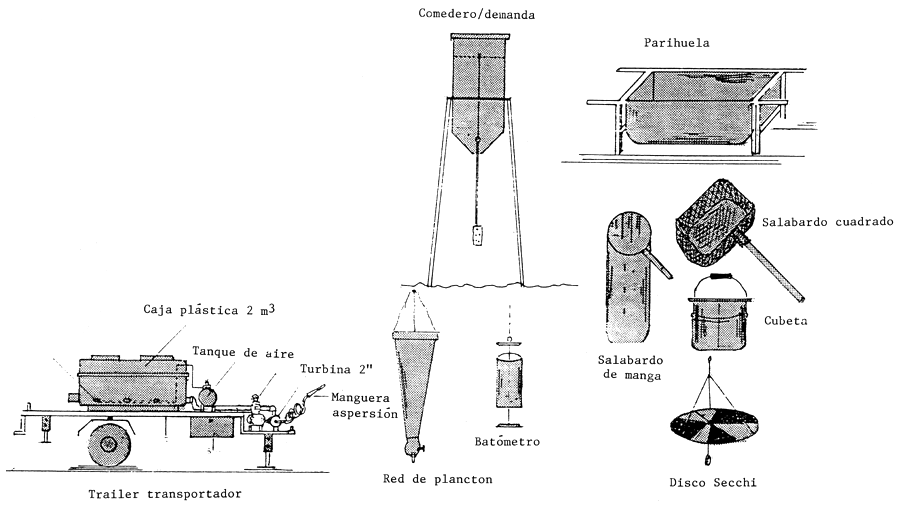
Figura 20 Medios de desinfección y artículos del inventario piscícola
(b) Tratamiento sistemático con la dieta: se aplica a las especies que consumen alimento artificial, mediante la inclusión en la misma del medicamento indicado.
(c) Inyecciones: sólo se aplican a reproductores o especies de alto valor.
En el Cuadro 20 se ha resumido la información respectiva.
Cuadro 20
Tratamientos profilácticos y terapéuticos aplicables a determinadas enfermedades de los peces en Cuba
| Enfermedad | Medicamento | Tiempo | Observaciones |
| Dactylogyrosis | Agua amoniacal al 25 % 1 ml/lit. | 30 seg | Se renueva la solucióncada 15 min. No aplicar con temperaturas mayores de 29°C |
| Formaldehído al 37–38 % (0,25 ml/lit) | 15–20 min. | Idem | |
| Dipterex 80 0,7 mg/lit. | 24 h | - | |
| Tricodiniasis y Scyfidiariasis | Agua amoniacal al 25 % (1 ml/lit.) | 40 seg | Idem |
| Verde malaquita | |||
| 0,09 mg/lit. | 24 h | Con aireación | |
| 0,35 mg/lit. | 5 h | " " | |
| Sal común 15 g/lit. | 5 min | " " | |
| Ictioftiriasis | Verde malaquita 0,05 mg/lit. más formaldehido 0,025 ml/lit. | 3 aplicaciones días alternos | " " |
| Chilodoneliasis | Verde malaquita 0,09 mg/lit. | 24 h | " " |
| Botriocefalosis | Niclosamida 1 g/kg alimen. | 7 días | Una dosis diaria |
| Neoergasilosis | Permanganato de potasio 0,01 mg/lit. | 1 h | Con aireación. No usar recipientes metálicos |
| Dipterex 80 0,4 mg/lit. | 7 días | - | |
| Lerneasis | Dipterex 800,4 mg/lit. | 15 días | 3 aplicaciones, una cada 5 días |
| Saprolegniasis | Permanganato de potasio 0,01 mg/lit. | 15–20 min | Con aireación |
| Verde malaquita 5 mg/lit. | 30 min | Para huevos | |
| Enfermedades bacterianas | Cloranfenicol 10 mg/lit. | 7 días | |
| 1 g/kg alimento | 7 días | ||
| 30 mg/kg pez | 1 día | Inyección | |
| Sumetrolin 30 mg/kg pez | 1 día | " |
El proceso de enriquecimiento de las aguas con nutrientes que incrementan la producción de alimento natural es conocido con el nombre de fertilización.
Aunque la cantidad y tipo de fertilizantes a añadir al agua depende, en primer lugar de la cantidad de nutrientes de la fuente natural y del sedimento, ha sido posible crear dosis estándar sobre la base del conocimiento empírico y de algunos resultados de investigaciones realizadas en Cuba (Anon., c).
Condiciones del suelo: el parámetro fundamental a tener en cuenta es el pH del mismo, ya que es conocido que los terrenos acídicos imposibilitan la implantación de una trama alimentaria adecuada, si el pH es menor de 7, se produce el encalamiento de los estanques de acuerdo al Cuadro 21.
Cuadro 21
Tratamiento con cal para el control de pH
| pH del suelo | Cal viva CaO | Cal hidratada Ca(OH)2 | Caliza Ca2 CO3 |
| 4,0 | 2 000 | 2 600 | 3 600 |
| 4,5 | 1 500 | 1 950 | 2 700 |
| 5,0 | 1 000 | 1 300 | 1 800 |
| 5,5 | 500 | 650 | 900 |
| 6,0 | 300 | 350 | 550 |
Unidad de medida: kg/h
El estanque debe estar libre de vegetación, removiéndose el fondo del mismo una vez al año para facilitar la descomposición de los sedimentos y la mineralización de la materia orgánica.
Condiciones de iluminación: la fertilización se hará en días soleados. Esto es requisito fundamental para el incremento de la actividad fotosintética. De lo contrario, el efecto deseado se retarda.
Condiciones del agua: se debe asegurar que el pH sea neutro o ligeramente alcalino (7–9) para lograr la mayor efectividad.
La cantidad de agua que tendrá un estanque para efectuar la primera fertilización debe ser menor que la mitad de la columna total del agua cuando está lleno.
Fertilizantes minerales o inorgánicos
Se recomienda utilizar las siguientes combinaciones:
| Fertilizantes | Dosis |
| Nitrato de amonio + Surperfostato simple | 50 kg/ha |
| Urea + Surperfostato simple | 70 kg/ha cada uno |
| Urea + Surperfostato triple | 70 kg/ha y 35 kg/ha respectivamente |
Fertilizantes orgánicos
La aplicación de este tipo de fertilizantes puede ir sóla o en conjunción con los inorgánicos; depende de la riqueza en materia orgánica de la fuente de agua y del sedimento del estanque. En general su aplicación se realiza de la siguiente forma:
(a) Si la fuente de agua es un río, embalse o laguna se escogerá una de las siguientes alternativas:
Gallinaza: 1 t/ha
Estiércol porcino: 0,5 t/ha
Hierba seca: 1 t/ha (amarrada en haces)
(b) Si la fuente de agua es un pozo:
Gallinaza: 2–3 t/ha
Estiércol porcino: 1–2 t/ha
Hierba seca: 2–3 t/ha
Aunque pueden existir diversas formulaciones para el control del nivel de nutrientes en el agua, un método rápido es a través del disco de Secchi. Como criterio de re-aplicación de nuevas dosis de fertilizantes se ha tomado la transparencia. Cuando ésta supera los 50 cm se añaden nuevamente los fertilizantes señalados anteriormente, pero en esta ocasión a la mitad de la dosis registrada. Esto es suficiente para mantener una población fito y zooplanctónica adecuada.
Este método, cuya exactitud es cuestionable debido a la presencia de sólidos en suspensión, ha demostrado ser válido en el momento de decidir aplicaciones sucesivas de fertilizantes.
Durante el período de cría de los alevines y/o reproductores, se evita, en la medida de lo posible, circular grandes volúmenes de agua en los estanques para disminuir el arrastre de los nutrientes. Si las condiciones hidroquímicas del estanque, especialmente el nivel de oxígeno disuelto, empeoran entonces se suministra agua.
El método de fertilización que se sigue en Cuba es susceptible de ser mejorado. No obstante, bajo las condiciones climáticas y de calidad de agua del país, este sistema ha demostrado ser eficiente tanto biológicamente como económicamente.
En cualquier tipo de estanque explotado con fines piscícolas, es obligatorio realizar diariamente el control de la calidad del agua, guiándose por los siguientes parámetros: temperatura, contenido de oxígeno, concentración de iones de hidrógeno, transparencia y color.
Los muestreos se realizan una vez al día, por la mañana temprano.
Con respecto al lugar del muestreo se hace en la parte más profunda del estanque, cerca de la exclusa. La temperatura y el oxígeno se determinan obligatoriamente en dos horizontes: cerca de la superficie del agua y cerca del fondo del estanque.
Si la profundidad máxima del estanque es de más de 1,5 m, estos parámetros se determinan en tres horizontes: en la capa superior, media e inferior del agua.
En caso de observarse los valores de los parámetros hidroquímicos desviados de las normas establecidas es necesario tomar las muestras dos veces al día, por la manaña y la tarde.
En estos casos las muestras se toman en varios puntos del estanque, iniciando el trabajo en la exclusa y terminándolo en la región de suministro de agua en el estanque.
Muy importante cuando se observe la desviación constante de los parámetros hidroquímicos (por más de 2 días), se apliquen inmediatamente las medidas corespondientes para mejorar y cambiar la situación en el estanque. Esto se hace sobre la base del análisis de los datos existentes y a partir de la decisión conjunta del piscicultor, el hidroquímico y el hidrobiólogo de la estación.
En el Cuadro 22 se muestran los valores óptimos, mínimos y máximos de los principales parámetros hidroquímicos, las características de éstos y las recomendaciones de las medidas que se aplican para evitar o mejorar las situaciones de gravedad en los estanques.
Cuadro 22
Guía para el control de los principales parámetros físico-químicos
| Parámetros | Optimo | Valores Mínimo | Máximo | Características Recomendaciones y Medidas |
| Temperatura °C | 24 | 30 | En el caso de observar una diferencia de 2°C entre la superficie y el fondo aplicar circulación de agua. | |
| Contenido de oxígeno (mg/lit.) | 5–9 | 3 | 10 | Junto a la disminución del oxígeno se detiene el crecimiento de los peces, no consumen alimento y pueden morir. Medidas: no suministrar alimento, circular abundante agua y colocar aireación. |
| Alto contenido de oxígeno indica la ausencia de la interacción de las capas superiores e inferiores del agua. Medidas: reponer el agua del estanque, colocar aireación, eliminar macrófitos existentes en el estanque. | ||||
| pH | 6,5–8,6 | 6 | 11 | El valor bajo del pH indica acidez del medio acuático, acumulación de las sales disueltas y carencia de calcio. Medidas: introducción del cal. El pH alto disminuye la base alimentaria natural, provoca la quemadura de las branquias y la piel de los peces. Medidas: circular y reponer el agua del estanque. |
| Transparencia (fracción de la profundidad del estanque) | ½ | ⅓ | ⅔ | El valor mínimo indica el desarrollo abundante de algas. Esta situación puede conducir a la toxicosis y la mortalidad de los peces. Medidas: reducir la cantidad de alimento suministrado, circulación del agua, aireación. |
| Valor máximo de la transparencia indica la carencia de alimentos naturales. Medidas: introducción de fertilizantes inorgánicos. | ||||
| Amoniaco (mg/lit.) | 0,01–0,07 | 0,1 | El amoníaco es venenoso para los peces, cuando el pH es 8,5–9,0 y la temperatura más de 18°C. Existe la amenaza de la toxicosis, afectando las branquias de los peces. Medidas: eliminar la contaminación orgánica, o sea suspender la alimentación y la introducción de abonos orgánicos. | |
| Fosfatos (mg/lit.) | 0,2–0,5 | 2,0 | En cantidades normales asegura el desarrollo del fitoplancton. Tanto el déficit como el exceso de los fosfatos en el agua son dañinos para el plancton. Medidas: introducción de los abonos fosfóricos según las normas establecidas. | |
| Hierro total (mg/lit.) | 1,5–1,8 | 2,0 | El hierro es producido por el agua suministrada y por el suelo de los estanques. Medidas: aireación, sedimentación y uso de filtros. | |
| Cloruros (mg/lit.) | 25–40 | 200–300 | Contaminan el agua, provocan la intoxicación de los peces, parálisis del sistema nervioso y muscular, ruptura y quemadura del epitelio de las branquias. Medidas: descubrir y evitar la entrada de los cloruros en el estanque. | |
| NH3 y NO2 (mg/lit.) | 1 | 2 | Se producen como resultado del metabolismo de las proteínas de los peces o de la descomposición de la materia orgánica. NH3 puede ser altamente tóxico libre en 0,6 a 2 ppm, aumentando la toxicidad directamente con el pH y la T°Cdel agua. | |
| Dureza (ppm) | 20 | 300 | Es la medida del calcio y el magnesio en el agua expresa do en ppm, de CO3Ca. | |
| Color | 540–580 | 440 | 580–620 | El color gris verdoso (valores mínimos) indica la ausencia en el fito y el zooplancton. Medidas: introducción de fertilizantes inorgánicos. Los colores verde-amarillo y amarillo junto a la transparencia baja indican la ausencia de los elementos biogénicos (nitritos y nitratos, fosfatos, etc.). Medidas: circulación de agua, introducción de fertilizantes inorgánicos. |
| Oxidación agresiva (%) | 40–65 | 85 | Valores altos indican contaminación del agua con sustancias de fácil oxidación. Medidas: encalamiento, aireación, recambio del agua, limitar la alimentación. | |
| Gas carbónico CO2 (mg/lit.) | 10 | 30 | En grandes cantidades su influencia es dañina. El ambiente contaminado por las sustancias orgánicas provoca el aumento del CO2. Medidas: encalamiento, aireación y circulación de agua. | |
| DBO (1 mg O2/lit.) | 1,0–6,0 | 8,0 | Con valores altos se observa el déficit de oxígeno y la contaminación con los productos de la descomposición anaeróbica. En este ambiente los peces detienen el crecimiento. medidas: Circulación de agua, aireación. | |
| Gas sulfhídrico | (ausencia total) | Es venenoso para los peces. Al aparecer el olor de este gas, urgentemente se toman las siguientes medidas: encalamiento del estanque, especialmente en los lugares donde se les alimenta, recambio de agua. | ||
Otro aspecto relevante en la calidad del agua es el referido al control de la base alimentaria natural de los estanques.
La transparencia del agua es un indicador del desarrollo del fitoplancton.
Cuando el valor de la transparencia es de:
½ de la profundidad media del estanque, la biomasa del fitoplancton corresponde aproximadamente a 20–30 mg/lit., lo que asegura una alimentación normal y el crecimiento de los peces;
menos de ⅓ de la profundidad media, el desarrollo del fitoplancton es abundante. Se observa el florecimiento de algas lo que perjudica el régimen hidroquímico;
más de ⅔ de la profundidad media, el desarrollo del fitoplancton es mínimo o cero, lo que indica la pobreza del alimento natural para los peces.
El color del agua también caracteriza el desarrollo del fitoplancton:
color verde (valor 11–15 en la escala de Ule): indica la cantidad suficiente de los elementos biogénicos para el desarrollo normal de los organismos alimenticios;
color gris verdoso (valor menor de lo normal): junto a la transparencia baja, indica la acumulación de la materia orgánica y débil desarrollo del fitoplancton. En este caso es necesario analizar la concentración de oxígeno disuelto. Si el valor de este parámetro es bajo hay que introducir los fertilizantes inorgánicos. Si el valor es alto, hay que eliminar la materia orgánica, sedimentándola mediante encalamiento del estanque, al menos dos veces;
color amarillo verdoso (valor más alto de lo normal): junto a la transparencia alta indica déficit de los elementos biogénicos y débil desarrollo del fitoplancton. En este caso se introducen abonos minerales y orgánicos.
color amarillo verdoso; junto a la transparencia baja indica el déficit de los elementos biogénicos y la extinción paulatina de los organismos alimenticios.