Ces procédés qui consistent à traiter le milieu pour accroître la capacité des unités de transport et éviter des troubles physiologiques et sanitaires aux poissons sont constamment employés dans la solution des problèmes complexes liés au transport des poissons. Il s'agit entre autres, d'anesthésiques, de produits durcissant l'eau et favorisant la production d'oxygène, de substances bactériostatiques, de solutions tampons et d'antimoussants.
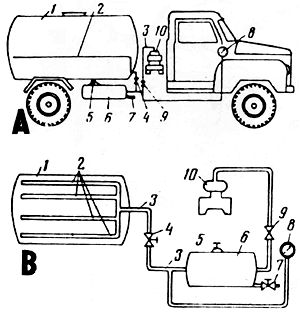
1 - cuve; 2 - tuyaux flexibles perforés pour l'amenée d'air; 3 - alimentation en air; 4 - régulateur de l'alimentation en air; 5 - soupape de sûreté; 6 - bac sous pression pour l'air; 7 - valve pour l'évacuation du condensat; 8 - manomètre; 9 - clapet de retenue; 10 - compresseur
Figure 41 Camion (A) équipé d'un système d'aération (B) (Mackevich et Shiyanov, 1984)
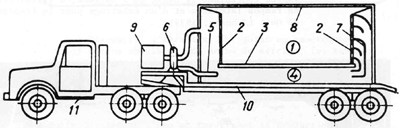
1 - espace réservé aux poissons; 2 - paroi grillagée; 3 - fond de l'espace réservé aux poissons; 4 - espace réservé au mixage de l'air et de l'eau; 5 - éjecteur; 6 - pompe centrifuge; 9 - moteur; 10 - remorque; 11 - véhicule tracteur
Figure 42 Camion soviétique pour le transport des poissons d'une contenance de 13 000 litres (Barekyan et al., 1975)

Figure 43 Véhicule d'une contenance de 2 227 litres pour le transport des poissons (BUCKINGHAM VEHICLES Ltd)

Figure 44 Véhicule pour le transport des poissons doté d'une installation d'alimentation en oxygène liquide, de valves contrôlant le débit de l'oxygène, d'agitateurs, de rampes latérales et d'un éclairage pour le transport de nuit (Johnson, 1979)

Figure 45 Camion pour le transport des poissons aux Etats-Unis, équipé des dispositifs permettant de contrôler la qualité de l'eau en cours de route

Figure 46 Semi-remorque utilisé par Bristol Channel Fisheries pour transporter des poissons vivants
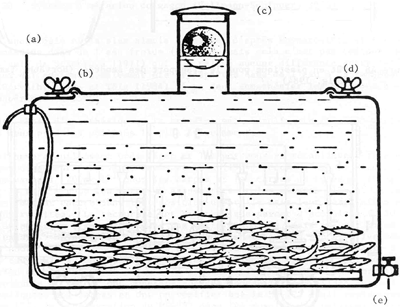
(a) Dispositif d'aération; (b) joint en caoutchouc; (c) dessus amovible; (d) écrou de serrage; (e) robinet de vidange
Figure 47 Bac spécial pour le transport des sandres (Vollmann-Schipper, 1975)
Il est souhaitable d'administer un sédatif aux poissons pendant le transport car ainsi ils consomment moins d'oxygéne et ne dégagent pas autant de CO2 et de NH3. Toutefois il faut éviter des doses trop fortes, car alors les poissons risquent de tomber au fond du bac, de s'empiler les uns sur les autres et de s'étouffer. Dans le cas où on utilise des pompes, ils risquent d'être pris dans la grille, d'être déplacés par l'air et de perdre des écailles. Le mieux est de verser le sédatif 30 minutes avant le chargement dans le conteneur et de n'administrer ensuite que de faibles doses au cours du transport. Recourir à des anesthésiques pour augmenter la capacité de charge ne convient pas. D'autres méthodes sont plus inoffensives et plus sûres. Il est illégal d'administrer des aneshtésiques à des poissons qui doivent aller peu après à la consommation humaine. Il faut toujours tenir compte des lois qui régissent les produits chimiques et des conséquences éventuelles de ces derniers pour les consommateurs.
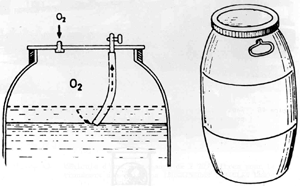
Figure 48 Fût en plastique pour le transport des sandres (Horváth, Tamás et Tölg, 1984)
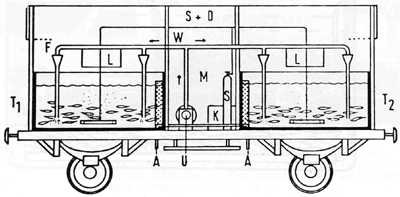
M - Cabine technique et de surveillance; U - pompe et compresseur; T - bacs de transport 1 et 2; S - bouteilles
Figure 49 Wagon spécialement aménagé pour le transport des poissons (Vollmann-Schipper, 1975)
L'anesthésie est en général réservée aux reproducteurs. On commence par leur administrer une dose normale de tranquillisant, puis on les met dans le bac de transport où on dilue la concentration initiale à 50 pour cent en ajoutant la même quantité d'eau douce. Le reproducteur reste en général bien tranquillisé dans cette solution diluée (Woynarowich et Horváth, 1980). Il est bon de faire des essais pour déterminer la dose qui convient au poisson en question. La sensibilité, la résistance et l'endurance varient d'un poisson à l'autre. Même des espèces qui sont très proches peuvent réagir très différemment sur ce point.
Il est déconseillé d'administrer des anesthésiques à de petits poissons transportés sur de courtes distances, car en pareils cas, l'espace a beaucoup plus d'influence sur la santé des poissons que l'accumulation de produits du métabolisme (Shevchenko, 1978).
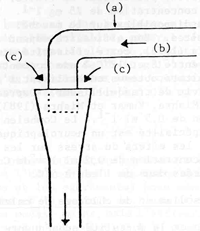
(a) Tuyau d'arrivée d'eau; (b) eau; (c) air
Figure 50 Système d'aération du wagon (Vollmann-Schipper, 1975)
La meilleure anesthésie et la plus simple consiste, d'après Woynarowitch et Horváth (1980), à transporter les poissons dans de l'eau froide (5–10°C), mais cela n'est pas toujours possible. C'est également l'avis de Strebkova (1971) qui n'a relevé aucune différence entre des poissons anesthésiés et ceux qui avaient simplement été transportés dans de l'eau à la température de 11–13°C. Selon, Horváth, Tamás et Tölg (1984) il ne faut anesthésier les poissons que lorsque la température est supérieure à 15°C.
Parmi le vaste choix d'anesthésiques, la tricaïne méthanesulfonate (MS-222) et la quinaldine semblent être les deux produits utilisés le plus fréquemment.
Le MS-222 est un tranquillisant très léger et les poissons se rétablissent facilement même après un long engourdissement. Horváth, Tamás et Tölg (1984) recommandent de diluer le MS-222 dans l'eau aux doses suivantes: 20 mg 1-1 pour les carpes et les carpes de roseaux; 10 mg 1-1 pour les carpes argentées; 35 mg 1-1 pour les carpes à grosse tête et les silures-glanes. A ces concentrations les poissons restent encore dans leur position naturelle mais leur respiration et leur mobilité sont nettement réduites. Le recours à cet anesthésique permet d'accroître de 50 à 150 pour cent la quantité de poissons transportés dans une unité de volume, mais il vaut mieux procéder auparavant à des essais. Woynarowich et Horváth (1980) conseillent à peu près les mêmes doses de MS-222. On met d'abord les reproducteurs dans une solution très forte c'est-à-dire 5 g de MS-222 dans 100 litres d'eau, puis au bout de 15–20 minutes, lorsque les poissons sont tout-à-fait calmés, on dilue la solution en y ajoutant de l'eau à la concentration mentionnée par Horváth, Tamás et Tölg (1984). Rzanicanin et Balcer ont constaté que des concentrations allant jusqu'à 50 mg 1-1 pouvaient être appliquées aux carpes et ont pu vérifier que le MS-222 était rapidement résorbé; à la dose de 50 mg 1-1, la concentration de MS-222 dans les muscles des poissons n'était que de 2 mg kg-1 après 15 heures et aucune trace du produit n'était signalée après 39 heures. La solution de MS-222 a été également employée avec succès par Powell (1970) à la concentration de 7 mg 1-1 pour transporter des bars d'Amérique. Dupree et Huner (1984) préconisent l'emploi de MS-222 à des concentrations allant de 20 à 200 mg 1-1 (sans donner de précisions par espèces) et affrment que la préparation doit être traitée avec une solution tampon pour obtenir la stabilité du pH à 7–8. La majorité des auteurs pensent que le MS-222 a d'excellentes propriétés anesthésiantes mais que-par ailleurs - son usage courant est relativement coûteux.
La quinaldine (2–4 méthylquinoline) est un liquide toxique qui doit donc être utilisé avec prudence. On l'administre en général aux poissons transportés quand ils sont dans beaucoup d'eau (par exemple dans un grand bac). Woynarowich et Horváth (1980) avancent que le produit est efficace à une concentration de 25 mg 1-1, tandis que Dupree et Huner (1984) indiquent une fourchette de 15–30 mg 1-1 en faisant remarquer que la quinaldine est sans doute le produit le plus pratique pour les poissons d'eau chaude, mais qu'il peut être mal toléré par les truites et quelques autres espèces.
Outre ces deux tranquillisants, d'autres produits pharmaceutiques sont employés, dont le phenoxyéthanol utilisé depuis peu comme tranquillisant pour les poissons. Il est plus léger et moins efficace que le MS-222 mais beaucoup moins cher; on compte 30–40 cm3 de phenoxyéthanol pour 100 litres d'eau afin d'obtenir une solution de traitement (Woynarowich et Horváth, 1980). Pour ce qui est des autres produits chimiques, Dupree et Huner (1984) décrivent l'utilisation de l'alcool amylique tertiaire de 1, 2 à 10, 5 ml 1-1, du méthylpentynol de 0, 4 à 2, 6 ml 1-1 et du bicarbonate de sodium à 0, 5 g 1-1.
Fereira, Schoonbee et Smit (1984) préconisent de traiter Oreochromis mossambicus avec du chlorhydrate de benzocaïne à une concentration de 25 mg 1-1. L'amytale de sodium est l'un des nombreux barbiturates hypnotiques disponibles sur le marché; il produit un effet tranquillisant progressif et durable sur les truites. Son efficacité dépend dans une certaine mesure de la température. D'après Leitritz et Lewis (1976), cette efficacité diminuerait lorsque la température dépasse 12°C, et serait optimale entre 8 et 12°C à une concentration de 7 mg 1-1. Strebkova (1971) mentionne également les bons résultats obtenus en utilisant l'amytale de sodium avec le barbital. L'acide carbonique peut aussi servir de tranquillisant. Dupree et Huner (1984) recommandent la concentration de 0, 1–0,4 mg 1-1; Mishra, Kumar et Mishra (1983) ont transporté des alevins (0,8 g) de Labeo rohita à la concentration de 0,5 ml 1-1. Le Combelen (Bayer) s'est révélé efficace pour le transport des truites; cette spécialité est un neuroleptique qui ne provoque pas directement une narcose mais réduit nettement les effets du stress sur les poissons pendant le transport (Studnicka et al., 1982); une concentration de 0,2 ml 1-1 de Combelen a donné de bons résultats pour des truites de 250–300 g placées dans de l'eau à 5°C.
Le stress dû à la manutention et la mortalité subséquente des poissons peuvent être atténués moyennant adjonction de chlorure de sodium (NaCl) et de chlorure de calcium (CaCl2) à l'eau de transport. L'ion de sodium tend à “endurcir” les poissons et à diminuer la formation de mucus alors que l'ion de calcium supprime les disfonctions osmorégulatoires et métaboliques. Dans des eaux dures, contenant déjà de fortes concentrations de calcium, il n'est pas toujours nécessaire d'ajouter du chlorure de calcium. Dupree et Huner (1984) conseillent d'ajouter de 0,1 à 0,3 pour cent de sel et 50 mg 1-1 de chlorure de calcium. Certaines espèces de poissons qui supportent bien la salinité de l'eau comme les bars d'Amérique, les tilapias et les carpes peuvent recevoir jusqu'à 0,5 pour cent de sel. Une addition de 0,2 pour cent de sel est également recommandée par Johnson (1979). Selon Hatting (1975) on devrait utiliser des doses différentes selon la température de l'eau: pour une température de 25–26°C il conseille une concentration à 0,7 pour cent, pour des températures moyennes à 0,5 pour cent et pour des températures basses à 0,3 pour cent. Powell (1970) a même obtenu de bons résultats en employant une concentration à 1 pour cent pour transporter des alevins de bar d'Amérique Roccus saxatilis. Par contre Carmichael (1984), tout en reconnaissant que le sel permet de protéger les poissons au cours du transport, déclare qu'il ne faut pas en surestimer le rôle. Quant à Amend et al. (1982) et Pecha, Berka et Kouril (1983), ils affirment clairement que rien ne prouve que le sel ait une action bénéfique sur les poissons en cours de transport.
L'utilisation de ces produits à cette fin pendant le transport des poissons est controversée. Huilgol et Patil (1975) ont essayé de l'eau oxygénée sur les alevins de carpe et ont constaté qu'avec l'addition d'une goutte (1 ml = 20 gouttes) (concentration à 6 pour cent) dans un litre d'eau la teneur en oxygène augmentait de 1,5 mg 1-1 lorsque la température était de 24°C, tandis que la teneur en CO2 et le pH restaient inchangés. L'oxygène dissous a été mesuré à l'aide de la méthode de Winkler. Astapovich (1974) et Hartman (1976) ont fait des essais dans le même sens avec le peroxodisulphate et ont relevé un enrichissement de l'eau en oxygéne en appliquant la méthode de Winkler. Máchová (1984) a examiné ces résultats et a démontré dans une étude détaillée que le peroxodisulphate K2S2O8, Na2S2O8 (NH4)2S2O8 ne dégage pas d'oxygène dans l'eau et que son utilisation pour le transport des poissons est absolument inutile. La méthode de Winkler donne des résultats peu fiables en présence d'oxydants et il vaudrait mieux employer un oxymètre.
Il existe un vaste éventail de produits bactériostatiques utilisés pour lutter contre le développement des bactéries dans les unités de transport. Les plus courants sont le nitrofurazone (furacine) à 10 mg 1-1, l'acriflavine à 1–2 mg 1-1, l'oxytetracycline (terramycine) à 20 mg 1-1, le Combiotic à 15 mg 1-1 (Dupree et Huner, 1984) et le sulphate de néomycine a 20 mg 1-1 (Amend et al., 1982). Les bactériostatiques renforcent peut-être la résistance des poissons, mais ils ne sont sans doute guère efficaces pour combattre les bactéries dans les bacs, sauf dans les rares cas d'infection superficielle par des bactéries qui y sont sensibles.
Les solutions tampons comme les “tris-buffer” (tris-hydroxylméthyl-amino méthane) servent à stabiliser le pH à un niveau favorable (7–8). L'accumulation de gaz carbonique dans les sacs fait baisser le pH, car ce gaz est un acide. Comme il faut des doses de 2,2 à 4,1 g 1-1 (Johnson, 1979; Amend et al., 1982) ou de 1,1 à 2,2 g 1-1 (Dupree et Huner, 1984) de “tris-buffer” pour agir sur le pH dans des sacs modérement remplis, le coût de ces produits en interdit généralement l'utilisation.
Afin de réguler la concentration d'ammoniac dans les sacs en cas de transport sur de longues distances, on recommande l'utilisation de clinoptilolite, minéral zéolithe. Amend et al. (1982) ont obtenu des résultats probants avec une dose de 14 g de clinoptilolite par litre, Bower et Turner (1982), ont essayé pour leur part des doses de 10–40 g 1-1; la concentration d'azote ammoniacal non-ionisé n'a jamais dépassé 0,017 mg 1-1 dans les sacs contenant une dose même infime de clinoptilolite alors que des concentrations allant jusqu'à 0,074 mg 1-1 ont été enregistrées dans les sacs témoins sans clinoptilolite.
La formation de mousse et d'écume, notamment lorsqu' on recourt à des produits pharmaceutiques pour transporter des poissons ou lorsque l'eau contient une forte quantité de déchets organiques (sécrétions et excrétions comme le mucus et les excréments) pose souvent des problèmes. La mousse en effet forme une couche entre l'oxygène et la surface de l'eau et rend également difficile l'observation des poissons. Avec du NaCl l'eau mousse moins, mais l'efficacité des antimoussants risque de s'en ressentir un peu. Parfois, on se sert d'une solution à 10 pour cent de Dow Corning Antifoam AF Emulsion à raison de 0,05 ml 1-1 (Leitritz et Lewis, 1976; Dupree et Huner, 1984). Les antimoussants ne présentent pas de gros avantages, mais ont quand même le mérite de garder l'eau claire et par conséquent de faciliter l'observation des poissons.